血浆纤维蛋白降解产物对出血性脑卒中患者早期预后的评估价值
陈旭光,施晟懿,胡岚,陈瑜,陆一鸣,叶静
上海交通大学医学院附属瑞金医院北院急诊科,上海201800
出血性脑卒中(hemorrhagic stroke,HS)包括脑内出血(intracerebral hemorrhage,ICH)、原发性脑室出血(primary intraventricular hemorrhage,PIVH)和蛛网膜下腔出血(subarachnoid hemorrhage,SAH),早期死亡率较高,是世界范围内主要的死亡原因之一。一项纳入30个研究包含7 736例HS的meta分析[1]显示,ICH的30 d全因死亡率为36.3%;另一项基于人群的大型卒中研究[2]显示,美国SAH的30 d死亡率为25%~46%。2017年,全球HS死亡人数占全因死亡人数的6.1%[3]。已有研究[4-5]证实ICH、SAH引起的局部脑损伤可导致全身性凝血激活和纤溶亢进,而凝血激活和纤溶亢进均可能导致出血进展;HS患者的早期死亡与血肿基线体积、血肿进展、血肿脑室内扩展密切相关[1,6],因此,我们认为凝血激活和纤溶亢进可能和HS患者早期死亡相关。纤维蛋白降解产物(fibrin degradation product,FDP)作为纤溶亢进的标志性产物,是否可用于评估HS患者的早期死亡风险尚不确定。基于此,本研究对上海交通大学医学院附属瑞金医院北院急诊科就诊的640例HS患者的临床资料进行回顾性研究,分析血浆FDP水平与HS患者平均住院时间14 d内死亡的相关性,探讨凝血激活和纤溶亢进对HS预后的影响,以期为临床评估HS患者的早期预后提供参考。
1 对象与方法
1.1 研究对象及分组
选取2017年5月1日—2020年5月1日就诊于上海交通大学医学院附属瑞金医院北院急诊科的HS患者。纳入标准:①HS的诊断符合美国心脏协会/美国卒中协会相关标准[7]。②年龄>18岁。③首次发病。④在发病24 h内获得血浆FDP水平的相关数据。排除标准:①凝血异常导致脑出血。②梗死后出血。③存在颅内肿瘤或血栓性疾病。④合并外伤。本研究已通过上海交通大学医学院附属瑞金医院北院伦理委员会审批,审批号为(2019)瑞北伦审第(002-2)。
根据出血类型,将患者分为ICH组、PIVH组和SAH组。根据是否合并脑室出血(intraventricular hemorrhage,IVH)、SAH,再将ICH组分为单纯血肿亚组、合并IVH(ICH+IVH)亚组、合并SAH(ICH+SAH)亚组、合并IVH和SAH(ICH+IVH+SAH)亚组。根据患者是否在发病14 d内死亡分为死亡组和存活组。
1.2 资料收集
由2名研究人员收集患者的一般资料、基线实验室指标、手术情况及14 d预后信息。一般资料包括年龄、性别、出血类型,以及入院时的收缩压(systolic blood pressure,SBP)、舒 张 压(diastolic blood pressure,DBP)、格拉斯哥昏迷量表(Glasgow Coma Scale,GCS)得分、Graeb脑室内出血评分;基线实验室指标包括血浆FDP、葡萄糖(glucose,Glu)、钙(calcium,Ca)、白细胞计数(white blood cell,WBC)、血小板计数(platelet,PLT)、国际标准化比值(international normalized ratio,INR)、肌酐(creatinine,Cr)、谷丙转氨酶(glutamicpyruvic transaminase,GPT)、肌 钙 蛋 白I(cardiac troponin I,cTnI)、C-反 应 蛋 白(C-reactive protein,CRP);手术情况及14 d预后信息包括患者入院后是否接受手术治疗,发病14 d内死亡或存活信息。
所有患者入院1 h内接受层厚为5 mm的头颅CT检查。中线结构偏离额顶骨正中骨脊连线超过5 mm视为中线移位。ICH患者的出血部位分为幕上、脑干、小脑;计算脑实质血肿体积(V),即V=abc/2,其中a是最大出血直径,b是同一层面内垂直于a的最大直径,c是出血层面数。PIVH患者脑室出血量采用Graeb评分,CT表现侧脑室(每侧侧脑室分别记分)有微量或少量出血为1分,出血小于脑室1/2者为2分,出血大于脑室1/2者为3分,脑室内充满血液并扩大为4分;第三脑室有积血但脑室未膨胀为1分,充满血液且脑室膨胀为2分;第四脑室有积血但脑室未膨胀为1分,充满血液且脑室膨胀为2分;最后将各脑室得分相加,最高为12分。
1.3 统计学分析
采用SPSS 23.0软件进行数据处理。定性资料以频数(百分率)表示,采用χ2检验进行组间分析。符合正态分布的定量资料以x±s表示,采用独立样本t检验进行组间比较;不符合正态分布的定量资料以M(Q1,Q3)表示,采用Mann-Whitney U检验进行组间比较。采用受试者操作特征曲线(receiver operator characteristic curve,ROC曲线)建立连续性变量最佳预测预后的截断点,并行多因素Logistic分析,以确定14 d内死亡的独立危险因素。P<0.05表示差异具有统计学意义。
2 结果
2.1 研究对象的整体情况
本研究共纳入HS患者640例,其中失访19例、数据缺失15例,最终纳入606例。患者的平均年龄为(58.9±15.1)岁,其中男性405例,女性201例。按出血部位分,ICH组493例、PIVH组32例、SAH组81例;ICH组中出血部位位于幕上、脑干、小脑的患者分别为436、33和24例;ICH组中单纯血肿亚组254例,ICH+IVH亚组142例,ICH+SAH亚组49例,ICH+IVH+SAH亚组48例。所有患者中位GCS得分为11(8,13)分,ICH组中位血肿体积为10(4,27)mL,PIVH组中位Graed得分为6(4,9)分。共有124例 患者(ICH组82例、PIVH组6例、SAH组36例)接受手术治疗。有85例患者在发病14 d内死亡。
2.2 发病14 d内存活与死亡患者的比较
与14 d存活患者相比,死亡患者的年龄更大,GCS得分更低,中线偏移者比例更高,血浆FDP水平、血糖水平更高,白细胞计数更大,差异均有统计学意义(均P<0.05,表1)。
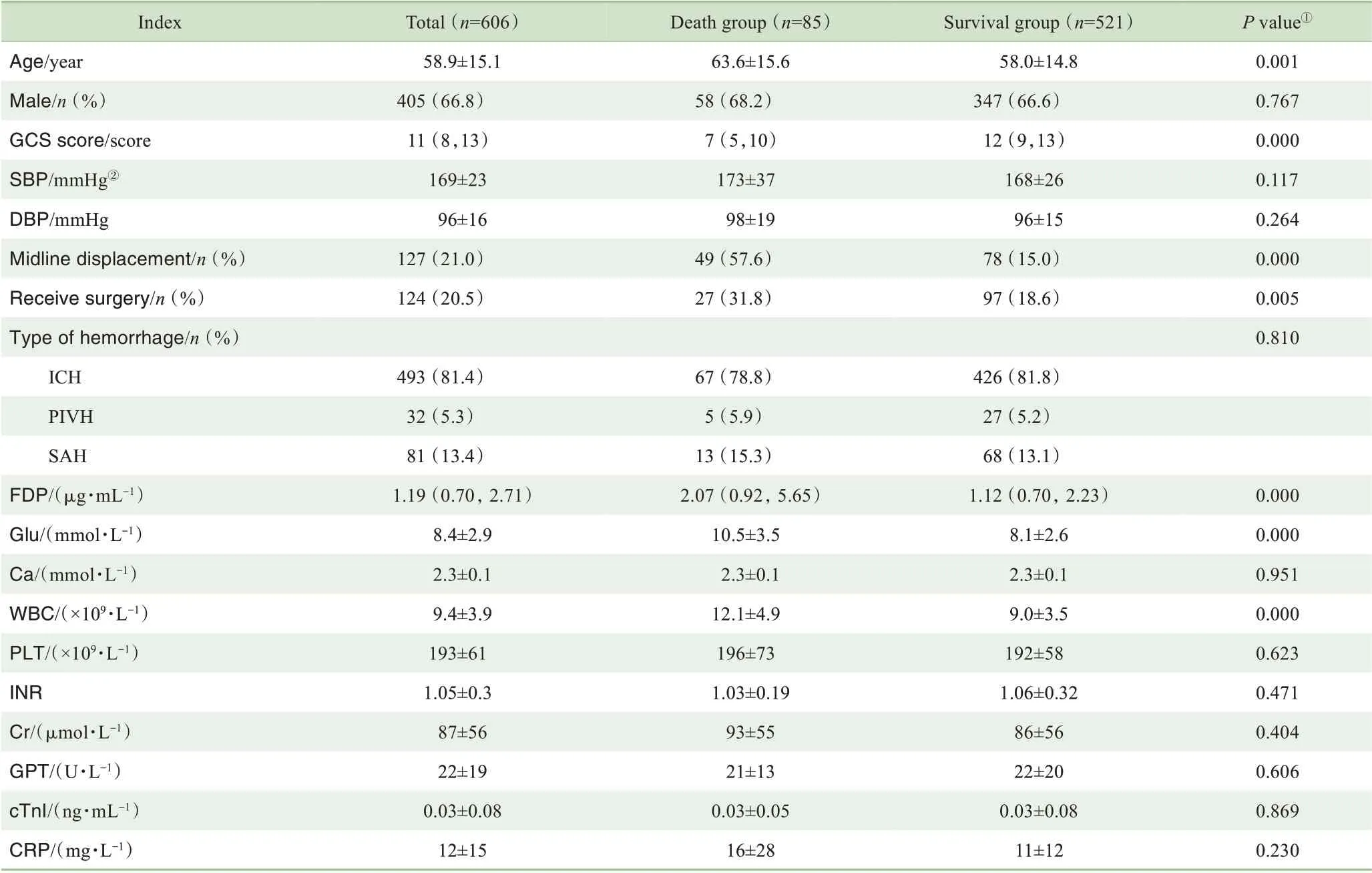
表1发病14 d内存活和死亡患者的基线临床特征比较Tab 1 Comparison of baseline clinical characteristics between surviving and dead patients within 14 d after onset
2.3 血浆FDP对患者14 d内死亡的评估价值
获得血浆FDP预测患者14 d内死亡的最佳截断值为2.78μg/mL,血浆FDP>2.78μg/mL预测出血性脑卒中患者14 d内死亡的敏感度为45.6%,特异度为80.3%;曲线下面积(area under the curve,AUC)为0.648(95%CI 0.585~0.710),小 于GCS评 分<11分 的AUC(AUC=0.790,95%CI 0.736~0.843),但大于年龄>64岁(AUC=0.604,95%CI 0.538~0.669)、血糖>8.7 mmol/L(AUC=0.610,95%CI 0.544~0.676)和WBC>8.76×109/L(AUC=0.632,95%CI 0.566~0.698)的AUC(图1)。
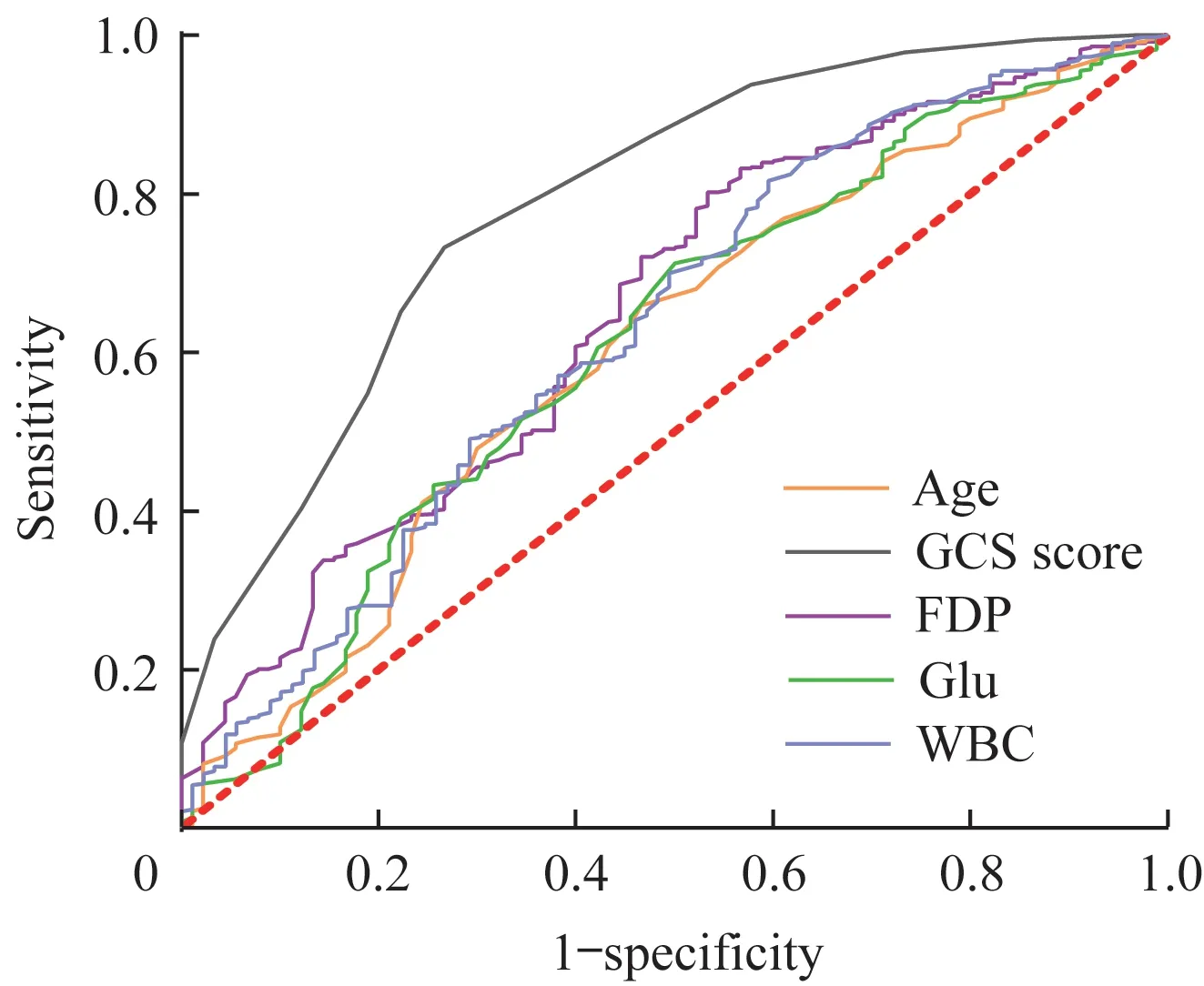
图1各指标判断HS患者14 d内死亡的ROC曲线Fig 1 ROC curve of death within 14 d in HS patients
2.4 多因素Logistic回归分析结果
将患者14 d内是否死亡作为因变量,接受手术、中线 偏 移、FDP>2.78μg/mL、GCS评 分<11分、年 龄>64岁、Glu>8.7 mmol/L、WBC>8.76×109/L作为自变量纳入多因素Logistic回归分析,结果(表2)显示中线偏移、FDP>2.78μg/mL、GCS评分<11分、年龄>64岁、Glu>8.7 mmol/L是患者14 d内死亡的独立危险因素(R2=0.143,调整R2=0.256),而接受手术、WBC与因变量无相关性。
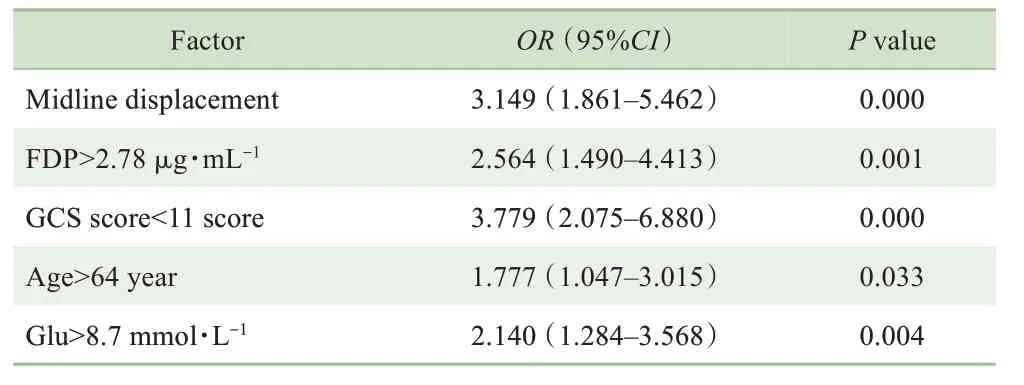
表2 HS患者14 d内死亡危险因素的多因素Logistic分析Tab 2 Multivariate Logistic regression analysis of risk factors for death within 14 d of HS patients
2.5 分组分析结果
分别分析ICH组、PIVH组、SAH组中14 d内存活和死亡患者间血浆FDP水平的差异,结果(图2)发现ICH组中,14 d内死亡患者的血浆FDP水平[2.09(1.00,5.34)μg/mL]显著高于存活者的FDP水平[1.06(0.70,1.86)μg/mL,P=0.000];PIVH组中,14 d内死亡患者的血浆FDP水平[4.25(1.49,5.91)μg/mL]也显著高于存活者[1.20(0.64,2.30)μg/mL,P=0.041];而SAH组中14 d内死亡和存活患者的FDP水平间差异无统计学意义。
2.6 ICH亚组分析结果
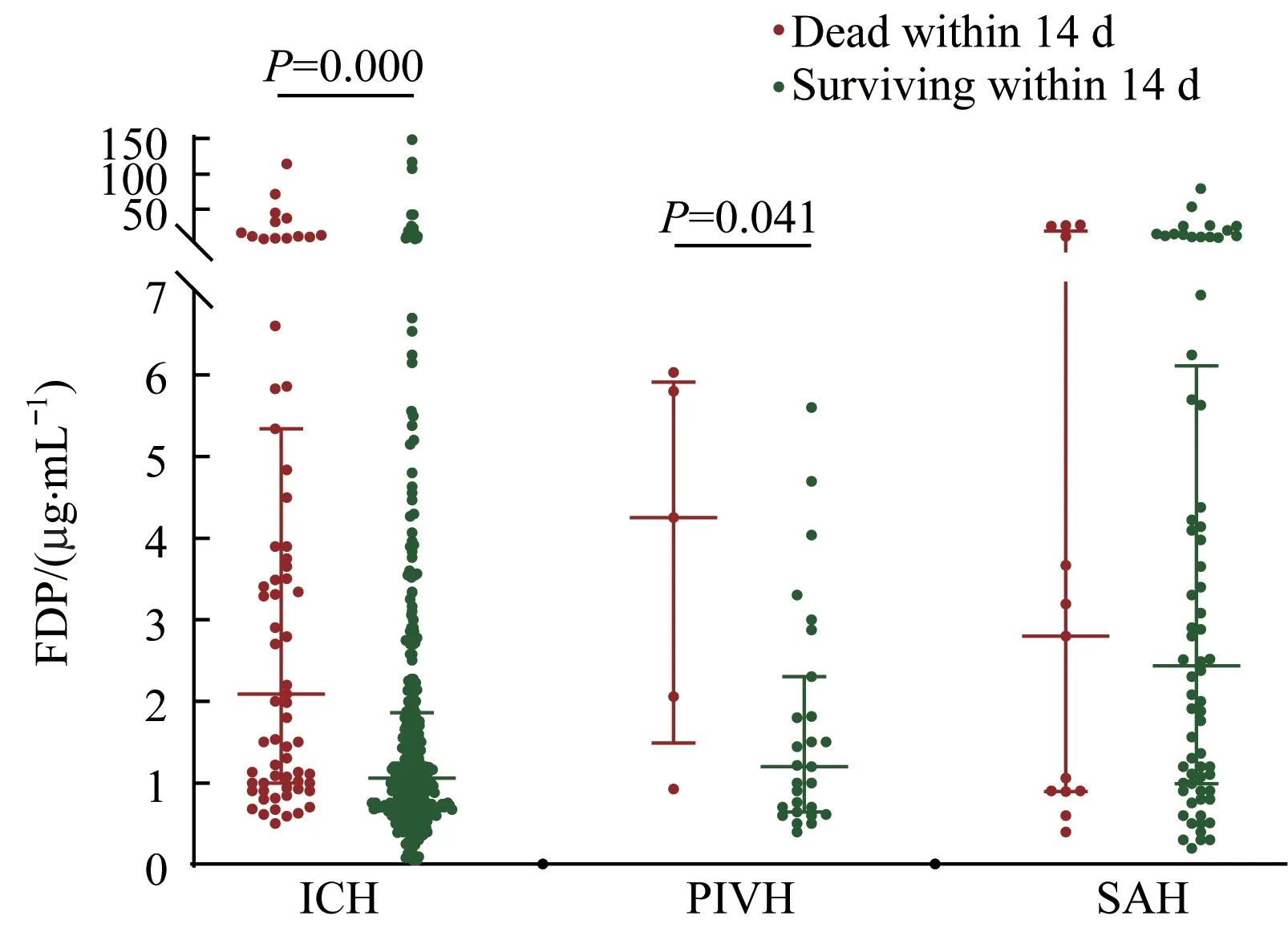
图2不同类型HS患者14 d内死亡与存活患者血浆FDP水平的比较Fig 2 Comparison of the plasma FDP levels between the patients who died within 14 d and those who survived in the different types of HS
对ICH组中4个亚组血浆FDP水平进行分析,结果(图3)发现在ICH+IVH亚组中,14 d内死亡患者的FDP水平[2.09(1.00,5.58)μg/mL]显著高于存活者[1.26(0.90,2.21)μg/mL,P=0.027]。而在单纯血肿亚组、ICH+SAH亚 组、ICH+IVH+SAH亚 组,14 d内 死 亡 患 者血浆FDP水平略高于存活者,但差异无统计学意义。
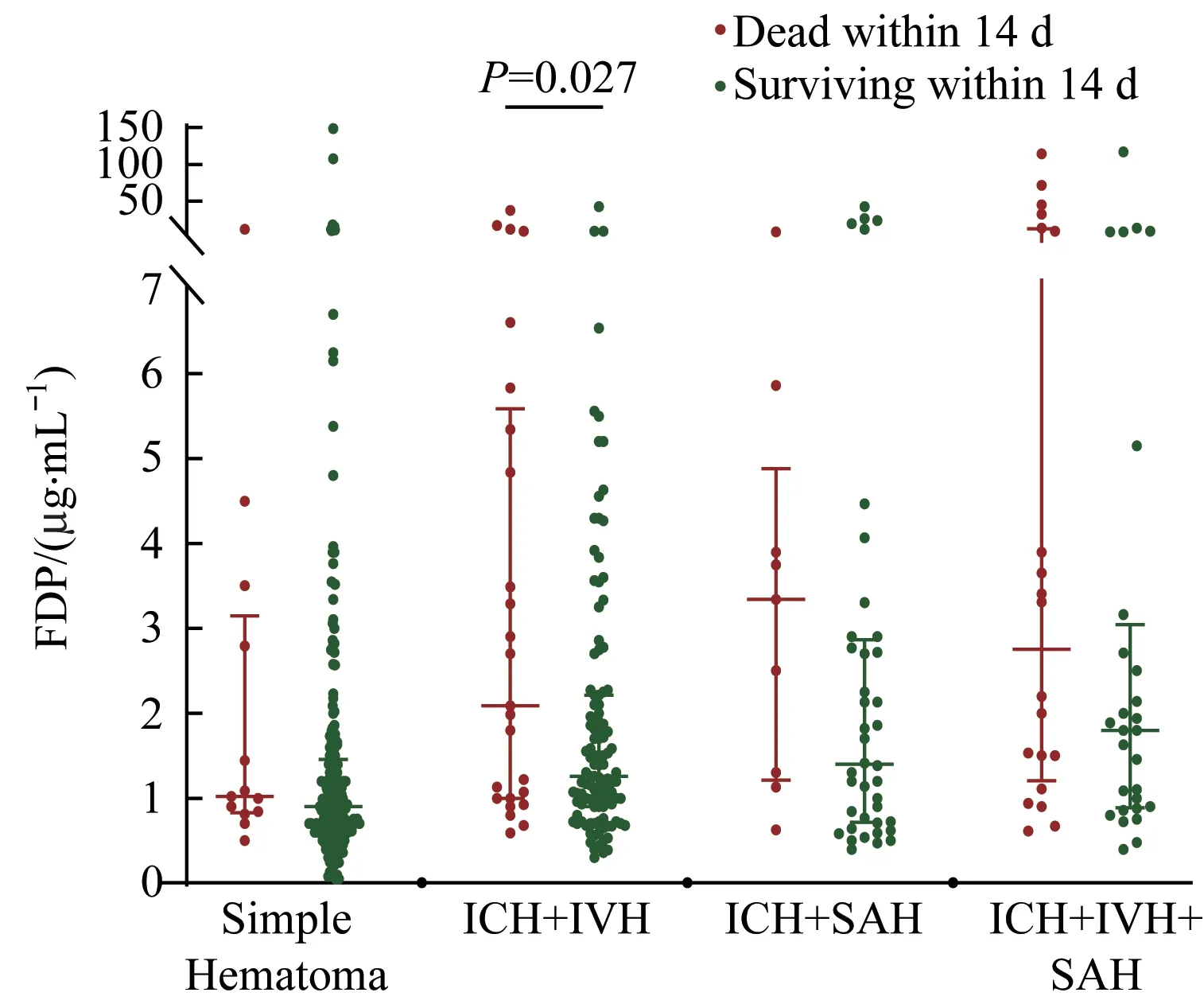
图3 ICH组的4个亚组中14 d内死亡与存活患者血浆FDP水平的比较Fig 3 Comparison of plasma FDP levels between the patients who died within 14 d and those who survived in four subgroups of ICH group
3 讨论
本研究证实血浆FDP水平在早期死亡的HS患者中显著升高,血浆FDP>2.78μg/mL是HS患者14 d内死亡的独立危险因素,进一步分组分析发现血浆FDP水平可能在PIVH或ICH合并IVH的患者中对早期死亡的预测价值更大。
早在2001年Fujii等[5]发现合并IVH或SAH的ICH患者血液中凝血酶-抗凝血酶复合物、纤溶酶-抗纤溶酶复合物显著升高,2014年Kawano-Castillo等[8]通过血栓弹力图检测发现ICH患者比健康者血凝块形成的速度更快,凝血反应更强,这些均提示HS后凝血系统被激活。Chen等[9]通过测定ICH合并IVH患者脑脊液中D-二聚体的动态变化,证实纤溶系统活性可预测HS预后;血浆FDP水平是反映全身纤溶系统活性的敏感指标,因此它可能可以间接反映脑出血的预后。血浆D-二聚体是FDP的一种,它和血浆FDP水平有很好的相关性,但因为检测方法的原因D-二聚体比FDP更易受其他因素干扰[10-11],因此本研究选择使用FDP来评估纤溶系统活性。
分组分析发现,在ICH组、PIVH组,血浆FDP水平在14 d内死亡和存活患者间存在差异,而在SAH组中则未观察到;这与Boluijt等人[12]的研究一致,原因可能为SAH后无纤维蛋白溶解[13]。但也有研究[5,14-16]认为SAH后存在纤溶激活,且纤溶产物水平的升高可能与并发症和不良预后相关。因此血浆FDP水平是否能预测SAH患者的预后尚存争议。
ICH亚组分析发现,血浆FDP水平只在合并IVH亚组中与14 d内患者死亡与否有关,这可能和脑实质内血肿只能激活局部凝血系统,而当血液进入脑室后可激活全身凝血系统有关。IVH的相关研究[5,17-18]表明,凝血级联反应的成分可以独立地诱发脑损伤:如凝血酶可以激活小胶质细胞,诱发星形胶质细胞增生并破坏血脑屏障,引起血管性水肿;纤维蛋白原转化为纤维蛋白后,形成的血凝块会阻碍脑脊液循环,纤维蛋白原释放到脑室中可诱导强大的炎症反应,通过CD11b/CD18受体激活小胶质细胞,引发脑损伤。因此在IVH中,血浆FDP可能通过反映凝血级联反应造成的脑损伤程度来预测预后,而单纯脑实质血肿未发生上述凝血级联反应造成的脑损伤,导致血浆FDP水平与预后无明显相关。
总之,本研究发现血浆FDP高水平可能预示HS患者14 d内死亡风险较高,这种评估价值可能仅存在于PIVH或ICH合并IVH患者中。早期准确地评估HS的死亡风险,对临床正确决策以改善预后至关重要。后续我们将收集更多HS患者,尤其是PIVH患者以及ICH合并IVH患者样本,进一步明确血浆FDP水平评估其早期预后的准确性。
参·考·文·献
[1]Pinho J,Costa AS,Araújo JM,et al.Intracerebral hemorrhage outcome:a comprehensive update[J].J Neurol Sci,2019,398:54-66.
[2]MacKey J,Khoury JC,Alwell K,et al.Stable incidence but declining casefatality rates of subarachnoid hemorrhage in a population[J].Neurology,2016,87(21):2192-2197.
[3]GBD 2017 Causes of Death Collaborators.Global,regional,and national age-sex-specific mortality for 282 causes of death in 195 countries and territories,1980-2017:a systematic analysis for the Global Burden of Disease Study 2017[J].Lancet,2018,392(10159):1736-1788.
[4]Lauridsen SV,Hvas AM,Sandgaard E,et al.Coagulation profile after spontaneous intracerebral hemorrhage:a cohort study[J].J Stroke Cerebrovasc Dis,2018,27(11):2951-2961.
[5]Fujii Y,Takeuchi S,Harada A,et al.Hemostatic activation in spontaneous intracerebral hemorrhage[J].Stroke,2001,32(4):883-890.
[6]Abulhasan YB,Alabdulraheem N,Simoneau G,et al.Mortality after spontaneous subarachnoid hemorrhage:causality and validation of a prediction model[J].World Neurosurg,2018,112:e799-e811.
[7]Sacco RL,Kasner SE,Broderick JP,et al.An updated definition of stroke for the 21st century[J].Stroke,2013,44(7):2064-2089.
[8]Kawano-Castillo J,Ward E,Elliott A,et al.Thrombelastography detects possible coagulation disturbance in patients with intracerebral hemorrhage with hematoma enlargement[J].Stroke,2014,45(3):683-688.
[9]Chen CW,Wu EH,Huang J,et al.Dynamic evolution of D-dimer level in cerebrospinal fluid predicts poor outcome in patients with spontaneous intracerebral hemorrhage combined with intraventricular hemorrhage[J].J Clin Neurosci,2016,29:149-154.
[10]Kogan AE,Mukharyamova KS,Bereznikova AV,et al.Monoclonal antibodies with equal specificity to D-dimer and high-molecular-weight fibrin degradation products[J].Blood Coagul Fibrinolysis,2016,27(5):542-550.
[11]Wu Y,Xiao YX,Huang TY,et al.What makes D-dimer assays suspiciousheterophilic antibodies?[J].J Clin Lab Anal,2019,33(2):e22687.
[12]Boluijt J,Meijers JC,Rinkel GJ,et al.Hemostasis and fibrinolysis in delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage:a systematic review[J].J Cereb Blood Flow Metab,2015,35(5):724-733.
[13]Lauridsen SV,Hvas CL,Sandgaard E,et al.No hyperfibrinolysis following subarachnoid or intracerebral haemorrhage:a prospective cohort study[J].Blood Coagul Fibrinolysis,2019,30(7):341-349.
[14]Fukuda H,Lo B,Yamamoto Y,et al.Plasma D-dimer may predict poor functional outcomes through systemic complications after aneurysmal subarachnoid hemorrhage[J].J Neurosurg,2017,127(2):284-290.
[15]Larsen CC,Hansen-Schwartz J,Nielsen JD,et al.Blood coagulation and fibrinolysis after experimental subarachnoid hemorrhage[J].Acta Neurochir(Wien),2010,152(9):1577-1581.
[16]Ji Y,Meng QH,Wang ZG.Changes in the coagulation and fibrinolytic system of patients with subarachnoid hemorrhage[J].Neurol Med Chir(Tokyo),2014,54(6):457-464.
[17]Garton T,Hua Y,Xiang JM,et al.Challenges for intraventricular hemorrhage research and emerging therapeutic targets[J].Expert Opin Ther Targets,2017,21(12):1111-1122.
[18]Wilkinson DA,Pandey AS,Thompson BG,et al.Injury mechanisms in acute intracerebral hemorrhage[J].Neuropharmacology,2018,134(Pt B):240-248.

