不同促生剂对红花玉兰娇红2号苗木移栽生长的影响1)
王延双 赵秀婷 段劼 马履一 朱仲龙 何宝华 桑子阳
(北京林业大学,北京,100083)(北京西山国家森林公园)(五峰博翎红花玉兰科技发展有限公司)
对于具有极高观赏价值的园林绿化类树木,移栽是短期快速成景的主要手段[1-2]。移栽过程包括移栽苗的选择和挖取、移栽时间、运输存放、移栽地气候条件以及移栽后的栽植与养护,任何环节发生失误都会使苗木成活率降低,导致观赏时间被推滞、观赏价值削弱,进而造成经济损失[1]。由于苗木的生长习性以及栽植地环境因素的变化,苗木移栽后会出现不同程度的缓苗现象。缓苗是苗木经过移栽或生长环境改变,重新适应新环境而恢复正常生长状态的过程[3]。根系损伤的严重程度是影响移栽缓苗期长短的重要原因[4-5]。关于移栽和缓苗的研究多集中在农作物的棉花[6-9]、烟草[10]、茶[11]、甘薯[12],以及园林植物栽植技术[13-15]和影响植物移栽生长的胁迫因素[16]。
红花玉兰(Magnoliawufengensis)是马履一等[17]在湖北省五峰县发现的木兰科玉兰亚属植物新种。娇红2号(见图1)属红花玉兰系列新品种,荷花型,花期早,花被12~14片,且花瓣内外均为粉红色、腹面颜色略淡。红花玉兰为肉质浅根,喜有机质、疏松、微酸或中性土壤,对生长环境要求较高。娇红2号具有极高观赏价值,2014年被审定为省级林木良种。目前对红花玉兰播种、嫁接育苗[18-19]、区域化引种和抗逆等栽培技术开展了研究[20-24]。但是娇红2号苗木在移栽后1~2 a出现生长停滞、叶片枯萎等缓苗现象[25],针对缩短苗木移栽缓苗期、缓苗生长过程、缓苗根系特征的研究还未报道。为此,本文对娇红2号施用ABT-1号生根粉和EM菌剂后移栽生长过程进行研究,以探求促进根系生长、提高光合能力和维持保护酶系统的活性等措施缩短缓苗期,为红花玉兰娇红2号的引种推广提供科学依据与技术支撑。

图1 红花玉兰娇红2号花部形态
1 材料与方法
1.1 材料与试剂
试验地点位于北京市海淀区西山国家森林公园温室内。温室内有完善的降温、保温、遮荫、补光、增湿、灌溉等装置,可充分满足苗木的生长。
试验材料为1年生娇红2号嫁接苗。2019年3月3日,由湖北五峰运至北京西山国家森林公园。运输前将苗木根系用水浸润并用塑料薄膜包裹根部,防止根系失水。2019年3月4日将长势基本一致的裸根苗木栽在底部有孔的花盆(盆高32 cm、直径36 cm)中。采用草炭土(丹麦进口草炭土pH=5.5)和沙土(土壤密度1.847 7 g·cm-3;体积比1∶1)作为供试土壤。运用ABT-1号生根粉和农富康EM菌剂(生物复合菌液,主要成分为:地衣芽孢杆菌、乳酸菌、枯草芽孢杆菌、酵母菌、粪肠球菌等多种益生菌及生物酶)进行处理。
1.2 试验设计
将苗木随机分成9组,共设置9个处理,2019年3月4日开始进行试验。
设置对照(CK),ABT-1生根粉各处理的质量分数分别为50×10-6(A1)、100×10-6(A2)、150×10-6(A3)、300×10-6(A4),EM菌剂各处理的质量分数分别为2×10-6(B1)、3×10-6(B2)、5×10-6(B3)、10×10-6(B4),每个处理10株,重复3次。分别于5月(M5)、7月(M7)、9月(M9)进行生长和生理指标的采样与测定。
1.3 取样与指标测定
移栽存活率:于2019年11月初对各处理植株的存活株数进行统计,计算移栽存活率。
生长指标的测定:分别于5月、7月、9月对每个处理的所有植株,利用卷尺和数显游标卡尺分别测定苗高和地径,并计算苗高、地径的相对生长量。苗高相对生长量(y)公式为y=(y2-y1)/y1;地径相对生长量(z)公式为z=(z2-z1)/z1。式中:y1为上一测定时间点苗高,y2为当前时间点苗高,z1为上一测定时间点地径,z2为当前时间点地径。
根系形态结构:每个处理破坏性选取3株苗木,取样时为保证根系的完整性,剪开塑料花盆,将根系浸在水中并轻轻抖动,使根系与土壤分离。获取的整个根系用去离子水冲洗干净,放置在装有冰块的透明托盘上,按照Pregitzer et al.[23]的根序分级法,将其分别放入盛有冰水的对应托盘中,用镊子取下不同根序的根,查数每一级别细根数量。用扫描仪(EPSON PERFECTION V750 PRO)扫描分级后各个根序的根样,用WinRHIZO Pro 2004a对图片进行分析,计算分析根系长度、根系数量、根系体积等指标。扫描后的根系用纸包好放于烘箱中,65 ℃烘干至恒质量,用于生物量的计算。
光合生理指标:分别于5月、7月、9月初选取晴朗的一天,测定仪器为美国Li-cor公司生产的Li-6400XT,选取植株上层健康的叶片,测定净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)等参数。
保护酶活性指标:每个处理随机选取3株苗木的上层成熟健康的叶片,取下后立刻过液氮并置于干冰中暂时储存,带回实验室,放置于-80 ℃超低温冰箱保存。超氧化物歧化酶(SOD)活性采用NBT还原法测定[24],过氧化酶(POD)活性采用愈创木酚显色法测定[25],丙二醛(MDA)的质量摩尔浓度采用硫代巴比妥酸法测定[26]。
1.4 数据统计与分析
利用Microsoft Excel 2010进行数据的整理统计并制图,用SPSS22对不同处理之间的试验数据进行方差分析,并运用Duncan检验法确定每个指标在处理间差异的显著性。
2 结果与分析
2.1 不同处理下娇红2号苗木存活及生长特性
2.1.1 不同处理下娇红2号移栽成活率
当年苗木生长末期,B1、B2处理苗木存活率均为100%,A1、A2处理苗木成活率均为96.77%,B3处理为93.33%,A3、A4、B4处理和对照的苗木成活率均为90%。可见,娇红2号施用低浓度的ABT-1生根粉和EM菌剂比对照成活率显著提高。
2.1.2 不同处理下娇红2号苗高地径生长特性
由表1可知,各处理的结果苗高均存在差异。5—9月份,苗高相对生长量平均值分别为0.063 1、0.021 2、0.018 4。三次采样数据分析发现,3—5月份的数据中,A1处理最好,苗高相对生长量达到0.081 1,但与其余各处理无显著差异(P>0.05);5—7月份的数据中,A2处理最好,苗高相对生长量达到0.023 9。7—9月份的数据中,A1处理表现较好,苗高相对生长量达到0.028 4,各处理间均无显著差异(P>0.05)。
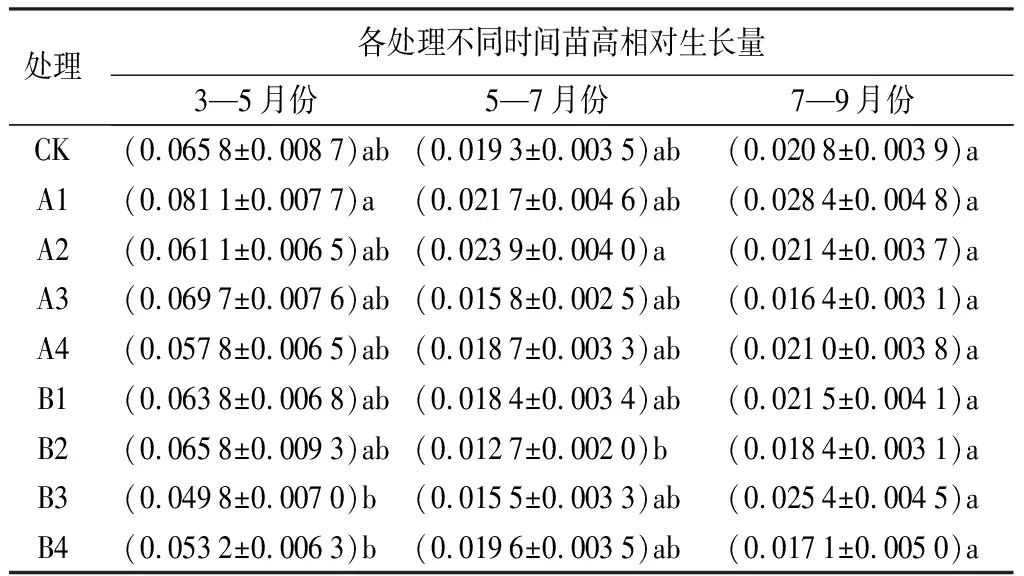
表1 不同处理下娇红2号苗高相对生长量变化
由表2可知,不同处理对娇红2号地径的影响存在差异。各处理苗木地径的相对生长量波动幅度在3—5月份间最为明显,3个阶段地径相对生长量平均值分别为0.049 1、0.038 3、0.034 1。三次采样数据分析发现,3—5月份的数据中,A4处理的地径相对生长量最大为0.064 7;5—7月份的数据中,A2处理的相对生长量最大为0.054 8;7—9月份的数据中,CK相对生长量最大为0.045 5,但各处理无显著差异(P>0.05)。
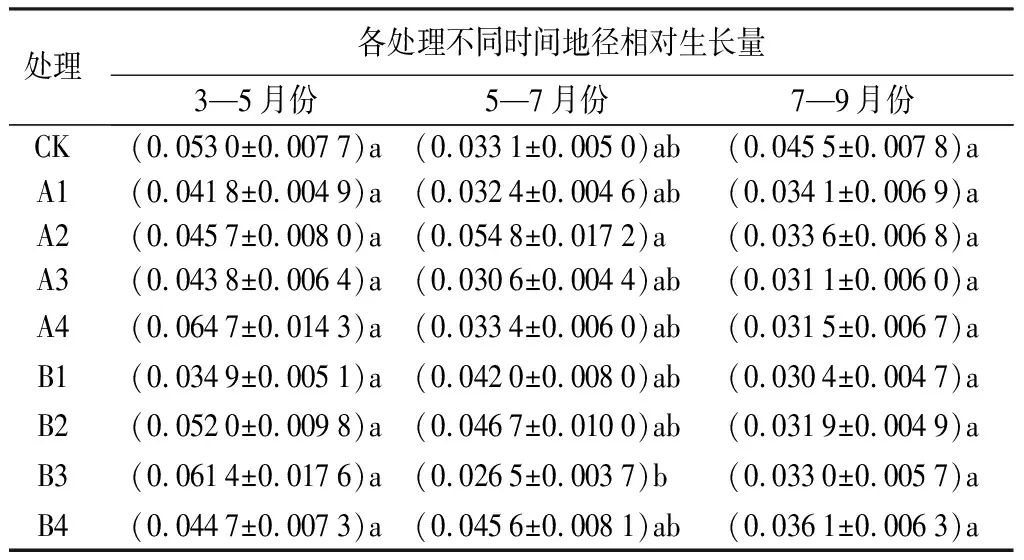
表2 不同处理下娇红2号地径相对生长量变化
通过对不同处理不同时间的苗高和地径的数据分析,A1处理对苗高生长的促进作用较好,A4处理对苗木地径生长的促进作用较好。地径与苗高,均在3—5月份有较高的生长量,但是苗木高生长对试剂处理的反应较为敏感,在3—5月份就已经表现出差异;各处理与对照间地径生长的差异在5—7月份才显现出来。各处理苗木的生长差异体,现了各处理在缓苗期的作用程度。此时推测,缓苗期间的3—5月份苗木主要体现高生长,5—7月份主要体现径生长。
2.2 不同处理下娇红2号根系形态特征
2.2.1 新生根系数量变化特征
由表3可知,5月份,苗木新生根数量较少,新生根数量最多的A4处理为109条,新生根数量最少的CK为3条,A4处理与A2处理、A3处理差异不显著(P>0.05),与其他处理均差异显著(P<0.05);7月份,苗木新生根数量增多,新生根数量最多的A2处理为1 188条,新生根数量最少的CK为252条,且A2处理与CK差异显著(P<0.05),与其他处理无显著差异(P>0.05);9月份,苗木新生根数量显著增加,新生根数量最多的处理是A3达到2 354条,新生根数量最少的B2处理为429条,各处理间只有A3和B2差异显著(P<0.05)。
分析发现,施加ABT处理的苗木比施加微生物菌剂的苗木,在5—7月份能更好地促进苗木根系的新生,且与未施加处理的苗木差异显著。直到苗木生长到9月份,苗木根系数量最多的是A3处理,除B2处理外,各处理间均无显著差异,说明此时苗木已经度过缓苗期。
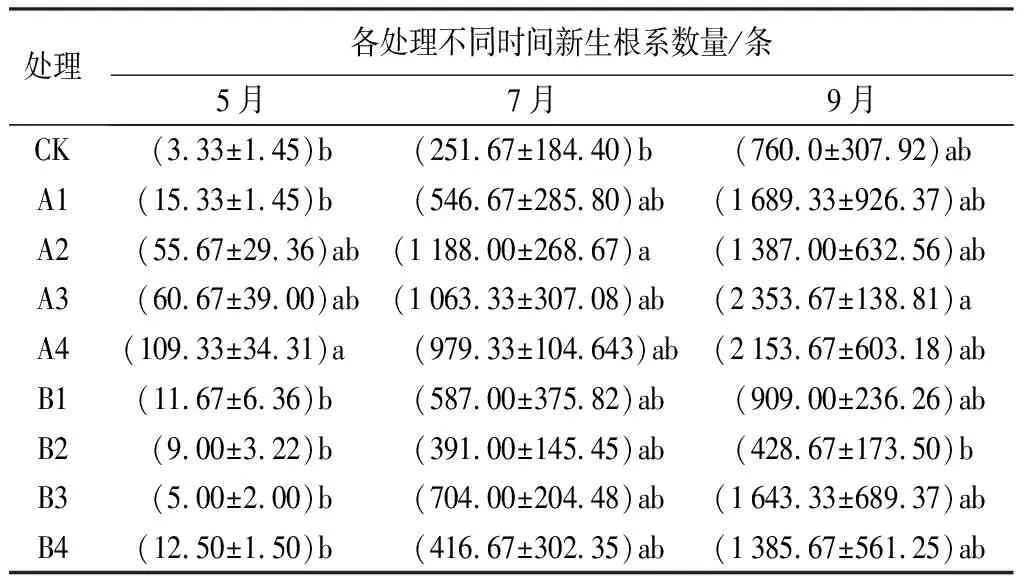
表3 不同处理下娇红2号新生根系数量变化
2.2.2不同处理下娇红2号的根长、根表面积、根体积的特征
由表4可知,各处理苗木的一级根根长、根表面积和根体积差异均不显著(P>0.05),表明各处理对苗木的主要作用并不是促进一级细根的分化。
由表5可知,7月份,A3处理的苗木的二级根根长、根表面积和根体积分别为1 463.107 5 cm、239.950 0 cm2、4.088 8 cm3,苗木二级根根长、根表面积与CK差异显著(P<0.05);9月份,A3处理苗木二级根根长、根表面积分别为2 949.684 1 cm、483.064 2 cm2,与CK差异显著(P<0.05);虽然A4处理的根体积值最大,为8.064 8 cm3,但与A3处理差异不显著(P>0.05),与CK差异显著(P<0.05)。
由表6可知,不同处理苗木三级细根总L3、总S3和总V3特征。7月份,A4处理最好,苗木的三级细根根长、根表面积和根体积分别为796.679 8 cm、183.825 2 cm2、4.957 4 cm3,与A3差异不显著,但与CK差异显著;9月份,A3处理最好,苗木的三级细根根长、根表面积和根体积分别为902.509 4 cm、214.351 1 cm2、6.093 4 cm3。综合苗木新生根系数量以及二三级细根特征来看,A3处理较其他处理能明显促进娇红2号新生根萌发,并通过调节二级以及三级细根的分化,增加其根长、根表面积、根体积来保证植物对营养和水分的吸收运输。

表4 不同处理下娇红2号一级根特征
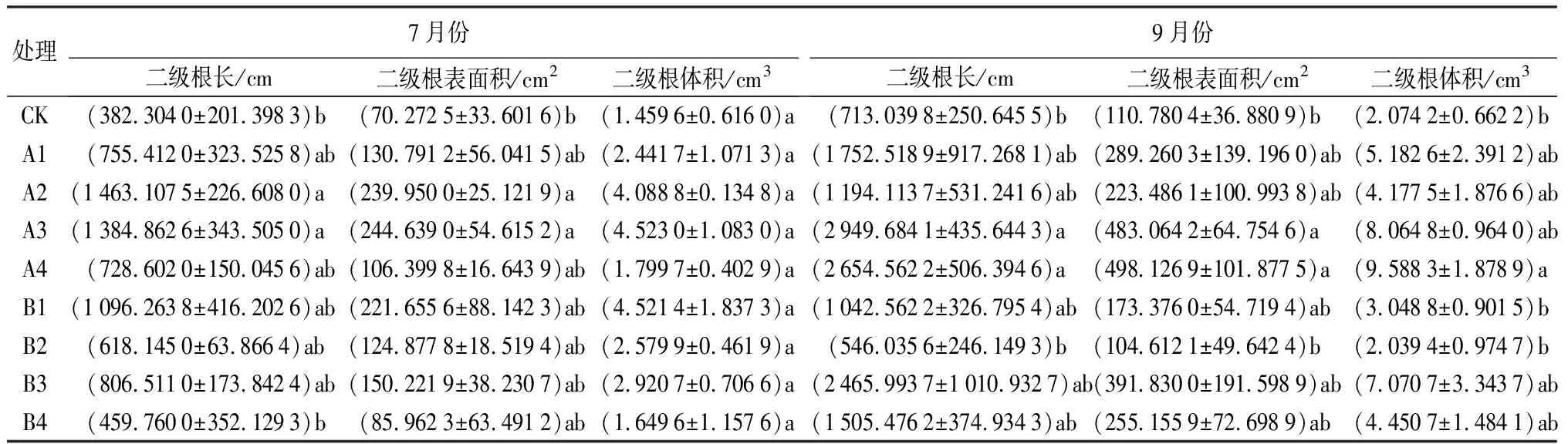
表5 不同处理下娇红2号二级细根特征

表6 不同处理下娇红2号三级细根特征
2.3 不同处理下娇红2号苗木光合生理特性
如表7所示,不同处理对苗木净光合速率的影响表现为:5、7、9月份各处理间具有相同的变化趋势,变动幅度由小变大再变小。5月份,A4处理的净光合速率最大(5.128 0 μmol·m-2·s-1),且A4与CK、B2、B4、A1处理间差异显著(P<0.05);7月份,A4处理的净光合速率最大(11.545 μmol·m-2·s-1),除B3、B4处理外,A4与其他处理均差异显著(P<0.05);9月份,CK处理净光合速率最大(11.728 9 μmol·m-2·s-1),且与A1、A2、A4处理间差异显著(P<0.05)。A4处理在5-7月份的净光合速率值较大,说明A4处理能提高苗木净光合速率;直至9月份,CK处理的净光合速率值变为最大。
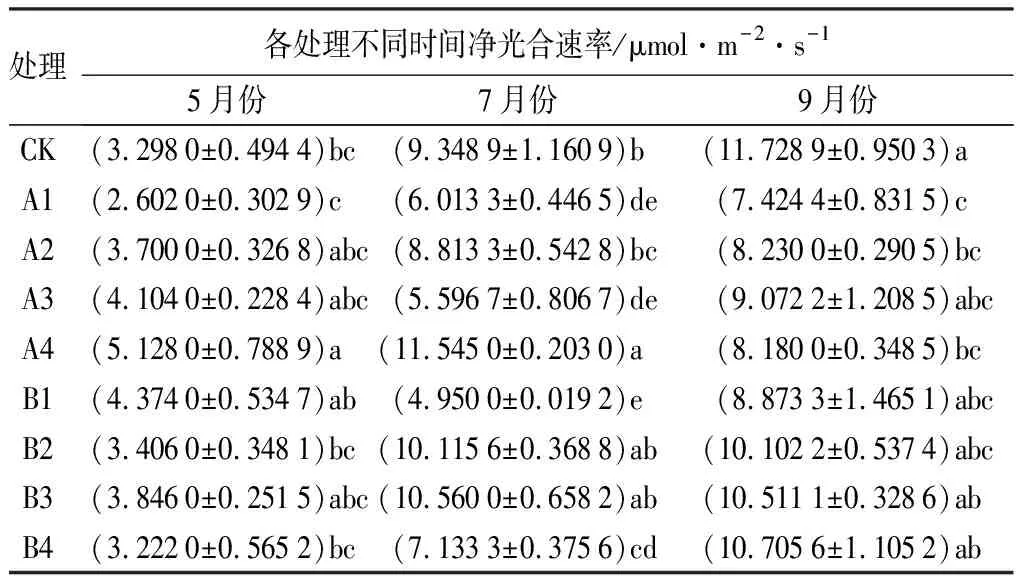
表7 不同处理下娇红2号净光合速率变化
由表8可知,5月份、7月份、9月份,不同处理对苗木气孔导度的影响表现为各处理间的变动幅度与Pn的变动幅度相似。5月份,B1处理的气孔导度最大为0.092 6 μmol·m-2·s-1,各处理间差异不显著;7月份,A4处理的气孔导度最大为0.244 5 μmol·m-2·s-1,且A4处理与其余各处理均差异显著(P<0.05);9月份,B3处理数值最大为0.199 1 μmol·m-2·s-1,且B3处理与CK、B2、B4处理无显著差异(P>0.05)。可知,施加处理和CK的气孔导度在7月份与A4处理表现出明显的差异(P<0.05);直至9月份,除B3处理外,其余各处理之间无明显的差异(P>0.05)。

表8 不同处理下娇红2号气孔导度变化
由表9可知,不同处理对娇红2号胞间CO2浓度的影响表现为:5月、9月各处理间变动幅度较小,7月份变动幅度较为明显。5月份测定的数据中,A1处理的胞间CO2浓度最大为229.200 0 μmol·m-2·s-1,且与B1处理(164.400 0 μmol·m-2·s-1)差异显著(P<0.05);7月份测定的数据中,B3处理的胞间CO2浓度最大为301.000 0 μmol·m-2·s-1,且与A1、A2、A3、B1处理差异显著(P<0.05);9月测定的数据中,B3处理的Ci最大为273.555 6 μmol·m-2·s-1,但各处理间差异均不显著(P>0.05)。通过对数据分析发现,B3处理在7—9月份拥有较大的胞间CO2浓度,但5—9月期间,CK与B3处理,各月份没有显著差异(P>0.05)。
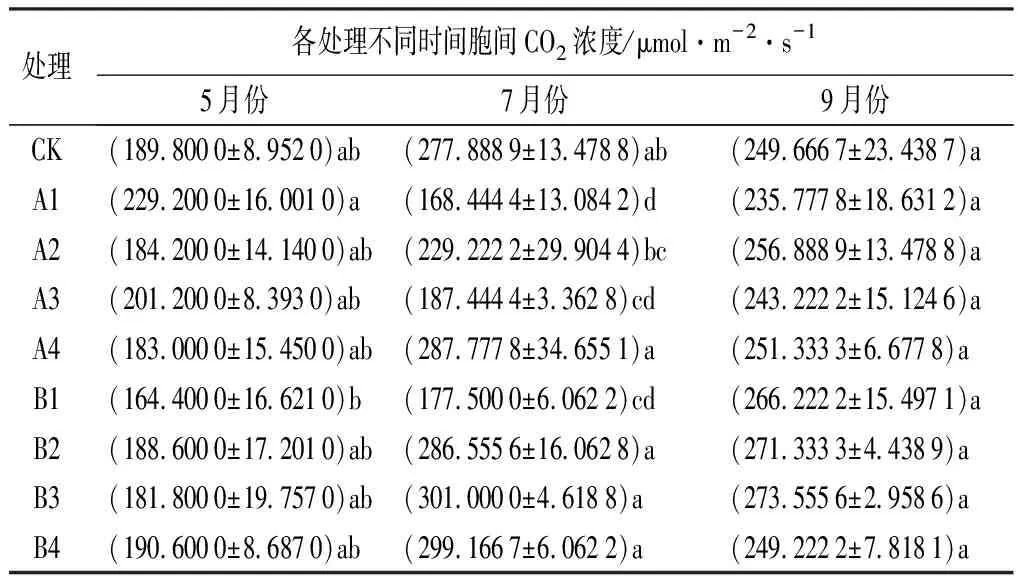
表9 不同处理下娇红2号胞间CO2浓度变化
由表10可知,不同处理对娇红2号蒸腾速率的影响表现为:5月份、9月份各处理间变动幅度较小,7月份变动幅度较为明显。5月份测定的数据中,A4处理的蒸腾速率最大为0.902 4 μmol·m-2·s-1,且各处理间只有A4处理和A2处理(0.493 9 μmol·m-2·s-1)差异显著(P<0.05);7月份测定的数据中,A4处理的蒸腾速率最大为6.995 0 μmol·m-2·s-1,与其余各处理差异显著(P<0.05);9月测定的数据中,CK处理的蒸腾速率最大为2.287 8,且CK与A1处理差异显著(P<0.05)。5月份,A4处理的娇红2号苗木的蒸腾速率的数值最大;7月份,A4处理仍保持较高的蒸腾速率;9月份,CK才逐渐表现出较高的蒸腾速率。

表10 不同处理下娇红2号蒸腾速率变化
经过数据综合分析发现,施加处理的植株面对逆境时,在7月份其光合生理表现出较高的抵抗能力,且表现较为突出的两个处理分别是A4和B3。而CK处理在9月份才逐步恢复正常的生长状态。此时推断,7月份施加处理的苗木(例A4、B3等)已经度过缓苗期,而CK处理的各项光合生理指标在9月份才度过缓苗期。
2.4 不同处理下娇红2号苗木保护酶活性和丙二醛质量摩尔浓度
2.4.1 超氧化物酶(SOD)活性变化
由表11可知,5月份,A4处理的娇红2号苗木SOD活性最高(382.211 0 U·g-1),其次是A3处理(279.623 7 U·g-1)和CK(266.206 9 U·g-1),且这3个处理间差异不显著(P>0.05),但是除A3和CK处理外,A4处理与的其余处理均差异显著(P<0.05)。7月份,A1处理苗木的SOD活性最高(287.516 7 U·g-1),除A3处理外,A1处理与其余处理均差异显著(P<0.05)。9月份,B1处理苗木的SOD活性为323.263 6 U·g-1,CK苗木的SOD活性为318.971 0 U·g-1,且除A1处理外,各处理间的差异不显著(P>0.05)。

表11 不同处理下娇红2号SOD活性变化
2.4.2 过氧化物酶(POD)活性变化
由表12可知,5月份,娇红2号苗木的POD活性最高的处理是CK(33.397 8 U·g-1·min-1),且除B4处理外,CK与其余各处理均差异显著(P<0.05);7月份,娇红2号苗木的POD活性最高的处理是B2(42.311 1 U·g-1·min-1),且各个处理间基本上存在显著差异(P<0.05);9月份,POD活性最高的是CK为62.570 1 U·g-1·min-1,并与其余各个处理均差异显著(P<0.05)。娇红2号苗木的POD活性各个处理间差异较大,在5份和9月份,CK在各处理中POD活性最大。
2.4.3 丙二醛(MDA)质量摩尔浓度变化
由表13可知,不同处理下,娇红2号MDA质量摩尔浓度变化如表13所示。5月份,各处理的娇红2号苗木的MDA质量摩尔浓度最高的是A3处理(22.701 6 μmol·g-1),且与其余各个处理差异显著(P<0.05)。7月份,各处理的娇红2号苗木的MDA质量摩尔浓度最高的是A4处理(14.358 5 μmol·g-1),其次是A1、B2、B1处理,且A1、A4、B2、B1处理间差异不显著(P>0.05),但A4处理与剩余处理间差异显著(P<0.05)。9月份,各处理的娇红2号苗木的MDA质量摩尔浓度最高的是A3处理(24.439 8 μmol·g-1),且与其余各处理差异显著(P<0.05)。数据分析发现,5—7月份A4和A3处理的MDA质量摩尔浓度普遍较高,直到9月份CK的MDA质量摩尔浓度才逐渐上升。
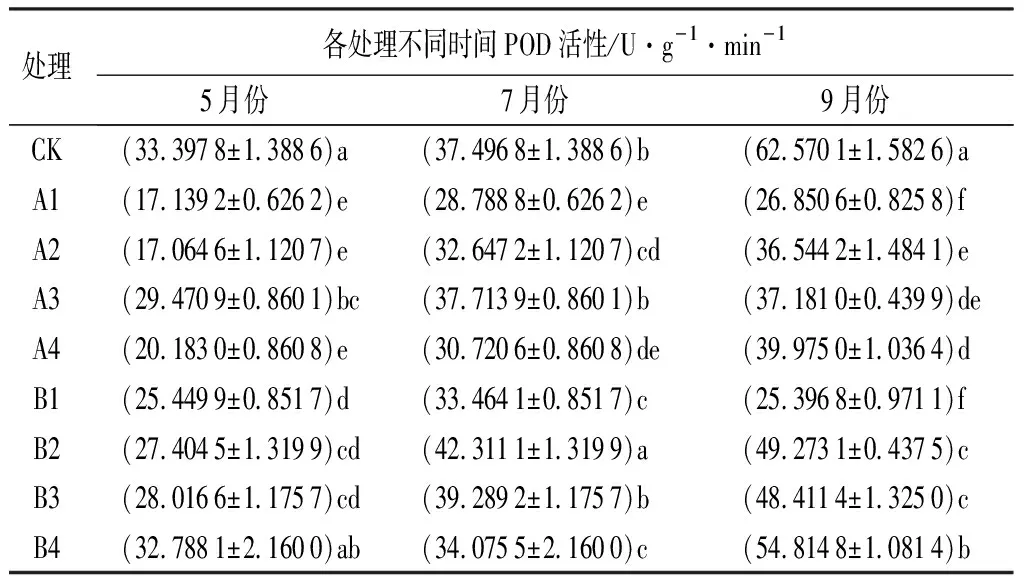
表12 不同处理下娇红2号POD活性变化

表13 不同处理下娇红2号丙二醛质量摩尔浓度变化
通过数据分析发现,较高浓度的ABT生根粉能在早期调节苗木的SOD活性,而微生物菌剂能更好的调节苗木的POD的活性。苗木生长至7月份,A3处理一直处于较高的SOD活性,B2处理处于较高的POD活性来应对植物生长中的逆境,并与CK差异显著(P<0.05);到9月份,CK处理的SOD、POD活性均较高,并与其余处理间差异几乎不显著。施加处理的苗木能普遍调节保护酶的活性来抵抗胁迫、减轻膜脂过氧化对植物造成的伤害。说明A3、B2处理可能在7月份已经度过缓苗期。直至9月份,CK处理的保护酶活性处于较高水平,此时所有苗木已度过缓苗期。
2.5 不同处理对娇红2号影响的综合评价
为了避免单个因子对苗木生长表现的片面性,综合反映不同处理对于娇红2号移栽苗生长的影响,利用主成分分析的方法对9个处理进行综合评分排名。得分越高说明该处理的苗木质量越好,即该处理对苗木生长的促进及抵御逆境的作用越强,则苗木度过缓苗期的时间越短。
由见表14可知,提取的3个主成分累计方差贡献率达89.6456%(>80%)。

表14 不同处理下娇红2号测定指标的主成分分析
由表15可知,第一主成分中根表面积、根长、根体积具有较大载荷,主要反映移栽后苗木根系生长状况,称根系影响因子;第二主成分中MDA具有较大载荷,主要反映了苗木移栽后受到环境胁迫膜脂过氧化的程度,称胁迫因子;第三主成分中SOD具有较大载荷,主要反映了苗木通过施加不同试剂在应对环境胁迫时的抵抗能力,称保护因子。

表15 不同处理下娇红2号测定指标的因子载荷阵
由表16可知,各处理综合得分排名由高到低分别是:A3、A1、A4、B3、A2、B4、B1、CK、B2。
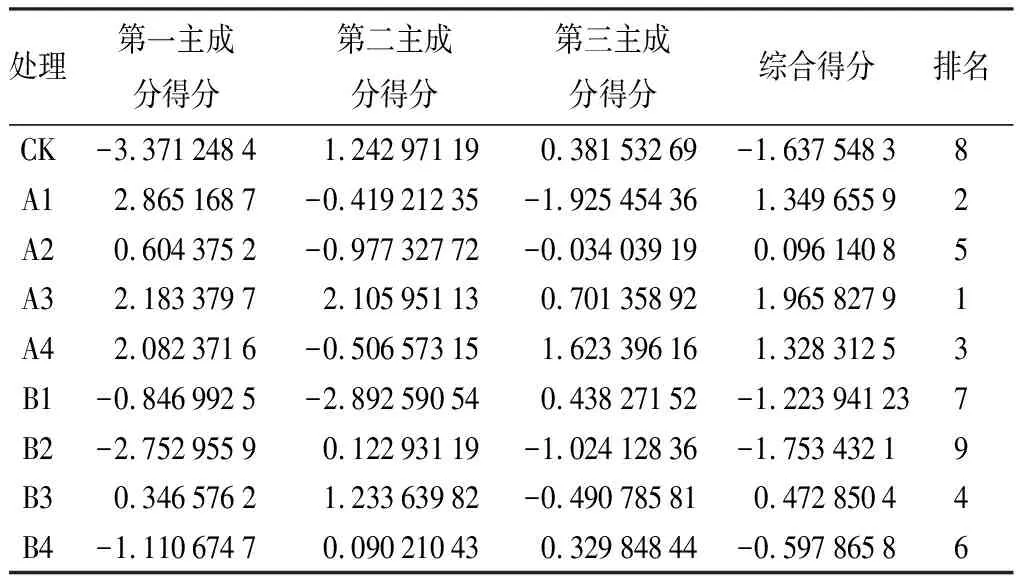
表16 不同处理下娇红2号生长情况综合得分排名
3 结论与讨论
3.1 促生剂对移栽后娇红2号苗木生长的影响
苗木移栽后面临着各种各样的“胁迫”。国外将苗木移栽后,将面临着各种各样的“胁迫”描述为“移栽效应”[26]、移植胁迫[27-28]、移植压力[29-30]等等。李继东等[31]将移植胁迫定义为移栽期间受到诸如断根、失水、高低温、光照不足、光周期紊乱、缺氧、擦伤、振动、根际环境改变等各种因子对移栽植物生长发育造成的不良影响。
缓苗期是苗木从生长地移植于移栽地进行生理和环境综合适应的过程,在此期间植物形态会随着环境的变化而发生变化[32-33]。ABT生根粉和EM菌剂通过促进根生长、增强光合作用、维持保护酶活性达到促进植物生长,缩短缓苗期的目的。从10年生玉兰移栽后施用ABT-3号生根粉的生长效果看,发现与对照相比能提高移栽后枝长和胸径生长,并提高移栽成活率[34]。本研究中,各处理苗木存活率都高于对照处理,苗木的高生长与径生长均好于对照处理。
根系作为植物重要的营养和功能器官,其性状特征对植物的生长分布具有指示作用[35]。对ABT生根粉在蝴蝶兰幼苗根系的应用[36]、EM菌剂在草莓生长和生理特性的应用中发现,ABT生根粉和EM菌剂可以促进根系生长,对于恢复苗木吸收能力,缩短缓苗期发挥重要作用[37]。Guo et al.[38]在对23个中国温带树种的研究结果中发现,一级根主要有完整的皮质和较低的中柱比例,有利于其吸收功能,根据解剖特征发现前三级根均有吸收能力,而四级和更高级根没有皮层的次生发育。本研究发现不同促生剂对苗木一级细根的生长与分级差异不显著,而二级细根和三级细根各处理的根长、根表面积和根体积差异显著。说明二、三级根对植物根输导能力、组织持久性和穿透土壤基质能力具有重要作用,也能提高植物吸收营养的功能[38-40]。
3.2 促生剂对移栽后娇红2号苗木光合特性的影响
光合作用是植物进行物质生产的基础,其变化过程反映了植物遭遇环境胁迫时的光合生理响应[41-43]。毕会涛[44]研究了枣树苗木移栽受到胁迫后光合生理变化,植株为了维持体内水分的平衡,净光合速率降低,气孔导度下降。本研究中,施加处理苗木的净光合速率、气孔导度数值均高于对照处理。说明施加处理的娇红2号具有较强的光合调节能力,以此减缓移栽造成的伤害,与毕会涛的研究结果一致。本研究还发现在光合能力的调节中,施加EM菌剂的效果要优于施加ABT生根粉。通过监测苗木移栽后光合特性的变化,间接的反映了苗木在缓苗期间应对胁迫的机制,为判定缓苗期的长短提供了重要的依据。
3.3 促生剂对移栽后娇红2号苗木保护酶特性和膜脂过氧化的影响
SOD、POD是植物抵御不良环境的保护酶,在植物体内活性氧的清除过程中发挥重要作用[45];MDA是衡量植物遭受逆境,细胞膜受到破坏的膜脂过氧化程度,它们本身存在于植物体内,会因为植物面临环境的不同而进行平衡调节。钟秋怡等[46]研究了N-乙酰-L-半胱氨酸(NAC)抗氧化剂对水稻缓苗调节过程,认为POD作为一种形成H2O2重要的酶,在移栽后短期内被激活,同时SOD活性受到抑制,MDA质量摩尔浓度随胁迫时间延长和程度加深均逐渐增加,表明膜脂质过氧化水平加重,细胞膜系统结构在一定程度上遭到破坏。本试验中,POD活性随着时间的延长而逐渐升高,SOD的活性则是先下降再升高,与钟秋怡等[46]的研究结果一致。
因此,本研究综合分析了移栽后红花玉兰娇红2号苗木施加不同促生剂后,生长、光合、保护酶等相关指标变化规律,结合主成分综合排名分析发现,ABT-1号生根粉(A3处理)能改善因移栽而造成的苗木生长不良的状况,促进苗木恢复正常的生长状态,与对照相比可缩短缓苗期1—2个月。本试验结果可为苗木移栽提供参考,并为娇红2号引种推广提供依据。

