肾缺血后处理通过抑制p38 MAPK信号通路减轻大鼠肾缺血再灌注损伤①
李 惠 刘建林 牛 聪 张 威 王慧超(河南大学第一附属医院肾内科,开封475000)
缺血再灌注损伤是急性肾损伤和慢性肾病的主要原因之一,包括肾纤维化,常由低血容量、感染性休克、意外或医源性创伤、心血管手术和肾脏手术引起[1]。缺血组织的再灌注过程至关重要,然而缺血过程会导致再灌注损伤。缺血再灌注损伤通过直接诱导肾小管细胞死亡而引起肾小管的结构和功能损伤,这些死亡细胞可能引起肾小管的损伤响应[2]。缺血再灌注损伤是移植过程中不可避免的现象,随着肾脏缺血再灌注的重要性越来越明显,开发新的治疗方法来预防缺血再灌注引起的肾脏损害是非常有必要的[3]。缺血后处理是在缺血组织或器官再灌注早期进行多次快速间歇阻断血流,从而机械地改变再灌注的流体动力学,相比缺血预处理,缺血后处理更具有临床应用价值[4]。相关研究表明缺血后处理能减轻肾脏缺血再灌注损伤,其机制与抑制p38 MAPK活化,进而抑制炎症因子释放有关[5]。本文旨在探讨肾缺血后处理通过抑制p38 MAPK信号通路对大鼠肾缺血再灌注损伤的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 30只SD大鼠购自成都达硕实验动物有限公司,雄性,体重(200±20)g,常规饲养7 d。
1.1.2 实验仪器和主要试剂 全自动生化分析仪(TBA-40FR)购自日本东芝;荧光显微镜(DM1000)购自德国徕卡;SOD测定试剂盒(A001-3-2)、MDA测定试剂盒(A003-1-2)、LDH试剂盒(A020-2-2)均购自南京建成;BCA试剂盒(ab102536)购自美国Abcam;HE染色试剂盒(C0105)、TUNEL细胞凋亡检测试剂盒(C1091)、p38 MAPK(SD5928)购自碧云天公司。
1.2 方法
1.2.1 动物模型的建立与分组 戊巴比妥(45 mg/kg)麻醉大鼠,对所有大鼠进行中线剖腹手术和右肾切除术,方法为行腹中线4~5 cm纵切口,暴露腹腔,将小肠、结肠、脾脏推到左侧,分离右肾,结扎肾蒂,将右肾取出。采用随机数字表法将大鼠随机分为3组(n=10):①假手术组(sham):暴露左肾,不作处理使左肾动脉血流正常;②肾缺血再灌注组(I/R)[6]:暴露左肾,用非创伤性血管钳夹紧左肾动脉,诱导缺血50 min,松开动脉后,再灌注24 h;③肾缺血后处理组(RI-Post):暴露左肾,用非创伤性血管钳夹紧左肾动脉,诱导缺血50 min,松开动脉后,再灌注的同时用非创伤性血管钳反复夹闭左肾动脉,重复3次,每次20 s。
模型建立24 h后从各组大鼠下腔静脉抽取静脉血2~4 ml置于抗凝管内,静置4 h后分离血清,-70℃保存待用,并刺激大鼠留尿于干净玻璃板上,用无菌注射器收集约0.2~0.5 ml。处死所有大鼠,取左肾组织分成2份进行石蜡切片和制作肾组织匀浆。
1.2.2 肾功能指标 采用全自动生化分析仪检测尿液中蛋白尿含量,分离后的血清采用全自动生化分析仪检测肌酐酸、尿素氮水平。
1.2.3 HE染色 取各组大鼠肾组织先用10%甲醛固定48 h,然后石蜡包埋制作切片,切片厚5µm。然后用苏木精、伊红染色。在400×荧光显微镜下观察肾组织损伤情况。参照JABLONSKI[7]方法对肾小管损伤评分。
1.2.4 TUNEL染色 大鼠肾组织切片用二甲苯浸洗2次脱蜡,每次5 min,梯度乙醇脱水。用蛋白酶K工作液在37℃下封闭20 min,PBS清洗2次。在每个切片样本上加入50µl TUNEL反应液,37℃避光反应60 min。用DAPI复染10 min后荧光显微镜下观察。
1.2.5 免疫组化 将切片先脱蜡处理后用PBS冲洗2次,4%多聚甲醛固定30 min,切片经3%过氧化氢处理后,再用山羊血清封闭。然后用抗BAX初级抗体孵育过夜,次日用PBS冲洗3次,每次5 min,最后加入辣根过氧化物酶(HRP)二抗孵育30 min,室温下用DBS显色。荧光显微镜下观察。
1.2.6 氧化应激指标检测 按照试剂盒说明书检测肾组织匀浆氧化应激指标SOD(WST-1法)、MDA(TBA法)、LDH(微板法)水平。
1.2.7 Western blot 取肾组织用BCA试剂盒提取总蛋白,并检测蛋白质含量。提取等量的蛋白质样品,在100℃条件下变性5 min。然后使用SDS-PAGE凝胶电泳法分离并转移至PVDF膜,在4℃条件下加入相应一抗并孵育过夜,清洗,然后在4℃条件下加入辣根过氧化物酶标记的二抗,洗膜后采用ECL法显色、拍照观察胶片上的条带,并用Image-Pro Plus软件对扫描图像进行灰度分析,目标蛋白的相对表达量用各目的条带与β-actin的灰度值比值来表示。
1.2.8 加入P38MAPK抑制剂SB203580对肾缺血再灌注损伤大鼠模型的影响 参照方法1.2.1构建肾缺血再灌注大鼠模型,将大鼠随机分为4组:sham组、I/R组、SB组、SB+RI-Post组。SB组大鼠腹腔注射P38抑制剂SB203580 400µg/kg,SB+RI-Post组在缺血后处理后腹腔注射P38抑制剂SB203580400µg/kg。检测各组大鼠肾组织病理损伤,蛋白尿、血清肌酸酐、尿素氮水平和氧化应激指标。
1.3 统计学分析 使用SPSS16.0软件对实验数据进行统计学分析,两两比较用独立的t检验,结果以±s表示,P<0.01为差异具有统计学意义。
2 结果
2.1 肾缺血后处理降低肾缺血再灌注大鼠模型蛋白尿、血清肌酸酐和尿素氮水平 检测各组SD大鼠24 h蛋白尿、血清肌酸酐和尿素氮的水平,结果如图1所示,I/R组尿素氮水平显著高于sham组(P<0.01),RI-Post组尿素氮水平显著低于I/R组(P<0.01),I/R组24 h蛋白尿水平显著高于sham组与RI-Post组(P<0.01)。sham组血清肌酐酸水平显著低于I/R组(P<0.01),RI-Post组血清肌酐酸水平显著低于I/R组(P<0.01),说明I/R组肾损伤情况高于RI-Post组与sham组。
2.2 肾缺血后处理改善肾缺血再灌注大鼠病理损伤程度 为了检测肾缺血后对肾组织损伤的影响,本研究采用HE染色检测肾组织损伤情况。结果如图2所示,I/R组较sham组肾组织病理改变明显,呈现肾小管肿胀,细胞核移位,细胞结构消失,间质充血,肾小管管腔内有坏死碎片,且肾小管损伤评分显著升高(P<0.01,图3)。RI-Post组较I/R组,肾组织损伤情况明显减轻且肾小管损伤评分显著降低(P<0.01)。TUNEL阳性表达的细胞核呈深染棕色。如图所示,I/R组阳性表达率显著高于sham组(P<0.01),RI-Post组阳性表达率显著低于I/R组(P<0.01)。Caspase-3的免疫组化阳性染色主要位于细胞浆内,少数也见于胞核,呈棕褐色。sham组与RIPOST组阳性表达率均显著低于I/R组(P<0.01)。说明肾缺血后处理较肾缺血后灌注可以明显降低肾组织的损伤程度。
2.3 肾缺血后处理降低肾缺血再灌注大鼠模型SOD、MDA、LDH水平 检测各组氧化应激指标SOD、MDA、LDH,如图4所示,与sham组相比,I/R组SOD活性显著降低(P<0.01),MDA水平和LDH水平显著升高(P<0.01),RI-Post组较I/R组SOD活性显著升高(P<0.01),MDA、LDH水平显著降低(P<0.01)。说明肾缺血后处理可能降低肾缺血后再灌注氧化应激水平。
2.4 肾缺血后处理抑制p38 MAPK信号通路 为了研究肾缺血后细胞损伤变化的潜在机制,本文检测p38 MAPK和磷酸化p38 MAPK的表达情况,如图5所示,sham组蛋白水平显著低于I/R组(P<0.01),I/R组蛋白水平显著高于RI-Post(P<0.01)。说明I/R组促进p38 MAPK信号通路表达,而RI-Post组可能通过抑制p38 MAPK信号通路表达降低肾组织损伤。

图1 肾缺血后处理对肾缺血再灌注大鼠模型蛋白尿、血清肌酸酐和尿素氮水平的影响Fig.1 Effects of renal ischemia post-treatment on nitro⁃gen,proteinuria and serum creatinine levels in rat models after renal ischemia and reperfusion
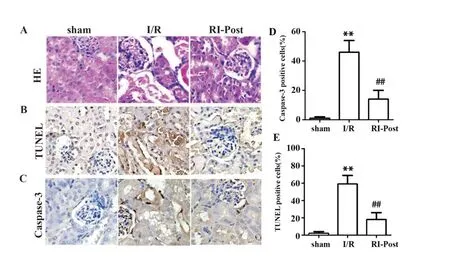
图2 肾缺血后处理对肾缺血再灌注大鼠模型肾组织损伤的影响(×400)Fig.2 Effects of renal ischemia post-treatment on renal tissue injury in rat model of renal ischemia reperfu⁃sion(×400)

图3 肾缺血后处理对肾缺血再灌注大鼠模型肾小管损伤评分的影响Fig.3 Effect of renal ischemia post-treatment on renal tu⁃bule injury score in renal ischemia reperfusion rat model

图4 肾缺血后处理对肾缺血再灌注大鼠模型SOD、MDA、LDH水平的影响Fig.4 Effects of renal ischemia post-treatment on levels of SOD,MDA and LDH in renal ischemia reperfu⁃sion rats
2.5 加入p38 MAPK抑制剂SB203580对肾缺血再灌注损伤大鼠模型的影响 通过HE染色检测各组大鼠肾组织损伤情况,结果如图6A所示,SB+RIPost组较SB组病理损伤程度明显改善,肾小管肿胀减轻,细胞结构较完整;检测各组大鼠尿素氮、24 h蛋白尿、血清肌酸酐水平,结果如图6B~D所示,与sham组相比较,I/R、SB组尿素氮、24 h蛋白尿、血清肌酸酐水平显著升高(P<0.01)。与SB组相比较,SB+RI-Post组尿素氮、24 h蛋白尿、血清肌酸酐水平显著降低(P<0.01);检测各组氧化应激指标SOD、MDA、LDH,如图6所示,与sham组相比较,I/R、SB组SOD活性显著降低(P<0.01),MDA、LDH水平显著升高(P<0.01)。与SB组相比较,SB+RI-Post组SOD活性显著升高(P<0.01),MDA、LDH水平显著降低(P<0.01)。
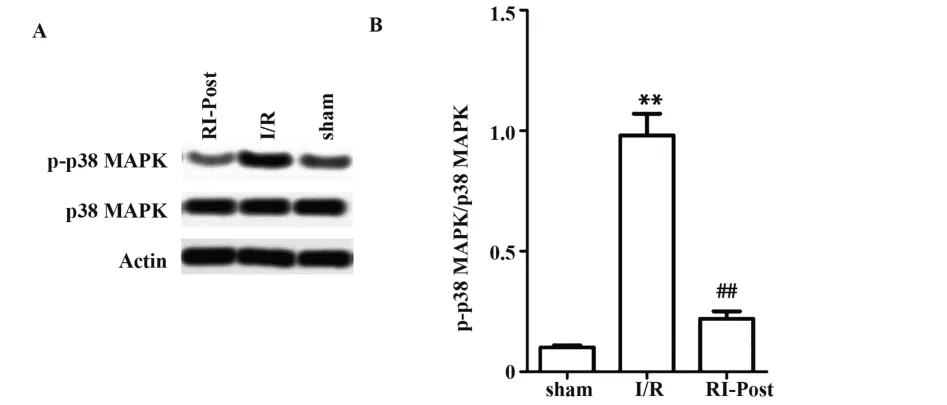
图5 肾缺血后处理对肾缺血再灌注大鼠模型p38 MAPK蛋白表达的影响Fig.5 Effect of renal ischemia post-treatment on expres⁃sion of p38 MAPK protein in renal ischemia reper⁃fusion rat model
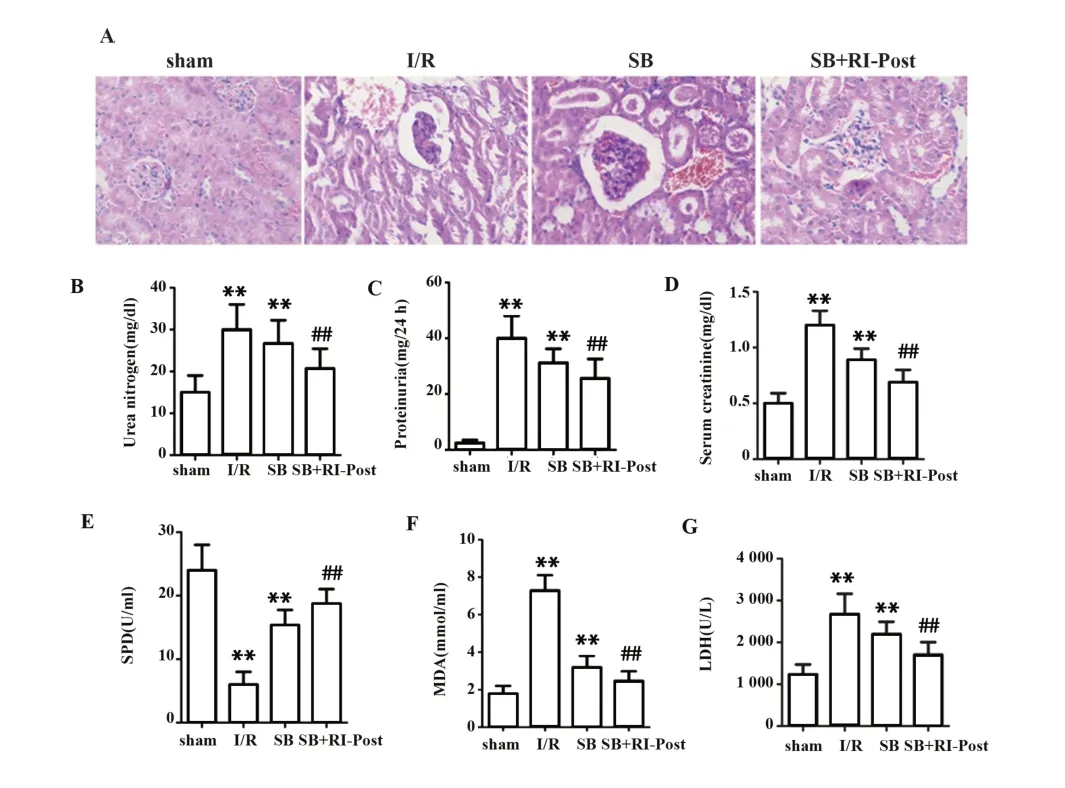
图6 加入p38 MAPK抑制剂SB203580对肾缺血再灌注损伤大鼠模型的影响Fig.6 Effect of p38 MAPK inhibitor SB203580 on rat model of renal ischemia-reperfusion injury
3 讨论
缺血再灌注损伤定义为组织器官经过一定时间缺血后再恢复血液灌注后其代谢、功能和结构的损伤反而加重,甚至出现不可逆损伤的现象[8]。细胞在缺血期缺乏氧气,因此,代谢从需氧转变为无氧糖酵解,导致细胞肿胀,酸中毒。ATP耗尽,细胞内Na+和Ca2+过载和抑制线粒体呼吸链,使细胞死亡发生在数分钟至数小时内,这取决于细胞类型。因此,缺血后血流的恢复对细胞存活至关重要。然而,缺血组织的再灌注常引起对细胞有害而非有益的效应,这尤其适用于突然恢复氧气(导致氧化应激),氧自由基的释放(可诱导细胞死亡)和炎症因子的释放[9]。缺血再灌注损伤可导致器官功能障碍或衰竭,是移植、休克和大手术中的重要临床问题。肾的高代谢和血管解剖学对缺血再灌注损伤特别敏感,严重缺血期是呈时间依赖性的:已经证实15~20 min的缺血会对肾脏造成不可逆的损害[10]。
缺血后处理是一种短暂,相互作用的保护策略,缺血后处理应用于缺血后再灌注的早期阶段,RI-Post一直存在于各种动物的各种器官中,呈现衰减I/R的作用,目前应用于目标器官、远端器官或组织时有效[11]。因此RI-Post为I/R患者提供了一种有广泛前景的治疗策略。WANG等[6]研究发现缺血后处理和臭氧后处理可协同减轻肾缺血再灌注损伤。SEIFI等[12]研究发现肾缺血后处理对肾缺血再灌注损伤后肝脏远端器官具有保护作用。本文研究结果与上述研究结果一致,肾缺血后处理可以减轻肾缺血再灌注损伤。
研究表明细胞内丝裂原活化蛋白激酶(MAPK)信号通路在I/R损伤期间调节炎症和细胞存活,其家族成员p38蛋白激酶(p38 MAPK)在各种细胞功能中起调节作用。p38 MAPK信号通路参与缺血再灌注损伤等多种因素导致的炎症反应调控,通过p38 MAPK活化,巨噬细胞、中性粒细胞激活释放炎症细胞因子参与细胞的损伤,说明阻断p38 MAPK信号通路能减轻肾缺血再灌注损伤[13]。ZHOU等[14]研究发现高迁移率族蛋白1通过抑制p38丝裂原活化蛋白激酶信号通路减弱心肌缺血再灌注损伤。JIANG等[15]研究发现p38 MAPK诱导的核因子激活B细胞活性的κ-轻链增强子是视网膜缺血/再灌注损伤中神经保护所必需的。本研究中,观察到I/R组的p38 MAPK表达显著高于RI-Post组,提示肾缺血后处理可能通过抑制p38 MAPK的表达来减弱缺血再灌注的损伤,且加入P38MAPK抑制剂SB203580也证明了这一点。
综上所述,肾缺血后处理可以降低肾缺血后再灌注氧化应激水平,I/R组促进p38 MAPK信号通路表达,RI-Post组可能通过抑制p38 MAPK信号通路来降低表达。本文的研究结果阐明了肾缺血后处理可通过抑制p38 MAPK信号通路减轻大鼠肾缺血再灌注的损伤程度。

