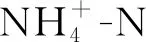瞬时Cu2+冲击负荷对序批式反应器脱氮性能、微生物活性和微生物群落的影响❋
潘云浩, 孙艳霞, 宋陈光, 鲁帅领, 吴淑妍, 武原原, 高孟春❋❋
(1. 中国海洋大学海洋环境与生态教育部重点实验室, 山东 青岛 266100; 2. 北京市劳保所科技发展有限公司, 北京 100070; 3. 中国海洋大学环境科学与工程学院, 山东 青岛 266100)
铜被广泛应用于金属加工、电镀、采矿和各种制造业[1-2],其工业废水通常经预处理后排放到城市的下水道系统,与城市污水混合,最终进入城市污水处理厂[3-4]。由于工业活动不同,铜离子(Cu2+)在不同工业废水中浓度差异较大[5-7]。在实际工程中,工厂可能会存在超量或事故排放[8],一些工业废水未经有效地预处理而进入污水处理厂,使其常常面临高浓度含Cu2+废水的冲击。此外,城市污水在水质和水量上的波动[9]以及污水处理厂操作条件的变化[10]也会导致污水处理厂受到高浓度Cu2+负荷冲击。瞬时Cu2+冲击将抑制微生物的活性,改变微生物群落结构,大大降低系统的污水处理效率,甚至导致污水处理系统的崩溃。污水处理系统抗冲击负荷的稳定性是污水处理厂最重要的设计特性之一,因此,有必要研究生物处理工艺在受到Cu2+冲击时运行的稳定性以评价工艺效能的优劣。
1 实验材料与方法
1.1 实验装置及运行条件
本试验采用SBR作为反应装置,其材质为有机玻璃,有效容积为7.7 L,有效高度和内径分别为50和14 cm,容积交换率为50%。SBR在室温下运行,共运行80 d。每天运行4个周期,每周期6 h(进水5 min,缺氧60 min,好氧180 min,缺氧60 min,沉淀30 min,出水5 min,闲置20 min)。SBR的各个运行阶段由时间继电器自动控制。进水由反应器底部的蠕动泵控制,出水由反应器中部的电磁阀控制。SBR采用底部曝气方式,其曝气量通过气体转子流量计调节,好氧阶段溶解氧(DO)浓度在2 mg/L以上。在缺氧阶段使用磁力搅拌器保证活性污泥和污水充分混合,DO浓度小于0.5 mg/L。定期排放污泥,使污泥龄保持在20 d左右。在受到Cu2+负荷冲击前,SBR经过18 d的运行达到稳定状态。第19天对SBR进行冲击试验,冲击时间为24 h。第20天至第80天,Cu2+冲击停止,SBR继续运行。
1.2 接种污泥及水质
1.3 分析方法

2 结果与讨论
2.1 Cu2+冲击负荷对SBR去除有机物和氮化物性能的影响
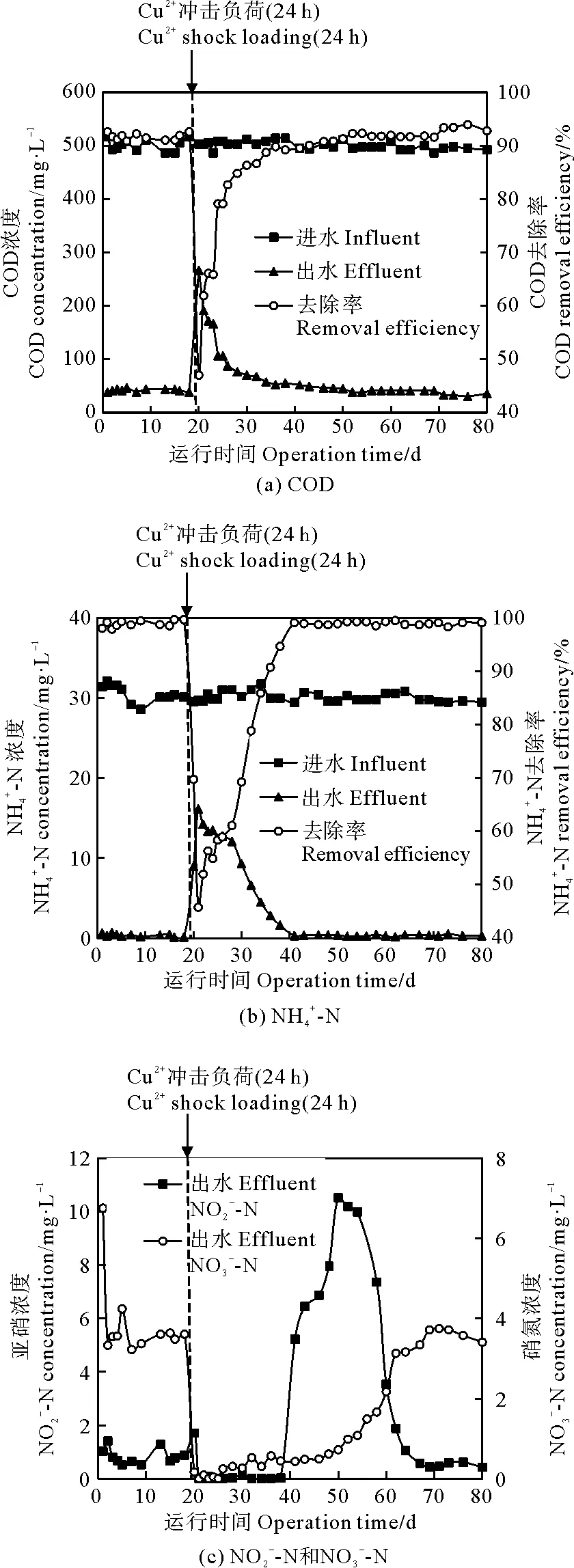
图1 Cu2+冲击负荷对SBR性能的影响
2.2 Cu2+冲击负荷对活性污泥比耗氧速率和脱氮速率的影响
为了更好的评价Cu2+冲击对SBR脱氮性能的影响,本研究分析了比耗氧速率和脱氮速率的变化情况,结果如图2所示。第18天,SOUR、SAOR、SNOR、SNRR和SNIRR分别为(84.94±6.07) mg O2/(g MLVSS·h)、(11.25±1.01)、(11.78±0.79)、(24.21±0.59)和(23.72±1.92) mg N/(g MLVSS·h)。冲击作用24 h后,SOUR值在第20天下降了82.27%。SOUR的急剧下降表明与去除COD相关的好氧异养菌的代谢活性在短暂冲击后受到了较大程度的抑制。从第21天起,SOUR值逐渐增加,第80天SOUR值为(82.18±4.75) mg O2/(g MLVSS·h),与第18天相比没有显著性差异。硝化速率(SAOR和SNOR)和反硝化速率(SNRR和SNIRR)与SOUR的变化趋势相似。与第18天相比,SAOR和SNOR在第20天分别下降了87.20%和89.98%,表明Cu2+冲击对氨氧化过程和亚硝酸盐氧化过程产生了较大的抑制。冲击停止后,SAOR和SNOR值逐渐增加,并在第80天基本恢复至冲击前的正常值。Madoni等[12]的研究表明0.02~0.9 mg/L Cu2+对SAOR没有明显的抑制作用;荣宏伟等[19]研究发现当反应器内加入5 mg/L的Cu2+冲击后,SOUR活性和SAOR活性在第3个周期结束后分别降低59.32%和82.61%;随后,SOUR活性和SAOR活性逐渐上升,分别在第6个、第9个周期结束后恢复至未投加Cu2+时的水平。目前研究结果表明,瞬时高浓度Cu2+冲击对微生物活性的抑制作用比低浓度Cu2+更强,且微生物活性恢复较慢。与第18天相比,SNRR和SNIRR在第20天分别降低了77.78%和52.02%,但抑制率低于SAOR和SNOR,这说明与反硝化过程相比,硝化过程更容易受到高浓度Cu2+负荷的影响,这与Li等[16]的研究结果相似。SNRR和SNIRR从第21天开始呈上升趋势,并在第80天恢复正常水平,对应值为(21.98±1.58)和(22.07±0.46) mg N/(g MLVSS·h)。以上研究结果表明冲击停止后,SBR去除有机物和脱氮性能恢复至稳定状态。
2.3 Cu2+冲击负荷对微生物酶活性的影响

(“*”表示与未施加Cu2+冲击负荷的对照组SOUR和脱氮速率具有显著性差异(p<0.05),误差线代表三次实验测量值的标准差。Asterisks indicate the statistical difference (p<0.05) from SOUR and nitrogen removal rates at 0 mg/L Cu2+. Error bars represent standard deviations of triplicate measurements.)

(“*”表示与未施加Cu2+冲击负荷时的微生物酶活性具有显著性差异(p<0.05),误差线代表三次实验测量值的标准差。Asterisks indicate statistical differences (p<0.05) from the microbial enzymatic activity 0 mg/L Cu2+. Error bars represent standard deviations of triplicate measurements.)
2.4 Cu2+冲击负荷对活性污泥生物毒性的影响
ROS的产量是反映细胞氧化应激水平的重要指标[24],而细胞外LDH水平是评价细胞膜完整性的指标[25]。SOD和CAT是两种抗氧化酶,是将重金属引起的氧化破坏降到最低的重要防御机制[26-27]。为了更好的表征Cu2+负荷冲击对活性污泥的生物毒性,本研究对ROS、LDH、SOD和CAT的变化进行了探讨,结果如图4所示。在受到Cu2+冲击后,ROS的产量在第20天增加了134.28%,表明Cu2+冲击使细胞产生了强烈的氧化应激反应。ROS以膜磷脂的不饱和脂肪酸为靶点,破坏细胞的蛋白质、核酸、脂质等成分,最终导致细胞形态的损伤[26]。Hu等[28]发现Cu2+可以催化羟基自由基的产生,并通过氧化还原循环反应促进氧化应激,导致细胞膜功能受损。从第21天起,ROS的产量呈现逐渐下降的趋势,第80天,ROS产量为(110.40±7.60)%,与第18天相比无明显差异。第18天,LDH的释放量为(100±9.88)%,但在第20天其释放量上升177.34%,这表明活性污泥的细胞膜受损。从第21天起,LDH释放量逐渐下降,第80天,LDH释放量为(113.73±3.11)%,基本恢复到正常水平。CAT和SOD的相对酶活性变化与ROS和LDH的变化趋势一致。第20天,CAT和SOD的相对酶活性与第18天相比分别提高336.17%和192.02%,这是因为在ROS产量增加时,细胞需要分泌更多的抗氧化酶来抑制ROS产生。从第21天起,CAT和SOD的相对酶活性呈现逐渐下降的趋势,第80天,CAT和SOD的相对酶活性与第18天基本一致。
2.5 Cu2+冲击负荷对微生物群落的影响
在第18天、第21天、第54天、第80天对SBR中的活性污泥进行高通量测序,对应的污泥样品分别为S18、S21、S54和S80。基于处理后得到的有效序列,以97%的一致性将上述活性污泥样品进行操作分类单元(OTUs)聚类分析,分别获得 906、529、298和354个OTUs。表1中列出了100 mg/L Cu2+负荷冲击下微生物群落的丰富度和多样性指数变化。Good’s coverage指数在第18天、第21天、第54天和第80天均接近于1,说明测序深度基本覆盖了样品中的所有物种。微生物群落的丰富性常用Chao1和ACE指数来表示,其多样性常用Simpson和Shannon指数来表示。Chao1和ACE指数从第18天到第21天分别由1 050和1 046降至604和611。Simpson和Shannon从第18天到第21天分别由0.959和6.809下降到0.820和4.044。由此可见,Cu2+冲击破坏了微生物群落的多样性和丰富度。虽然在第80天Shannon和Simpson指数、Chao1和ACE分别恢复到5.418、0.918、393和396,但与第18天相比受到了一定程度的抑制。从以上结果可以看出,在61天的恢复期内,微生物群落没有完全恢复到原来的水平。

(“*”表示该样品与未施加Cu2+冲击负荷时的样品差异性显著(p<0.05),误差线代表三次实验测量值的标准差。Asterisks indicate statistical differences (p<0.05) from the biotoxicity of activated sludge at 0 mg/L Cu2+. Error bars represent standard deviations of triplicate measurements.)
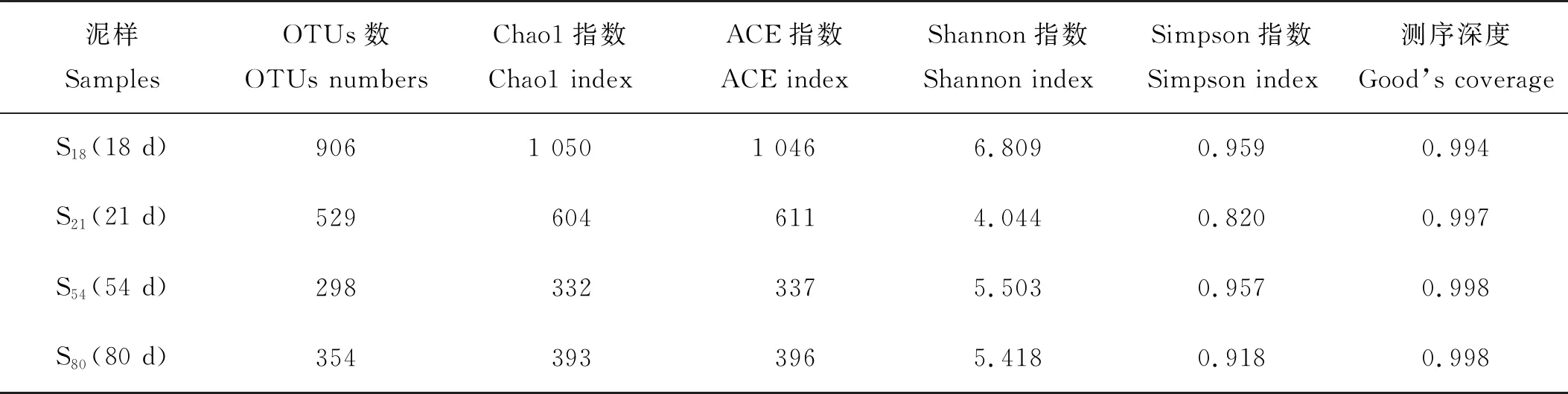
表1 Cu2+冲击负荷下微生物群落的丰富度和多样性指数
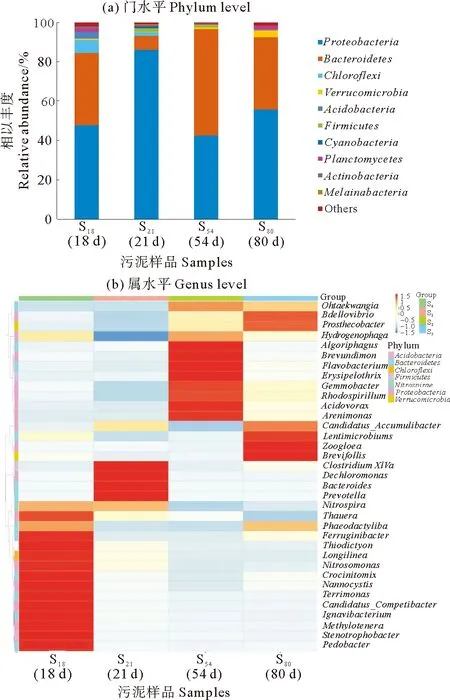
图5 Cu2+冲击负荷下微生物群落的分类
3 结语