急性脑梗死机械取栓后颅内出血转化的影响因素分析
蔡智立, 何奕涛, 付学军, 张启文, 郭毅*
(1. 暨南大学 第二临床医学院∥深圳市人民医院 神经内科, 广东 深圳 518020; 2. 南方科技大学 附属第一医院∥深圳市人民医院 神经内科, 广东 深圳 518020)
我国脑血管疾病患者中69.6%~70.8%为缺血性卒中[1-2],目前急性脑梗死超早期采用的治疗方法主要有静脉溶栓、动脉溶栓、动静脉联合溶栓、机械取栓、导管抽吸等.而机械取栓作为一种新型的血管内治疗手段,延长了治疗的时间窗,提高了血管的开通率,逐渐在急性大血管闭塞的脑梗死超早期治疗中占据主导地位. 2015年发表于TheNewEnglandJournalofMedicine5项研究均证实以支架取栓为主的动脉介入治疗可带来显著的临床获益[3-7].目前,国内外的指南都把大血管闭塞患者机械取栓治疗作为I类证据,A 级推荐.但是机械取栓存在颅内出血等并发病,严重影响患者的预后,甚至危及生命.因此,尽早明确机械栓术后发生颅内出血的危险因素,采取相关的措施,对预防颅内出血至关重要.本研究回顾性分析急性脑梗死机械取栓后颅内出血的影响因素,供临床参考.
1 资料与方法
1.1 研究对象
回顾性分析2017年1月至2020年6月于深圳市人民医院住院接受机械取栓治疗的急性脑梗死患者,纳入标准:① 符合机械取栓适应症,无机械取栓禁忌症且完成机械取栓者;②术后24 h内完成头颅CT复查或72 h内完成头颅MRI检查;排除标准:①相关临床资料不完善者;②术后24 h内未能完成头颅CT复查或72 h未能完成MRI检查.本研究方案经医院医学伦理委员会审批通过,患者或其家属均签署了知情同意书.
1.2 方法
1.2.1 治疗方法
所有的手术操作均由同一组神经介入治疗团队完成.根据患者的配合程度及生命体征等特点采取局麻、镇静麻醉、全麻等不同的麻醉方式.选择股动脉、桡动脉或肱动脉行脑血管造影,结合临床症状或MRI结果明确责任血管并评价侧支循环,侧支循环评价使用美国介入和放射治疗学会侧支循环分级系统[8](American society of interventional and therapeutic neuroradiology collateral grading system,ACG).造影完成后采用6F或8F导引导管(美国MicroVention),根据情况配合5F Navien 中间导管(美国美敦力)进入到责任血管,使用 Traxcess 0.014 英寸微导丝(美国MicroVention)配合Headway 17、21或27微导管(美国MicroVention)穿过血栓到达闭塞血管远端位置,手推造影剂确认微导管的位置及血栓长度,将Solitaire(美国美敦力)(4 mm×20 mm或6 mm×30 mm)或Trevo(美国史赛克)取栓装置 (4 mm×20 mm)通过微导管送至责任血管.支架到位后释放,放置 5~8 min,在负压吸引下,将支架与微导管一起拉出体外.以改良脑梗死溶栓(modified thrombolysis in cerebral infarction,mTICI)分级造影评价再灌注情况,如果mTICI分级达到2b或3级患者,结束手术.如果没有完全再通,可重复取栓,但最多不超过5次.对取栓后残余重度狭窄者、mTICI分级未达到2b级患者,根据具体情况可行球囊扩张或支架植入.若取栓后出现血管再闭塞或血管壁毛糙,可通过微导管缓慢推注6~10 mL替罗非班溶解血栓,观察半小时,造影后复查若仍然通畅,则结束手术.
1.2.2 围手术期处理
术后将患者送至神经内科监护病房,可根据患者情况酌情使用替罗非班以0.15 μg/kg/min持续静脉泵入24~48 h,后续以阿司匹林肠溶片100 mg和/或氯吡格雷片75 mg口服治疗,复查CT提示出血者停用抗血小板治疗;以尼莫同降压或多巴胺升压药控制收缩压于120 mmHg左右或低于基础血压20 mmHg;躁动者给予适当镇静,地西泮10~30 mg静脉注射;术后有脑出血或梗死范围扩大等外科手术指征者,及早行外科手术治疗.
1.2.3 分组方法
在手术结束后及术后第24 h复查头颅CT平扫,病情变化随时复查头颅CT,术后3 d内完善头颅核磁共振SWI序列检查,明确有无颅内出血(脑出血、蛛网膜下腔出血、脑室出血),如诊断结果有争议时,由2名神经科副主任及以上医师共同进行影像学评价,尤其是要排除造影剂渗出可能,CT 值为60~90 HU为出血,将患者分为有颅内出血组(HT组)和无出血组(无HT组).
1.2.4 基线资料的收集与比较
基线资料包括年龄、性别、吸烟史、高血脂史、高血压史、糖尿病史、房颤史、脑卒中史、院前抗血小板或抗凝治疗、术前美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分、取栓部位(前/后循环)、取栓前有无静脉溶栓、术中及术后静脉抗血小板药物的使用、取栓次数、发病至再灌注时间(onset to reperfusion time, ORT)、术后收缩压水平.吸烟史定义为一生连续或累积吸烟6个月或以上者.
1.3 统计学处理
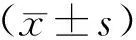
2 结果
2.1 两组患者一般资料比较
本组接受机械取栓治疗的共有47例急性脑梗死患者,排除2例术后未行头颅CT检查资料不完善的患者,最终纳入45例患者,男27例,女18例,年龄30~87岁,其中无HT组31例,HT组14例,两组患者在年龄、性别、吸烟史、高血脂史、高血压病史、糖尿病史、脑卒中史、术前静脉溶栓、院前抗血板或抗凝、术中及术后静脉抗血小板药物的使用方面无统计学差异(P>0.05).而HT组房颤比例、ORT、取栓部位为前循环的比例、NIHSS评分、术后收缩压水平明显高于无非HT组(P<0.05,表1).
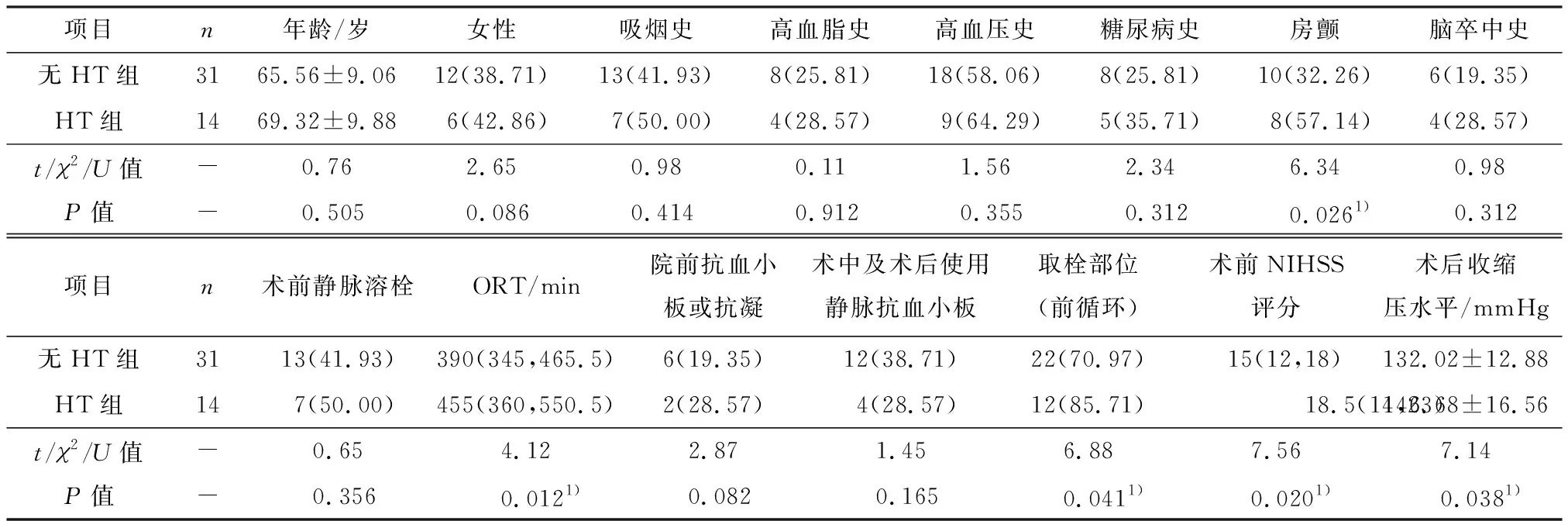
表1 两组患者的一般资料及单因素分析比较Table 1 The general data and univariate analysis were compared between the two groups n(%)
2.2 取栓后出现颅内出血的多因素回归分析
将房颤比例、ORT、取栓部位为前循环的比例、NIHSS评分、术后收缩压水平5个在单因素分析中有统计学意义的变量,纳入多因素 Logistic 回归分析模型,统计发现房颤、较长的ORT、NIHSS评分较高(P<0.05)是患者机械取栓后出现颅内出血的独立危险因素(表2).
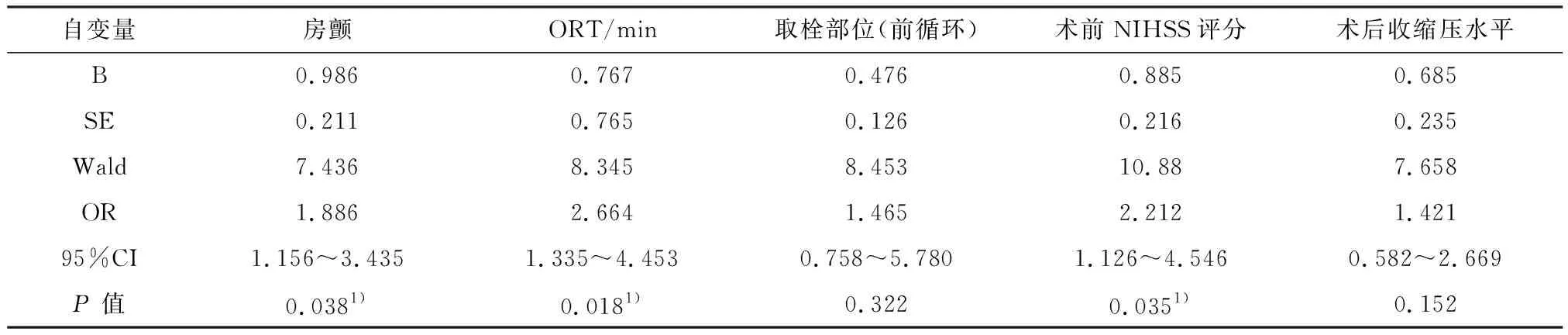
表2 急性脑梗死患者取栓后颅内 HT 发生的危险因素 Logistic 回归分析Table 2 Logistic regression analysis of risk factors of HT in patients with acute cerebral infarction after thrombectomy
3 讨论
机械取栓不但可以延长患者治疗的时间窗,还能提高血管的开通率,显著改善急性大动脉闭塞脑梗死患者的预后[9-11].颅内出血是机械取栓最常见的并发症,因其危害最大、发生率较高受到临床医生的密切关注.Berkhemer等[3]的研究显示其发生率为 47.2%,本研究中的发生率为31.11%,因此对影响术后颅内出血的因素进行分析和识别有重要临床意义.目前国内外研究对于急性脑梗死患者机械取栓后颅内出血转化的相关危险因素进行了描述,但纳入的影响因素比较单一,尚缺乏一致的结论.而本研究纳入了患者术前、术中、术后的相关影响因素进行分析,对于筛选合适的手术病人、指导手术操作及术后管理和预测患者临床转归具有重要的价值.
本研究显示房颤是患者术后颅内出血的独立危险因素.房颤患者易出现心源性栓塞,2019 年王陇德等[12]发表的一项我国流行病学调查显示房颤患者脑梗死发病率为9.48%,远远高于无房颤人群.由于房颤栓子质地较硬、体积较大、不易被支架取栓拉出,且心源性栓塞为突发起病,患者颅内难以短期内建立有效的侧支循环,远端血管易出现缺血坏死、血管通透性改变,血管再通后易导致血管壁破裂出血,因此心源性栓塞脑梗死与其他类型脑梗死相比更易发生出血性转化[13-14].Zhao等[15]的研究认为心源性栓塞为支架取栓术后颅内出血的独立危险因素.本研显示HT组房颤患者占57.14%,非HT组房颤患者占32.26%,统计学显示HT组房颤比例明显高于非HT组,多因素回归分析也显示房颤是支架取栓术后发生颅内出血的独立危险因素,所以对合并房颤的脑梗死患者要高度警惕支架取栓术后出血的风险.
2018年DAWN[10]和 DEFUSE 3[11]研究证实了发病 6~24 h机械取栓治疗的有效性.2018 年我国和美国ASA/AHA的急性缺血性卒中血管内治疗指南中,都有不同等级的推荐取栓时间在 6~24 h内[16-17],与DAWN[10]或 DEFUSE 3[11]研究入组标准相似.有研究认为发病至血管再灌注时间过长会使颅内出血的概率增加,容易导致不良的临床预后[18-19].Lee等[20]认为快速开通闭塞的血管对于降低取栓后发生 HT 概率至关重要,缩短ORT时间能够让患者有更好的神经功能恢复和更低的死亡率[6],本研究显示HT组ORT时间明显较非HT组者延长,ORT过长是取栓后颅内出血转化的独立危险因素,与国外的相关研究结论类似.“时间就是大脑”,提示手术者需严格把握手术时间窗,要十分注意血管开通时间与患者并发症及预后的相关性.
一项来自韩国的回顾性研究纳入了365例急性脑梗死患者,发现术前较高NIHSS评分是急性脑梗死患者取栓术后并发颅内出血的独立危险因素,随着术前NIHSS 评分的减少,颅内出血转化的风险会降低[21].本研究显示HT组NIHSS评分明显较无HT组高,差异有统计学意义,较高的NIHSS评分是机械取栓治疗后出血转化的独立危险因素,但其具体机制需要进一步研究.
本研究提示颅内出血组患者前循环大血管闭塞的急性脑梗死患者比例(85.71%)显著高于非HT组(70.97%),提示前循环脑梗死患者取栓后更易出现颅内出血转化.Novakovic等[22]的研究表明,前循环系统急性脑梗死血管内治疗后出现颅内出血转化的风险高于后循环系统.其可能原因为:(1)大脑中动脉发出的豆纹动脉多与载体动脉垂直,承受的血流动力学压力较大,而且取栓支架容易对垂直发出的豆纹动脉造成机械性损伤,从而导致豆纹动脉易破裂出血;(2)后循环的脑组织和血管组织对缺血的耐受性较好,血管再通时正常血管壁组织及功能保留相对完好,故出现血液渗出或血管破裂的风险相对较小,所以大多研究和指南都指出后循环脑梗死的取栓时间窗可适当延长,另外本研究提示HT组术后的收缩压水平明显高于非HT组,术后的血压过高可能导致脑组织过度灌注,血管通透性改变,出现再灌注损伤,再灌注损伤后又可能会导致血压进一步升高[23],二者互为因果,最终可能出现颅内出血转化.但本研究Logistic 回归分析并未显示前循环取栓和术后收缩压较高是脑出血的独立危险因素,需要扩大样本量进一步研究分析.
本研究的不足之处为病例数较少,且为来自单中心的回顾性研究,对一些其他出血转化的影响因素,如取栓次数、取栓支架的选择、术前侧支循环的分级、血糖水平等未纳入分析,下一步需要多中心、大样本、更加完善的临床资料来进一步证实影响急性脑梗死患者机械取栓后颅内出血转化的相关因素.
综上,机械取栓后颅内出血转化受到诸多因素的影响,有必要在术前对每个脑梗死患者进行完善的个体化评估,充分确认其术后出血转化的风险.需要医生能快速识别大动脉闭塞的患者,制定完善的绿色通道流程,减少院内延误.提高手术者操作技巧,尽量缩短发病至再灌注时间,对心源性栓塞及神经功能缺损症状严重的患者充分交代术后脑出血风险,对患者围手术期的血压等密切监测,预防过度灌注等,均有益于尽量降低机械取栓术后颅内出血转化的风险.

