早期不同浓度吸氧与急性心肌梗死患者短期主要不良心血管事件的相关性
王用 陈璐 邢玉龙 刘华英 王文彬
急性心肌梗死(AMI)是严重威胁人类生命安全的主要疾病之一。2015年心脑血管疾病的住院费用中,AMI为153.40亿元[1]。吸氧治疗用于AMI患者已有较悠久的历史。然而目前国内外对于AMI患者是否应该进行早期氧疗存在争议,且争议逐年增加[2-3]。AMI后梗死区发生缺血缺氧,心肌细胞坏死[4],引起组织不同程度低氧血症的临床表现,而目前对于AMI是否吸氧治疗存在较多争议,且多数研究只局限于急性ST段抬高型心肌梗死,而对非ST段抬高型心肌梗死的研究较少。同时在指南推荐方面也无明确的指导性内容,霍勇和葛均波教授等主编的《急性ST段抬高型心肌梗死溶栓治疗的合理用药指南》[5]中提出诊断明确应立即行指氧饱和度(SpO2)监测,可酌情考虑不同方式给氧。但指南中并未涉及到吸氧流量、吸氧浓度及持续时间的推荐。早期吸氧治疗AMI的大多数证据是基于非随机对照试验、非临床试验及临床经验,而随机对照试验(RCT)则较少、样本量较小且结论不一致[6]。本研究通过探讨早期不同浓度吸氧与AMI患者短期主要不良心血管事件(MACE)的相关性,旨在为AMI患者提供较为适用的吸氧浓度和吸氧时间。
对象与方法
1.对象:2018年10月~2020年2月于我院住院的AMI患者105例,采用随机数字表法分为3组:不吸氧组(吸空气)35例、低浓度吸氧组(吸氧1~3 L/min)35例、高浓度吸氧组(吸氧4~5 L/min)35例。纳入标准:(1)符合《急性冠脉综合征急诊快速诊治指南(2019)》[7]中关于AMI的诊断标准;(2)SpO2≥94%;(3)发病12 h以内;(4)接受PCI治疗。排除标准:(1)入院时SpO2<94%;(2)心肺复苏术后;(3)killip心功能Ⅲ级以上;(4)合并严重肺部疾病;(5)合并严重肝、肾功能不全;(6)合并消化道出血。本研究经我院伦理委员会审核批准,所有患者均签署知情同意书。
2.方法
(1)治疗方法:所有患者入院后立即采用鼻导管吸氧或吸空气,持续48 h。根据AMI指南对患者采用标准化药物治疗(双联抗血小板聚集、抗凝、调脂、抗缺血药物、β受体阻滞剂),且均接受PCI治疗。
(2)观察指标:包括性别、年龄、吸烟史、BMI、病史、入院时收缩压、舒张压、空腹血糖及血脂、血肌酐、CK-MB峰值、全球急性冠状动脉事件注册(GRACE)评分、氨基末端脑钠肽前体(NT-proBNP)等,采用心脏超声检测左心室射血分数(LVEF)和左心室舒张末期内径(LVEDD)。患者住院期间发生的MACE包括心绞痛、再次心肌梗死、急性心力衰竭、心源性休克、心源性死亡、严重心律失常[频发室性早博(简称室早)、室性心动过速(简称室速)、心室颤动(简称室颤)、初发心房颤动(简称房颤)、严重心动过缓(心率<50次/分)、Ⅱ度以上房室传导阻滞]。

结 果
1.不同吸氧浓度组患者临床资料比较:不吸氧组、低浓度吸氧组及高浓度吸氧组患者性别、年龄、有吸烟史、高血压病史、糖尿病病史患者比例、收缩压、舒张压、总胆固醇、低密度脂蛋白胆固醇、血肌酐、空腹血糖及CK-MB峰值比较差异均无统计学意义(P>0.05),而3组发生MACE患者比例比较差异有统计学意义(P<0.05),见表1。
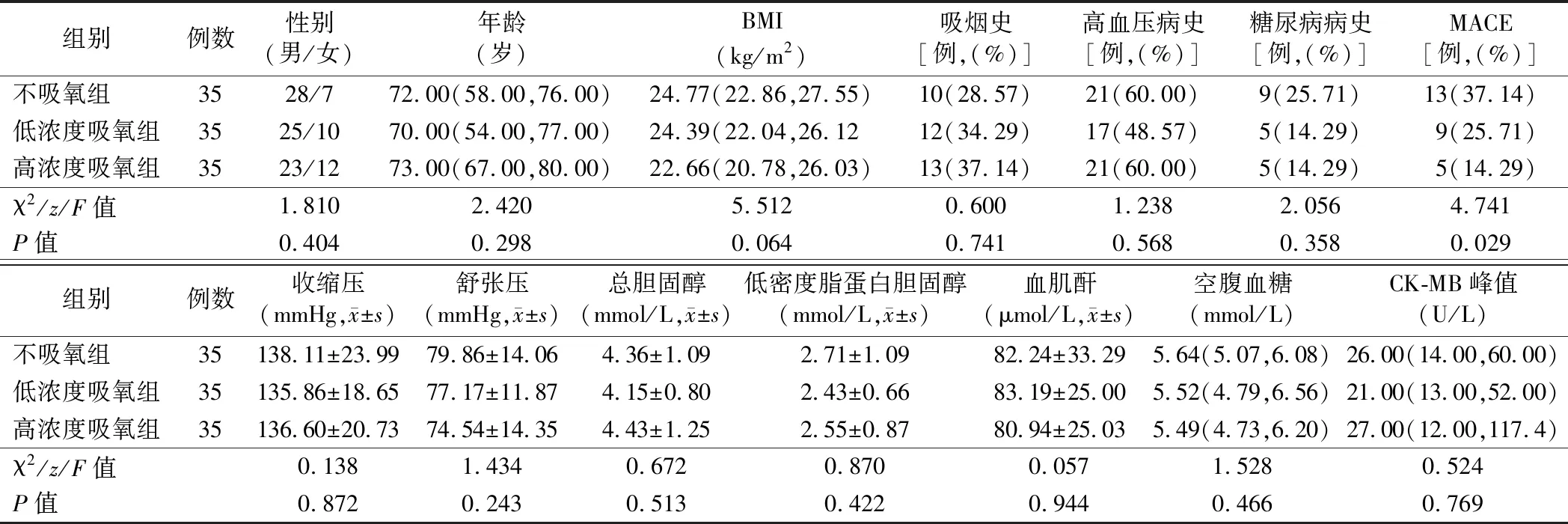
表1 不同吸氧浓度组患者临床资料比较[M(P25,P75)]
2.MACE组和非MACE组患者临床资料比较:105例患者住院期间,共27例发生MACE(MACE组),其中14例发生恶性心律失常,7例发生急性左心衰竭,3例发生心源性休克,3例发生再次心肌梗死,78例患者未发生MACE(非MACE组)。MACE组和非MACE组患者性别、年龄、有吸烟史、糖尿病病史患者比例及空腹血糖、血清胱抑素C水平比较差异均无统计学意义(P>0.05)。MACE组患者BMI、有高血压病史患者比例、GRACE评分、左心室舒张末期内径、NT-proBNP、血肌酐水平及CK-MB峰值均高于非MACE组,而LVEF低于非MACE组(P<0.05)。见表2。
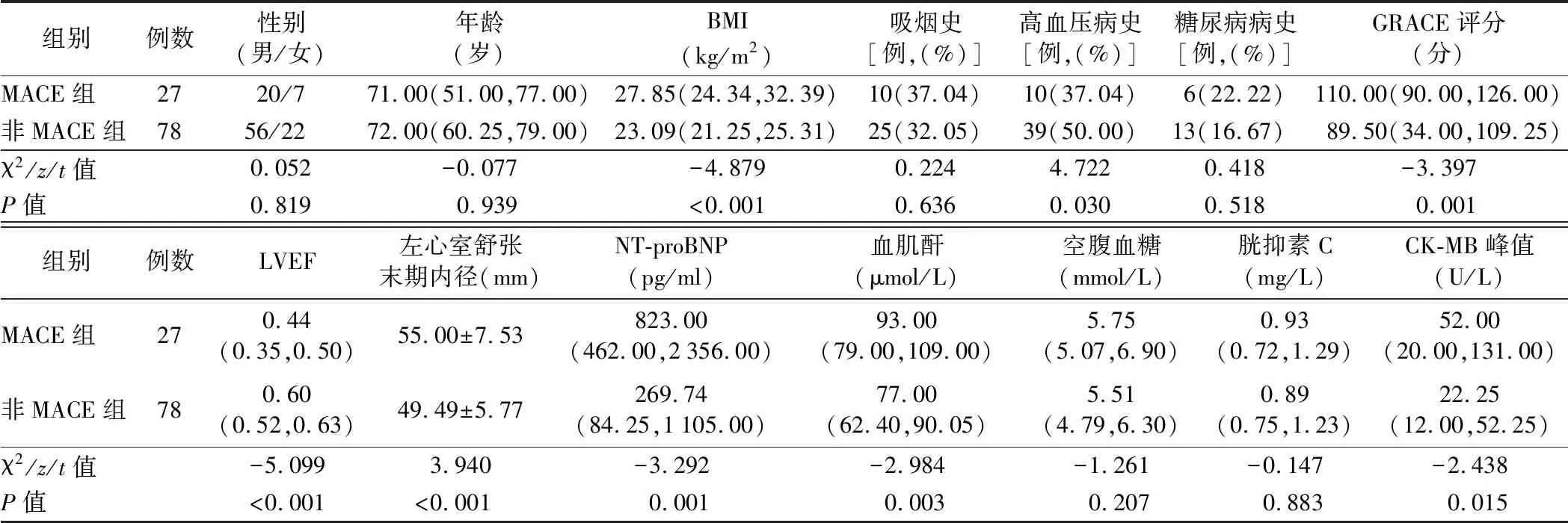
表2 MACE组和非MACE组患者临床资料比较[M(P25,P75)]
3.AMI患者发生MACE危险因素的单因素logistic回归分析:将吸空气和吸氧1~3 L/min患者合并为低浓度吸氧,吸氧4~5 L/min为高浓度吸氧。单因素logistic回归分析结果显示,高BMI、高血压病史、低吸氧浓度、低LVEF、高左心室舒张末期内径、高GRACE评分、高血肌酐水平、高CK-MB峰值是AMI患者发生MACE的危险因素(P<0.05);而年龄、性别、吸烟史、糖尿病病史、低密度脂蛋白胆固醇、空腹血糖、NT-proBNP、血尿酸水平与AMI患者发生MACE无相关性(P>0.05)。见表3。
4.AMI患者发生MACE危险因素的多因素logistic回归分析:进一步排除混杂因素的影响,采用进入法将BMI、高血压病史、吸氧浓度、LVEF、左心室舒张末期内径、GRACE评分、血肌酐、CK-MB峰值进行多因素logistic回归分析,结果显示,低浓度吸氧AMI患者发生MACE的风险是高浓度吸氧的4.393倍(P<0.05);有高血压病史AMI患者发生MACE的风险是无高血压病史患者的7.811倍(P<0.05);而LVEF每增加1%,AMI患者发生MACE的风险下降10.2%(P<0.05);BMI每增加1%,AMI患者发生MACE的风险增加1.3%(P<0.05);CK-MB每增加1%,AMI患者发生MACE的风险增加0.8%(P<0.05)。见表4。
讨 论
AMI是由于大面积心肌缺血坏死,心肌细胞缺血缺氧导致。临床上通常对AMI患者进行吸氧治疗,但存在一些争议。Valko等[8]的研究结果表明,吸氧可降低38%的梗死面积并显著提高LVEF,改善心功能。研究表明对于血氧饱和度正常的患者吸氧可诱发氧自由基水平升高,增加梗死面积[9]。而动物实验结果显示,缺血病变可诱发白细胞的炎症反应和趋化作用,加重缺血后再损伤,最终导致细胞死亡[10]。
本研究中,不吸氧组、低浓度吸氧组及高浓度吸氧组发生MACE患者比例比较差异有统计学意义,表明有效的吸氧可减少AMI患者MACE的发生,但具体机制尚不明确。而有研究报道,高浓度吸氧可影响AMI患者心肌的微循环,增加冠状动脉的血管阻力而减少冠状动脉血流量,减少临床并发症和AMACE的发生[11],与本研究结果一致。
本研究结果显示,MACE组患者BMI、有高血压病史患者比例、GRACE评分、左心室舒张末期内径、血肌酐、NT-proBNP水平及CK-MB峰值均高于非MACE组,而LVEF低于非MACE组。临床上发生MACE的AMI患者往往合并大面积心肌梗死,LVEF下降,同时合并肥胖、高血压病史等高危因素。本研究中多因素logistic回归分析结果显示,低浓度吸氧AMI患者发生MACE的风险是高浓度吸氧的4.393倍;有高血压病史AMI患者发生MACE的风险是无高血压病史患者的7.811倍;而LVEF每增加1%,AMI患者发生MACE的风险下降10.2%;BMI每增加1%,AMI患者发生MACE的风险增加1.3%;CK-MB每增加1%,AMI患者发生MACE的风险增加0.8%。有研究表明,吸氧可降低AMI患者的梗死心肌面积并显著提高LVEF,改善心功能和预后,但其中并未涉及吸氧浓度的不同[8],而本研究结果显示,高浓度吸氧可改善AMI患者预后。然而也有研究结果显示,自由氧疗可提高AMI患者的生存率但不会改善患者其他重要结局,SpO2>96%患者进行吸氧可能不利[12]。Siemieniuk等[13]发表的《急性疾病患者氧疗:临床实用指南》同样强调了盲目给AMI患者吸氧的错误性。但以上研究并未涉及给氧流量和时间,同时评价的终点事件和随访时间也不同。本研究结果显示,低浓度吸氧AMI患者发生MACE的风险是高浓度吸氧的4.393倍,同时高BMI、高血压病史、低LVEF、高左心室舒张末期内径、高GRACE评分、高血肌酐水平、高CK-MB峰值是AMI患者发生MACE的危险因素。
综上所述,临床上对AMI患者采用不同浓度的吸氧治疗可能会得到不同的研究结果。早期高浓度吸氧(4~5 L/min)可明显降低AMI患者MACE的发生率。但本研究仍有不足,样本量较小、评估时间较短、未对AMI进行分类,这是以后研究的努力方向。

