新型国产体外膜氧合系统用于大动物短期心肺辅助的模型建立
蔡黎明,刘 刚,张巧妮,高思哲,齐嘉琛,闫姝洁,吉冰洋
心肺辅助是重要的体外生命支持技术,体外膜氧合(extracorporeal membrane oxygenation,ECMO)及心室辅助在临床中的应用日益广泛,这与相关技术和机械设备的发展密切相关[1]。 相关研究在近年来受到广泛关注,但基于伦理学等问题的考虑,临床研究仍十分受限,因此需要建立稳定的大动物模型来开展深入研究。 本课题组前期已成功建立外周型静脉-动脉体外膜氧合(veno-artery extracorporeal membrane oxygenation, V-A ECMO)大鼠模型[2],在此基础上本研究希望建立易于管理且接近临床的外周型V-A ECMO 及清醒左心室辅助大动物模型。
1 实验材料与方法
1.1 实验动物 本实验经阜外医院动物实验伦理委员会批准(0098-1/2-9/2-HX(X))。 所有实验动物均为本院动物实验中心提供的5 ~6 月龄的健康动物,其中家猪3 只(体重分别为:74 kg、82 kg、110 kg;均为雌性),实验用小型猪1 只(体重43 kg,雄性);山羊1 只(体重78 kg,雌性)。
1.2 麻醉及术前准备 猪:所有实验猪均禁食过夜(12 h 以上),术前4 h 禁水。 术前称重后肌肉注射舒泰0.5 mg/kg、速眠新1 mg/kg;随后经耳静脉注射2~4 mg/kg 丙泊酚,进行麻醉诱导,诱导完成后将实验动物平卧位固定于手术台上。 随后置入导尿管连接尿袋(雌性动物进行无创导尿管导尿,雄性动物采用膀胱造口术进行有创导尿)。 所有动物经口气管插管,根据动物体重及气道状态选取合适型号气管插管,根据术中动物实际情况及血气结果调整呼吸机参数。 术中吸入2%~3%异氟烷维持麻醉。 山羊:实验羊的麻醉诱导过程同上,诱导完成后右侧卧位固定于手术台上,在完成手术操作后逐渐实现麻醉苏醒,实验过程中动物处于清醒且自主活动状态。
1.3 外科准备 猪:手术部位备皮、消毒。 完成外周监测通路的置管后,充分游离暴露右侧颈动、静脉后经外周静脉通路给予10 000 U 肝素进行全身肝素化,活化凝血时间(activated clotting time, ACT)>300 s 后开始直视下穿刺置管。 根据动物体重及血管条件选择合适型号插管,动脉选择16~20 Fr 插管(Edwards),静脉选择18~25 Fr 插管(Edwards)。 导丝引导下逐级扩张后置入动静脉插管(动脉插管置管深度8 ~10 cm,静脉置管尖端位于右心房中部),ECMO 设备于外科操作前完成预充排气,以上所有操作顺利完成并确保无误后将颈动、静脉插管与ECMO 系统动静脉端分别连接,连接过程中注意无菌操作,并避免系统进气。 连接完成后分别核对动静脉管路,确认无误后开始ECMO 转流并调整至合适的流量,同时根据血流量设置相应的通气流量和氧浓度。 注意牢固固定管路及插管,避免造成插管移位或脱出。 术中注意观察猪置管部位皮肤有无红肿、渗血等情况。 羊:手术基本操作如上所述,麻醉状态下左侧开胸暴露心尖和降主动脉,分别置入22 Fr 金属直角腔静脉插管(Medtronic),插管前经外周静脉通路给予10 000 U 肝素进行全身肝素化,置管成功后充分止血并牢固固定插管避免插管脱出或移位。左心室辅助装置完成预充排气后与插管连接并开始转流,随后逐渐减停麻醉药物,动物苏醒并自由活动。
1.4 管路及设备 猪:ECMO 系统组成(如图1)包括:离心泵主机及控制器(江苏赛腾医疗科技有限公司)、离心泵(江苏赛腾医疗科技有限公司)、管路(MEDOS)、氧合器(MEDOS)。 ECMO 系统预充排气采用850 ml 生理盐水完成无血预充。 ECMO 循环示意图见图2。

图1 ECMO 系统组成
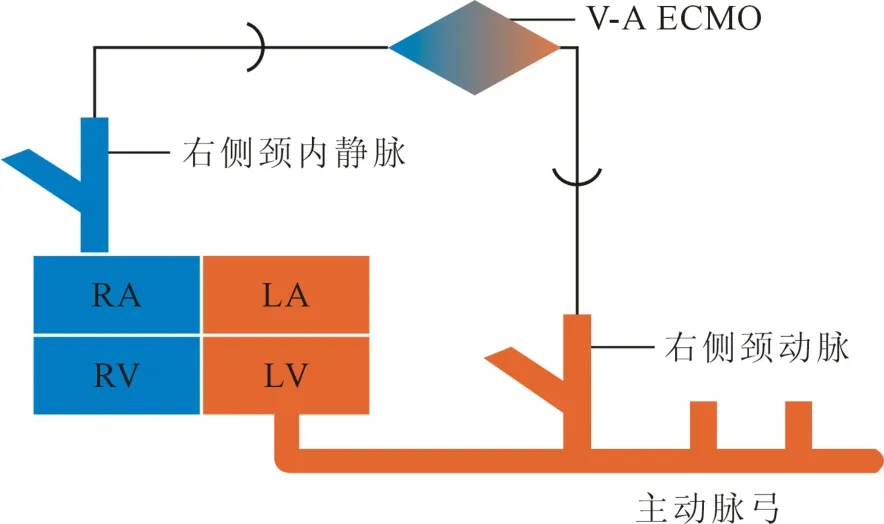
图2 ECMO 循环示意图
羊:左心室辅助系统组成包括:常规体外循环管路,离心泵主机及控制器(江苏赛腾医疗科技有限公司)。 系统预充采用400 ml 生理盐水实现无血预充。 左心室辅助循环示意图如图3。

图3 左心室辅助循环示意图
1.5 转流过程 猪:置管前抽取动脉血气,监测ACT>300 s 开始颈动、静脉置管,置管成功后与ECMO 系统连接,保证管路通畅且无气体进入,开始ECMO 转流。 术中肝素泵以12~50 U/(kg·h)的速度经外周静脉持续泵入,维持ACT 在100 ~300 s。离心泵起始转速为2 500 r/min、流速为1.2 L/min,术中根据动物情况逐渐加大转速以维持充足的器官灌注。 ECMO 系统气源来自实验室中心气源,通气量为1.5 L/min,氧浓度为60%,术中根据血气结果进行调整。 恒温水箱温度设置为36 ~38℃,术中注意维持实验动物体温于36~37℃。 术中注意关注动物尿的颜色及尿量,关注动物容量状态,保证出量与入量的基本平衡以维持充足的静脉引流;术中补充液体原则为晶体∶胶体为1 ∶2。 ECMO 转流时间分别如下:实验动物1 转流24 h,实验动物2 ~3 转流48 h,实验动物4 转流72 h。 实验动物5(山羊):心尖及降主动脉置管成功后与左心室辅助系统连接,保证系统密闭无气体进入。 抽取动脉血监测ACT>500 s 开始转流,术中按需经外周静脉补充肝素(由于清醒动物实验,未给予肝素持续泵入)。 离心泵转速为2 495 r/min、流速1.8 L/min,术中关注动物麻醉苏醒及进食水情况,牢固固定插管和机器,避免动物活动造成脱出,转流时间为24 h。
1.6 数据处理 猪:每只实验动物分别于术前、术中和结束前监测血气、凝血及游离血红蛋白浓度(根据实验动物具体情况作出调整),并记录相关指标的值。 羊:每8 h 监测游离血红蛋白浓度并记录。
2 结 果
所有实验动物均顺利完成实验,术中生命体征平稳,过程中无动物死亡,实验结束后均于麻醉状态下给予高钾溶液处死。 各实验动物具体结果分别如下:
2.1 实验动物1 该实验动物为小型实验用猪,体重43 kg,雄性,ECMO 转流时间为24 h。 ECMO 转流参数见表1,该结果提示实验过程中机器运转正常,转速与流速基本匹配;游离血红蛋白浓度见图4,该结果提示未见游离血红蛋白明显升高;血气结果见表2,实验过程中该动物血红蛋白浓度出现下降,可能存在明显血液稀释,其余指标基本平稳;凝血相关指标检测结果见表3,该结果提示术中抗凝稳定。
2.2 实验动物2 该实验动物为家猪,体重74 kg,雌性,ECMO 转流时间为48 h。 ECMO 转流参数见表1,游离血红蛋白浓度见图4,血气结果见表2,凝血相关指标检测结果见表3,以上结果均未见异常,提示术中平稳。
2.3 实验动物3 该实验动物为家猪,体重82 kg,雌性,ECMO 转流时间为48 h。 ECMO 转流参数见表1,游离血红蛋白浓度见图4,血气结果见表2,凝血相关指标检测结果见表3,以上结果均未见异常,提示术中平稳。
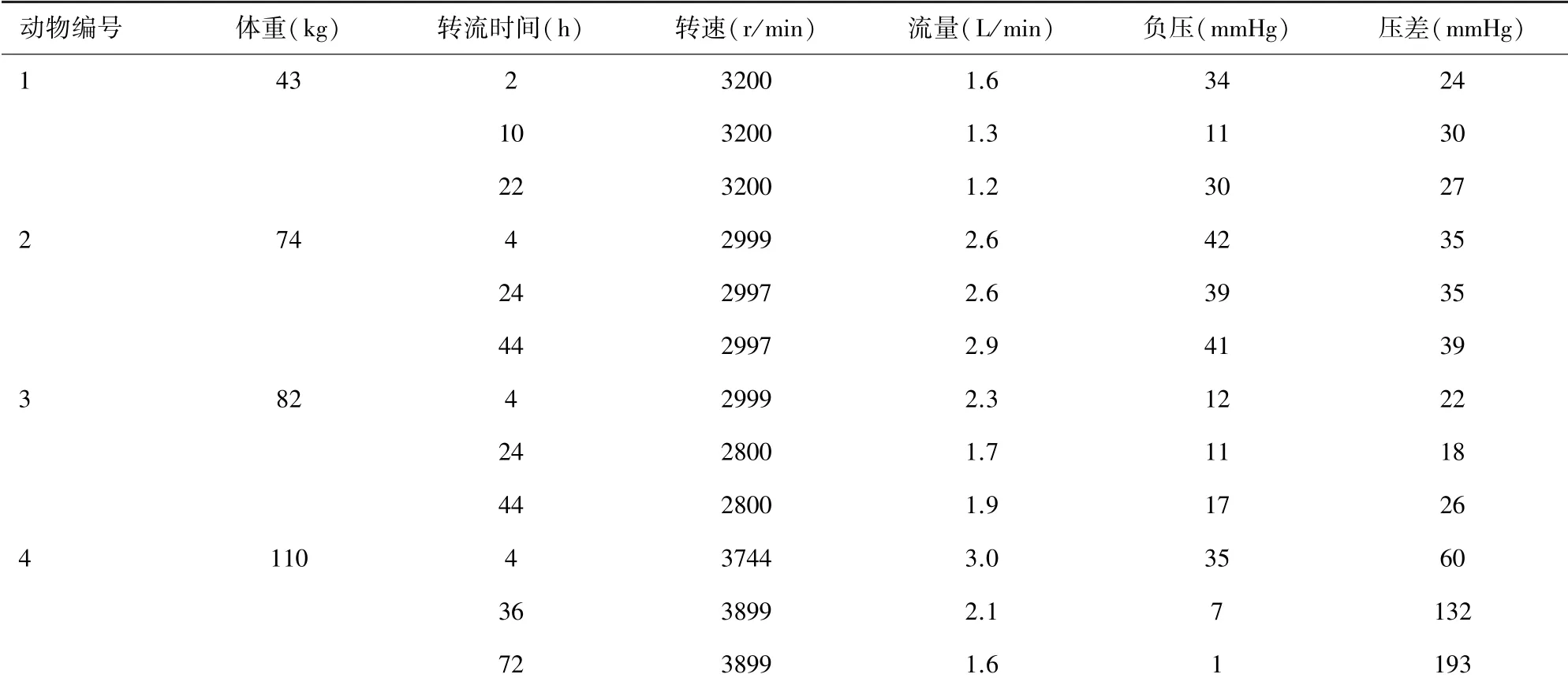
表1 实验动物辅助循环转流参数
2.4 实验动物4 该实验动物为家猪,体重110 kg,雌性,ECMO 转流时间为72 h。 ECMO 转流参数见表1,该结果提示跨膜压差较大,可能存在氧合器血栓形成;游离血红蛋白浓度见图4,该结果提示游离血红蛋白浓度升高,可能存在血栓形成造成血液破坏增加;血气结果见表2,该结果未见异常;凝血相关指标检测结果见表3,该动物术中抗凝效果欠佳。
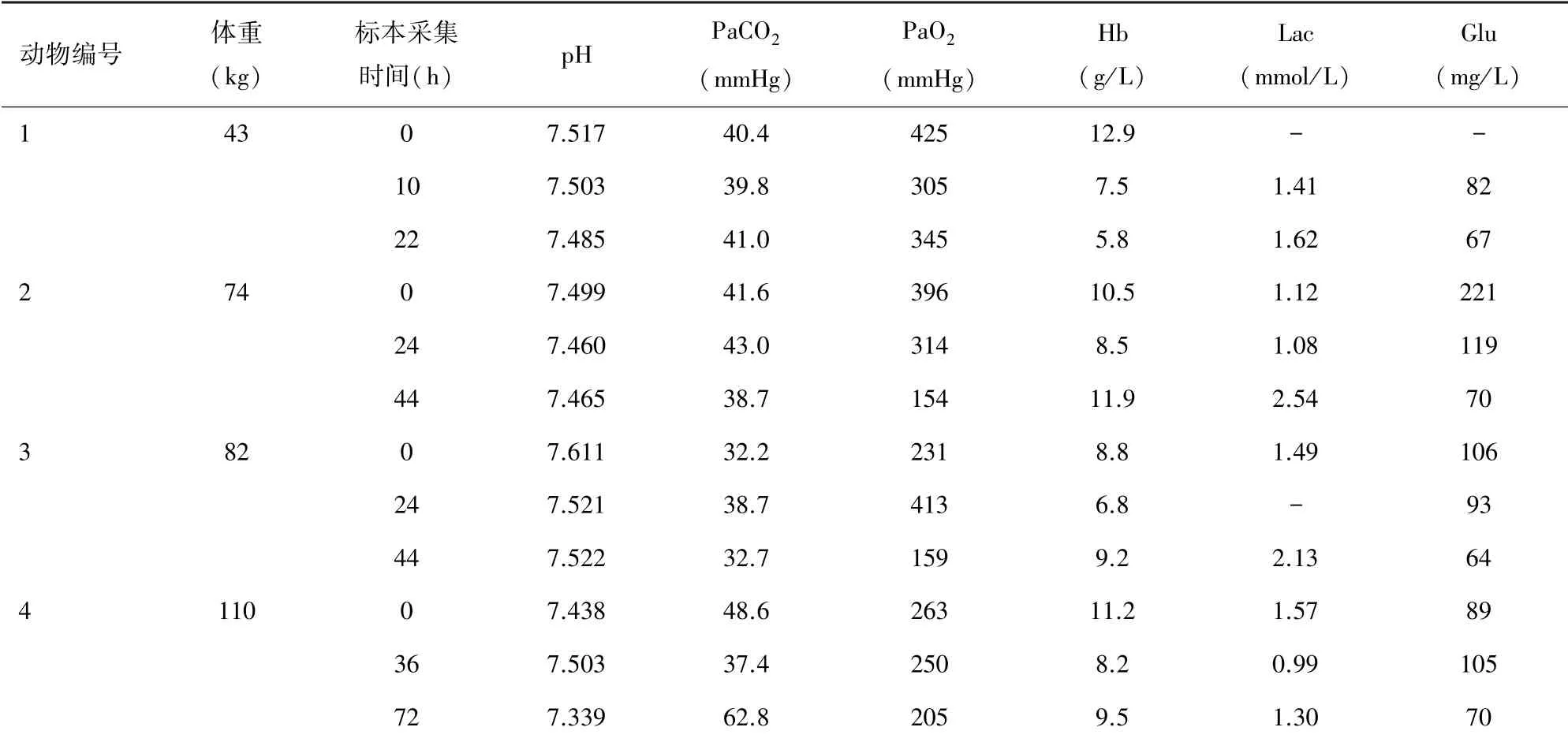
表2 实验动物血气结果
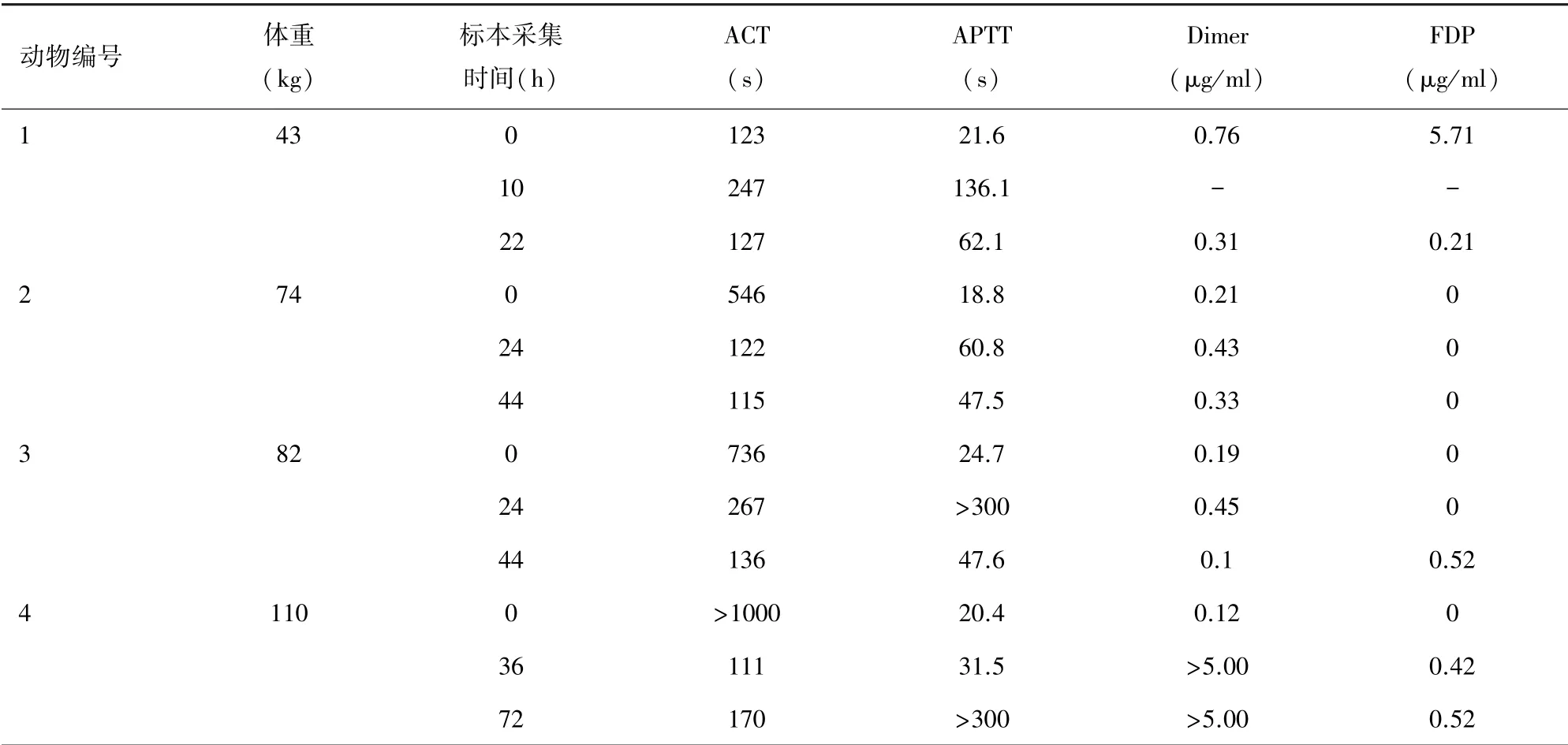
表3 实验动物凝血结果
2.5 实验动物5 (山羊) 该实验动物为山羊,体重78 kg,雌性。 左心室辅助转流时间为24 h,转流参数见表1,该结果未见异常。 游离血红蛋白浓度见图4,该结果未见异常。 动物术中状态平稳,麻醉苏醒状态稳定,可自主活动(见图5~6)。
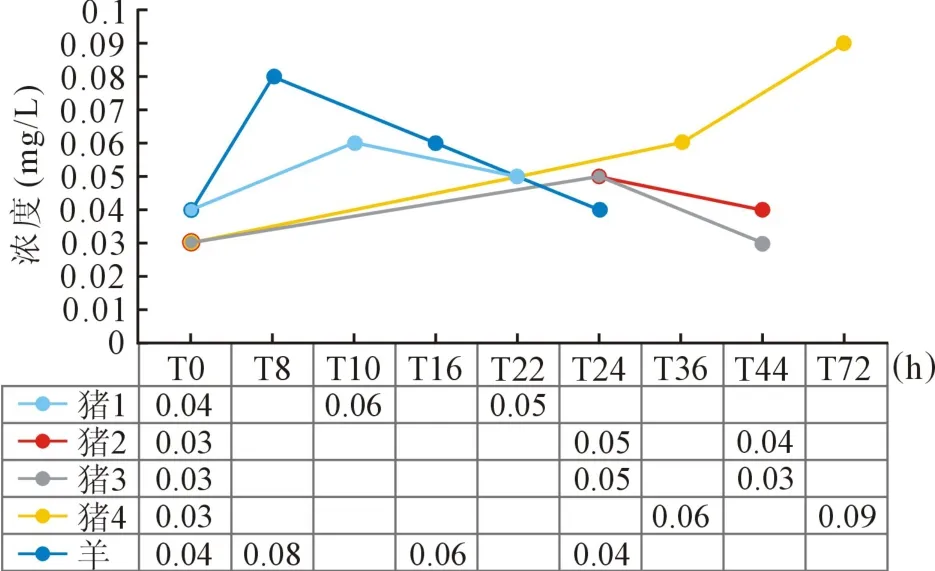
图4 实验动物游离血红蛋白浓度
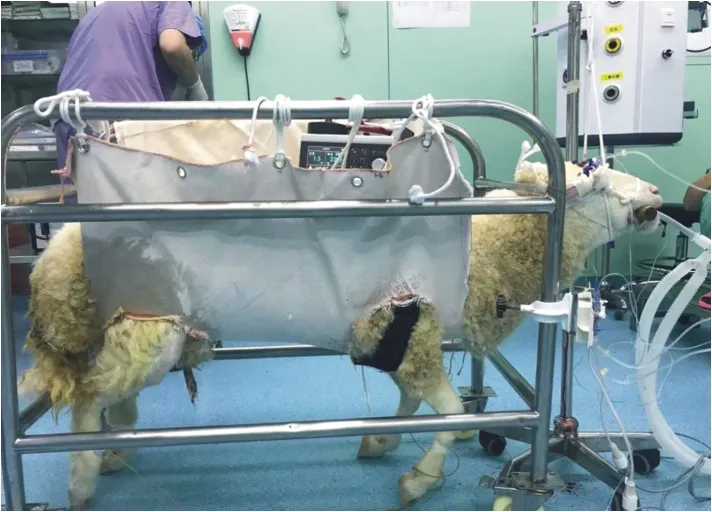
图5 山羊术后苏醒支具辅助阶段

图6 山羊清醒及辅助后完全自主活动
3 讨 论
当患者的心肺功能严重受损时,ECMO 作为心肺辅助的技术之一,可以代替肺的气体交换功能和心脏的泵血功能,维持全身氧供和血流动力学的稳定,保障全身脏器充分有效的氧合血灌注[3-6],使氧供与氧耗逐渐恢复平衡,从而纠正组织器官缺氧,使内环境恢复稳定。 V-A ECMO 在循环辅助方面的应用给患者带来显著生存获益,受到广泛关注;左心室辅助也是有效的心脏辅助手段之一,可以有效减少左心室的做功,有利于心脏功能的恢复。 本研究着眼于探索上述两种心肺辅助大动物模型的建立,并就建立过程中的关键问题进行讨论。
3.1 外周型V-A ECMO 模型初步探索 国内外报道的大动物V-A ECMO 模型多是选用体重较小的实验动物[7-11],因此本研究第一只实验动物选取体重43 kg 的小型猪进行探索。 通过对该动物实验过程总结发现,体重较小的动物血容量较少且血管偏细,实验过程中难以保证充足的静脉引流,大量补充液体会造成明显血液稀释;术中管理难度大,不适宜应用于中短期V-A ECMO 模型的建立。 基于上述考虑,本研究将后续实验动物调整为体重较大的家猪,并逐渐延长ECMO 转流时间,以探索中短期V-A ECMO 模型的最佳动物选择。 最终结果提示体重在60~90 kg 的雌性家猪为中短期外周型V-A ECMO大动物模型的最佳动物选择,该种动物体重适中,插管型号和ECMO 实际运行参数等均接近临床中的实际应用情况,术中引流量充足,管理难度小,模型稳定性高。
采取股动、静脉的插管方式[3-7]不适用于体重较大且转流时间较长的实验动物,主要是由于该种插管方式下的静脉插管长度相对偏短,难以到达实验猪的右心房水平,很难保证充足的静脉引流量,进而影响ECMO 的辅助效果。 因此本研究采用颈动、静脉插管方式,静脉插管能顺利置于右心房中部,在保证充足静脉引流的同时减小了护理难度,同时采用国产新型便携式设备(赛腾医疗OASSISTTMECMO系统,未上市)辅助完成实验,便于长时间心肺辅助研究的开展。
3.2 山羊清醒左心室辅助模型初步探索 基于对上述猪V-A ECMO 模型的总结,本研究尝试进一步探索清醒心肺辅助大动物模型的建立。 清醒的动物模型有利于动物摄取食物和水,避免营养不足及长时间麻醉带来的风险。 清醒的动物模型需要选用性情温和的动物,避免动物躁动导致插管脱出等不良事件的发生,因此清醒的动物模型选用山羊来完成实验。 动物实验中过大过多的设备对动物的活动限制极大,增加了清醒ECMO 的管理难度,不适宜长时间转流,本实验采用便携式设备来建立左心室辅助的清醒模型,该模型管路简单、动物负重小、操作难度小、易于护理、成功率及稳定性高,适合长时间的转流。
3.3 实验结果分析 外周型V-A ECMO 模型所涉及的4 只实验猪均顺利完成实验,未出现动物死亡,插管过程顺利,术中生命体征平稳,血气结果满意。本实验选取4 只不同品系和体重的猪完成实验,并逐渐延长ECMO 转流时间,用以探索适合该模型的最佳实验动物选择。 最终实验结果表明:所有实验动物术中血气结果平稳,说明ECMO 过程中的通气管理策略满意。 实验动物1~3 术中凝血指标控制满意,未见血栓形成和出血等并发症。 实验动物4 转流时间最长,为72 h;随着ECMO 时间的延长,逐渐出现ACT 数值的下降,加大肝素剂量后无明显改善,并且出现膜肺前后压力差的明显增加以及游离血红蛋白浓度的升高;提示膜肺内部阻力较大、可能有血栓形成,当血液通过阻力较大的膜肺时,剪切应力增加而产生了血液破坏,进而造成游离血红蛋白浓度的升高。 该实验结果可能是由于抗凝不足导致;也可能是长时间的抗凝造成机体凝血系统紊乱,且无法输注红细胞和血小板等血制品,最终导致凝血功能紊乱无法纠正;也有可能是实验动物的个体差异导致。 结合4 只动物术中情况考虑:体重较小的实验动物1(43 kg)难以保证充足的静脉引流;体重过大的实验动物4(110 kg)与临床实际偏差较大,术中管理难度大;实验动物2 ~3(60 ~90 kg)术中各项指标平稳、静脉引流充足、贴合临床实际、未出现不良事件。
清醒左心室辅助动物模型选取羊完成实验,插管过程顺利,无大量出血,术中动物生命体征平稳,麻醉苏醒顺利,24 h 机器运转正常。 清醒后动物可自由活动,并且能顺利进食水,未出现不良事件。
3.4 实验存在的不足 本实验存在的主要不足是动物数量较少,主要原因是由于本实验处于对全新模型建立的探索阶段,并未对具体临床问题进行研究,并且考虑到大动物实验的稳定性更高,所以选取的实验动物数量较少。 本实验的另一个不足是在抗凝管理方面,监测抗凝效果的指标较少,并且对于肝素抗凝不敏感的实验动物未能预先备选其他抗凝方案完成实验;由于选取的是正常动物且受限于实验条件,未能细化凝血监测指标,并且药物准备欠缺;由于受限于实验条件,无法进行红细胞、血小板等血液制品的输注,导致凝血功能紊乱难以纠正。 本实验相关抗凝结果提示,后续实验应提前准备预案,注意加强凝血监测和抗凝管理,结合凝血全项及ACT等各项指标综合评判[12]。 关于清醒左心室辅助模型,建立过程中应放置胸腔闭式引流,方便对实验过程中的出血情况进行监测。
4 结 论
本实验采用颈动、静脉置管的方式成功建立中短期外周型V-A ECMO 大动物模型,该模型可行性及稳定性高,并筛选出最佳的实验动物为60 ~90 kg的雌性家猪。 并且在便携式可穿戴设备的辅助下成功完成清醒左心室辅助大动物模型的建立。

