补气温阳法对慢性阻塞性肺疾病肺阳虚证大鼠的治疗作用及机制
冯毅, 郑岚, 阚竞, 杨岚, 黄帅, 杨来
(1.湖北省中医院,湖北武汉 430061;2.湖北中医药大学第一临床学院,湖北武汉 430061;3.重庆三峡医药高等专科学校附属医院,重庆 404120)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的以气流受限为特征的可预防和治疗的呼吸性疾病,常表现为气流受限不完全可逆,渐进性肺功能恶化[1],且其高患病率、高致残率、高病死率及病程长等特点给患者及其家庭带来了沉重的经济负担[2]。其发病机制复杂,多与香烟烟雾等有害气体或颗粒对气道及肺实质产生的非特异性炎症反应有关,主要表现为抗炎因子与促炎因子的失衡,从而产生慢性气道炎症[2]。中医药在治疗COPD相关疾病中有着悠久的临床实践经验,且疗效卓著,COPD是现代医学病名,经中医学者反复论证后,本病在中医学中被归属于“肺胀”的范畴,主要症状为胸部膨满、憋闷如塞、喘息上气、咳嗽痰多、烦躁、心悸、面色晦暗,甚者肢体浮肿等[3]。COPD的临床辨证分型多样,其中,肺阳虚学说经过多年的发展与论证,已被大多数中医学家所认同[4]。肺阳虚证在治疗上当以补气温阳为主。据临床观察发现,运用补气温阳法能提升患者肺功能,对改善患者生活质量等方面效果显著,且较西医具有明显的优势[5]。杨岚[6]对湖北省中医院肺病科2014—2015年收治的60位COPD肺阳虚患者进行临床治疗统计分析发现,同期患者中使用支气管舒张剂联合补气温阳中药配方治疗后病情改善情况显著优于单独使用支气管舒张剂治疗者。冯毅辨治肺系疾病发现,补气温阳中药可有效治疗不同症状的肺阳虚患者[7]。因此,本研究观察COPD肺阳虚证大鼠模型白细胞介素(IL)-8、IL-10、肿瘤坏死因子α(TNF-α)的动态变化来阐述COPD肺阳虚证的病理机制,使用自拟补气温阳中药对COPD肺阳虚证大鼠进行干预,以期为COPD肺阳虚证的病情评估提供新的依据,同时也为补气温阳法治疗COPD肺阳虚证提供更多的实验依据。现将研究结果报道如下。
1 材料与方法
1.1动物清洁级Wistar雄性大鼠50只,平均体质量为(200±20)g,购自湖北省疾病预防控制中心,动物质量合格证号:SCXK(鄂)2017-0056。实验于武汉华联科模型动物研究院进行,于屏障环境中饲养大鼠,温度为22~26℃,相对湿度为50%~60%,人工光照明暗各12 h。
1.2药物及制备自拟补气温阳方中药配方组成:黄芪30 g,白术12 g,防风、桂枝、白芥子、杏仁、肉苁蓉、补骨脂、炙甘草各10 g,炙麻黄、干姜、五味子各6 g。以上中药材均由湖北省中医院制剂室提供。将上述药物置于瓦罐中,加水至超过药物平面,浸泡20 min后,先用武火煮沸,再改用文火煎煮10 min,滤出药液。药渣再按照上法煎煮1次,滤出药液。将2次药液混合,再武火煮沸即可。然后将此药液浓缩成成品(生药量1.0 g/mL),放置于冰箱中冷藏备用。
1.3试剂与仪器脂多糖(LPS)(美国Sigma公司);“黄鹤楼”牌香烟(湖北中烟工业有限责任公司);瑞氏-吉姆萨复合染色液(北京雷根生物技术有限公司);大鼠IL-8、IL-10、TNF-α酶联免疫吸附分析(ELISA)检测试剂盒(武汉基因美科技有限公司)。有机玻璃熏烟箱(50 cm×40 cm×30 cm)自制;FCD-215SEA低温可调式冷柜(青岛海尔股份有限公司);AVL-OPTI动脉血液气体分析仪(罗氏瑞士公司);普通显微镜(美国奥林帕斯公司);低温冷冻离心机(德国Eppendorf公司);酶标仪(美国Bio-Tek公司)。
1.4 COPD肺阳虚证大鼠模型制备将50只大鼠随机分成2组,即正常组10只和造模组40只。将造模组大鼠先以烟熏及气管内滴注LPS的方法建立COPD大鼠模型,再加以寒凉环境刺激,复制阳虚证的病因,通过病证结合的方式构建COPD肺阳虚证模型。具体操作步骤:在造模的第1天和第14天,每只大鼠行气管内注入LPS(200μL/次),第2~49天(第14天除外)给予烟熏处理(50 g锯末和刨花+香烟14支/次,共同点燃制作熏烟环境,30 min/次,1次/d),烟熏15 min后进行寒冷刺激,将大鼠置于可调冷柜内(0~2℃),2次/d,2 h/次[8]。每天固定时间记录大鼠的饮水量及进食量,分别于第1、7、14、28、35、42、49天测量并记录大鼠背部温度及肛温。正常组大鼠不做任何处理,正常饲养。
1.5补气温阳方的制备及模型大鼠的分组处理全部造模成功。造模结束后,将造模组40只大鼠随机分成4组,即模型组,中药低、中、高剂量干预组,每组各10只。中药低、中、高剂量干预组根据人与动物体表面积折算出大鼠用药剂量,分别给予补气温阳方煎液8.0、16.0、32.0 g·kg-1·d-1灌胃,持续灌胃30 d。模型组大鼠给予16 mL/kg生理盐水灌胃。
1.6观察指标与方法
1.6.1 各组大鼠动脉血气指标检测 将大鼠用20 g/L戊巴比妥钠以3.0 mL/kg剂量腹腔内注射麻醉,采用肝素处理过的注射器行腹主动脉采血,立即进行动脉血气指标检测,分别测定二氧化碳分压(PaCO2)及氧分压(PaO2)。
1.6.2 各组大鼠血清中炎性细胞因子IL-8、IL-10及TNF-α指标检测 经大鼠腹主动脉采血,以2 000 r/min离心处理15 min,收集血清。具体检测步骤按照ELISA试剂盒说明书操作,经标准品的稀释与加样、加酶、温育、配液、洗涤、显色、终止及测定等步骤后,分别计算出IL-8、IL-10及TNF-α的实际浓度。
1.6.3 各组大鼠支气管肺泡灌洗液(BALF)中白细胞(WBCs)、中性粒细胞(NEUTs)计数 将大鼠用20 g/L戊巴比妥钠以3.0 mL/kg剂量腹腔内注射麻醉后,常规皮肤消毒,手术剪分离气管前组织,暴露气管,结扎远心端气管,用1 mL注射器行气管插管,注入37℃生理盐水0.5 mL,反复抽吸,重复3次。BALF回收率均在80%以上,收集置于1.5 mL的EP管中。取其中0.2 mL的BALF采用血细胞计数法在显微镜下进行WBCs计数。另取0.2 mL的BALF,离心重悬细胞沉淀涂片,晾干后行瑞氏-吉姆萨染色,在光学显微镜下观察,对中性粒细胞进行分类计算,最终得出BALF中NEUTs的数量。
1.6.4 各组大鼠肺组织病理学变化观察 BALF收集结束后,取大鼠的肺组织置于40 g/L多聚甲醛溶液中固定24 h后,依次进行组织常规脱水、透明、浸蜡、包埋、冷冻、切片(约4μm)、贴片、烘片后,进行HE染色:切片脱蜡、染色、脱水后再行二甲苯透明,中性树胶固定封片。光镜下观察肺组织病理学变化。
1.7统计方法采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(x±s)表示,多组间数据比较采用单因素方差分析,组间两两比较采用t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1各组大鼠动脉血气指标比较表1结果显示:与正常组比较,模型组大鼠PaO2显著降低(P<0.01),PaCO2显著升高(P<0.01);与模型组比较,中药低、中、高剂量干预组大鼠PaO2均显著升高(P<0.01),而PaCO2均显著降低(P<0.01),均呈剂量依赖性。
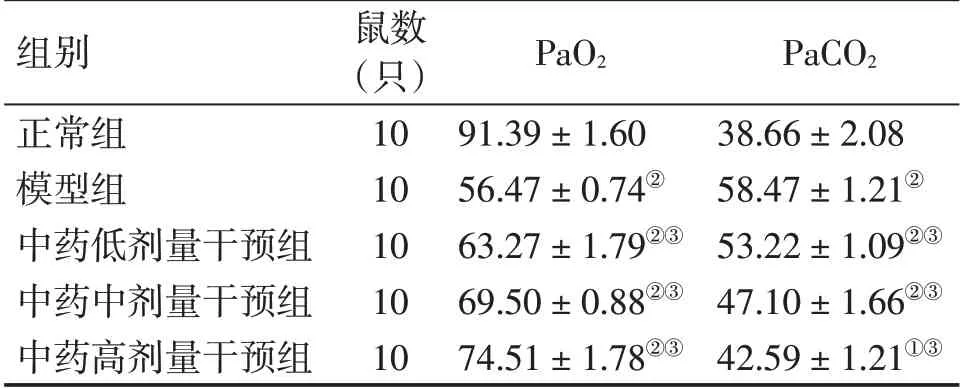
表1 各组大鼠动脉血气指标比较Table 1 Comparison of the arterial blood gas indexes in rats of various groups (x±s,mmHg)
2.2各组大鼠血清中炎性细胞因子IL-8、IL-10及TNF-α指标变化比较表2结果显示:与正常组比较,模型组大鼠血清中IL-10水平均显著降低(P<0.01),IL-8、TNF-α水平均显著升高(P<0.01);与模型组比较,中药低、中、高剂量干预组大鼠血清中IL-10水平均显著上升(P<0.01),而IL-8、TNF-α水平则均显著降低(P<0.01),均呈剂量依赖性。

表2 各组大鼠血清中IL-8、IL-10及TNF-α变化比较Table 2 Comparison of the levels of serum IL-8,IL-10 and TNF-αin rats of various groups (x±s,pg·mL-1)
2.3各组大鼠BALF中WBCs、NEUTs计数分析表3结果显示:与正常组比较,模型组大鼠BALF中WBCs、NEUTs数量均显著升高(P<0.01);而与模型组比较,中药低、中、高剂量干预组大鼠BALF中WBCs、NEUTs数量均不同程度降低(P<0.05或P<0.01),且呈剂量依赖性。
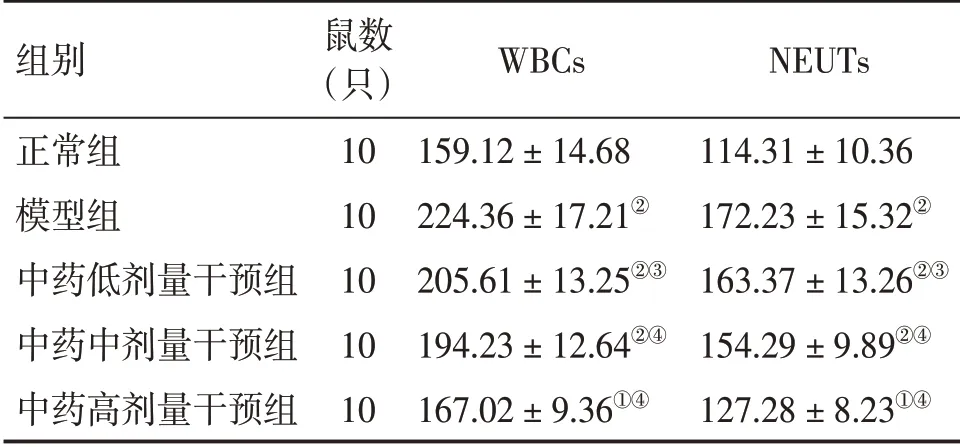
表3 各组大鼠支管肺泡灌洗液(BALF)中WBCs及NEUTs计数分析Table 3 Analysis of the counts of WBCs and NEUTs in BALF in rats of various groups(x±s,106个·L-1)
2.4各组大鼠肺组织病理学变化比较图1结果显示:正常组大鼠肺泡结构正常连续,肺泡壁完整,未见炎症细胞浸润。与正常组比较,模型组大鼠肺泡结构杂乱,肺泡壁断裂,胶原纤维增生明显,肺泡腔明显扩大,部分融合成肺大疱,同时伴有大量炎症细胞浸润;与模型组比较,中药低、中、高剂量干预组大鼠肺泡破损程度有所减轻,炎症细胞数目减少,肺泡结构逐渐趋于正常化,其中以高剂量的中药干预组大鼠肺组织病理变化改善最为显著。
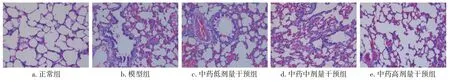
图1 各组大鼠肺组织病理变化比较(HE染色,×200)Figure 1 Comparison of the pathologicalchanges in rat lung tissue in various groups(by HE staining method,×200)
3 讨论
肺阳虚是慢性阻塞性肺疾病(COPD)患者的常见病证,贯穿稳定期的整个过程[9]。寒邪侵袭,首先犯肺,从而导致肺气受损、亏盈,阳气不足,内生寒邪发展为阳虚[7]。脏腑互通[10],长期肺阳虚则会影响他脏,子病及母,累及脾脏,母病及子,累及肾脏,加之脾虚,无以养肾,导致肾气亏虚,动则气喘,长则终致气损及阳,阴寒内生[11]。本研究根据肺阳虚COPD患者的发病原因,模拟病因建立肺阳虚证COPD大鼠模型。以香烟烟丝配合锯末、刨花点燃制烟为外邪,以冰柜环境制外寒[8]。对模型大鼠采用自拟补气温阳中药进行干预治疗,方中:黄芪具有补气升阳、益卫固表之功,直接参与机体的免疫调节作用[12]。防风具有解热、镇痛、抗炎、镇静、抗菌、抗肿瘤、抗过敏、提高机体免疫、抗凝血等药理作用[13]。黄芪健脾益气,白术健脾祛湿,二者可助脾之运化功能恢复,从而助力组方药效达肺经[6-7]。黄芪合防风,可行祛邪气而不伤正气之功[6]。桂枝、麻黄温通肺阳,干姜、白芥子温肺化饮,相互配伍使用,共行温阳化气之功,以温补肺阳,温通肺经。配伍苦杏仁,可止咳平喘,肉苁蓉、补骨脂可补肾纳气、温肾阳,五味子则行上敛肺气,下滋肾阴之功[6-7,14]。灸甘草及其提取物具有镇咳、平喘、痰祛、抗呼吸道病原体、抗炎、镇痛、调节免疫等作用[15],同时,甘草可调和诸药药性,行使药之职[7,14]。全方配伍使用以达治疗肺阳虚之效。
COPD可导致肺部进入的有效气体量减少,使机体处于相对缺氧的状态,可引发动脉血PaO2降低、PaCO2升高等并发症,因此,PaO2和PaCO2可间接反映出机体肺功能[16]。贾琦等[17]通过临床治疗的回顾性分析证明PaO2和PaCO2在COPD的临床诊断和鉴别诊断上具有重要的借鉴价值,因此,可用于模型的鉴定。本研究结果显示,与正常组比较,模型组大鼠PaO2显著降低,PaCO2显著增加,提示COPD大鼠模型构建成功。补气温阳法治疗COPD肺阳虚证大鼠后,大鼠动脉血PaO2提升,PaCO2降低,提示补气温阳法可改善COPD肺阳虚证大鼠肺功能。慢性气道炎症刺激是COPD的主要发病因素之一,参与COPD炎症反应的细胞通过释放不同的酶、炎症介质,引起一系列炎症改变,损伤支气管内皮细胞,长期慢性的炎症刺激导致气道重构,引起气道及肺组织的损伤、气道阻塞、气流受限等[18]。长期烟雾及污染的空气环境等因素刺激会导致的机体氧化-抗氧化平衡失调,过剩的氧化物可破坏蛋白质、脂质等生化分子,导致肺部血管、肺组织等的损伤,刺激并加重炎症反应[19-20]。研究发现,WBCs数量升高与COPD死亡率相关,IL-8、IL-10及TNF-α水平也与临床COPD的治疗结果有关[21]。NEUTs、嗜酸性粒细胞增多是COPD加重的标准之一[22]。本次研究结果显示,模型组大鼠肺组织出现肺泡结构杂乱、肺泡壁断裂、胶原纤维增生等COPD显著症状,且出现大量WBCs和NEUTs细胞,进一步提示模型组大鼠COPD模型构建成功,而经补气温阳法治疗可改善COPD肺阳虚证大鼠肺组织的病理变化,减轻炎症浸润,降低血清中促炎因子IL-8、TNF-α水平,升高抗炎因子IL-10水平,且减少WBCs和NEUTs的数量,提示补气温阳中药可减轻COPD肺阳虚证大鼠炎症反应。
综上所述,补气温阳法能通过调节机体促炎-抗炎因子表达平衡,发挥减轻COPD肺阳虚证大鼠炎症反应、改善肺功能的作用。

