丛枝菌根真菌对金叶六道木镉吸收及根际真菌群落结构的影响*
刘 琛,郭 彬,林义成,傅庆林,李凝玉
(浙江省农业科学院环境资源与土壤肥料研究所,杭州 310021)
2014 年《全国土壤污染状况调查公报》显示,我国土壤Cd 污染物点位超标率达到7.0 %,是主要污染物之一,严重影响作物的产量和品质,危害人体健康[1-2]。有关Cd 污染土壤的治理方法有很多,其中植物修复具有土壤扰动小、原位性、不产生二次污染等优点,是一种优先考虑的环境友好型修复技术[3]。
丛枝菌根(Arbuscular mycorrhizae,AM)真菌是土壤生态系统中一种同时具有植物根系和微生物特性的互惠共生体[4-5]。近年来,植物-菌根真菌联合修复已成为当前植物修复研究的热点。一方面菌根真菌对植物修复有直接强化作用,可以促进植物地上部分对重金属转运富集作用以及增强植物根系固持作用[6]。Liu 等[7]研究结果表明,在50 mg·kg–1Cd浓度条件下,接种Glomus versiforme 后,龙葵根、茎Cd 含量可分别增加61%和74%。另一方面可提升植物对重金属胁迫的抗性以及促进相应的解毒及耐受过程,提高植物在重金属污染环境的生存能力及活性,进而对植物修复产生间接强化效应[8]。Chen等[9]研究发现,接种AM 真菌后可以激发HMA3 的表达,将更多的Cd 固定在液泡中,从而减少Cd 从根系向地上部转移。Li 等[10]发现AM 真菌通过改变水稻Cd 化学形态和亚细胞分布,使水稻地上部和根系的Cd 浓度显著降低,从而增强水稻抗Cd 的能力。此外,AM 真菌产生的球囊蛋白也可以固定土壤中的Cd,减少有效Cd 含量[11]。AM 真菌的作用效果取决于AM 真菌种类、植物种类、重金属的浓度及土壤的基本性质[12-13]。当前关于植物-菌根共生体的研究主要集中于草本植物,如龙葵、东南景天等,而对木本植物的互作研究相对较少。
和超积累植物等草本植物相比,木本植物具有生物量大、根系发达的特点,对重金属具有较强的耐性和富集能力,例如圣栎、杞柳、蓝冰柏等[14-16]。研究表明,金丝垂柳 1011 对 Cd 的富集可达到231.4 μg·kg–1[17]。绿化苗木修复的关键在于其吸收和转移的Cd 总量,利用AM 真菌促进绿化苗木的吸收,通过绿化苗木吸收再移栽绿化的方式修复重金属污染土壤,不仅可解决修复植物残体后续处置的难题,同时还能在污染土壤上产出客观的经济效益,对推动土壤污染修复产业化具有重要意义[18]。
AM 真菌自身就是土壤微生物结构中重要的一部分,其结构及组成也会受到环境因子、土壤因子和生物因子的影响[19]。Cd 胁迫会影响AM 真菌的菌丝长度、代谢活性和功能[20-21]。接种AM 真菌也会影响植物的根际分泌,从而改变土壤微生物种群结构[22]。土壤中微生物种群通过吸收、固定、吸等方式对土壤中Cd 的行为起至关重要的作用[23]。因此,有必要明确接种丛枝菌根真菌后对绿化苗木根际土壤微生物群落结构的影响。
基于此,本文拟研究接种AM 真菌对不同绿化苗木吸收Cd 的影响,筛选出最佳组合,并探索接种AM 真菌后对绿化苗木根际土壤AM 真菌群落结构的影响,明确AM 真菌促进绿化苗木Cd 吸收的机理,以期为利用绿化苗木-AM 真菌联合技术修复Cd 污染土壤提供理论参考。
1 材料与方法
1.1 供试材料
收集矿区植物根际土壤混合样品,经风干后放入塑料袋内。AM 真菌孢子收集用湿筛法。
AM 真菌制备所用土壤是砂土,使用前121℃灭菌2 h,48h 后再重复一次,以灭绝土壤中所有真菌。将湿筛法得到的孢子,先移入蒸馏水反复清洗,然后再加入到灭菌土,充分混匀后装盆。宿主植物使用的是高梁种子。经过3 个月的生长,培养基质自然风干后磨碎过筛,此基质中所含的细根根段、菌丝和孢子作为土著AM 真菌菌种。自制备的土著AM 真菌标记为AMF1,由北京市农林科学院植物营养与资源研究所提供的摩西球囊霉真菌标记为AMF2(HK01,1511c001BGCAM0064)。
试验用绿化苗木包括:金禾女贞(Ligustrum quihoui)、金叶六道木(Abelia grandiflora ‘Francis Mason’)、茶梅(Camellia sasanqua Thunb.)、金森女贞(Ligustrum japonicum ‘Howardii’)、小叶蚊母(Distylium buxifolium)、红叶石楠(Photinia × fraseri Dress)、花叶女贞(Ligustrum sinense ‘Variegatum’)、红王子锦带(Weigela florida cv. Red Prince)、滨柃( Eurya emarginata( Thunb.) Makino)、 桂 花(Osmanthus fragrans(Thunb.)Lour)、金边胡颓子(Elaeagnus pungens var. varlegata Rehd.)和花叶锦带(Weigela florida cv. Variegata.),共12 种。
1.2 试验设计
试验共设置四个处理,分别为:CK,不加Cd;AM0,加Cd 和灭活AMF 菌剂对照;AM1,加Cd 和AMF1;AM2,加Cd 和AMF2。基质由浙江德清加州农业股份有限公司提供,按前述方法灭菌后按5%的接种量(w∶w)接种灭菌或未灭菌AM 菌剂。移入绿化苗木,稳定1 个月后,将 228 g CdCl2·2.5 H2O溶解于3 L 蒸馏水中,利用注射器均匀打入加Cd处理基质对照和加Cd 处理的基质淋溶液Cd 浓度分别为3 和10 mg·kg–1。
试验在浙江德清加州农业股份有限公司开展,培养期为2017 年1 月至12 月,共计12 个月。
培养6 个月时采集所有绿化苗木的叶片,烘干后测定其Cd 含量。12 个月后采集金叶六道木的根、叶片及枝条,烘干后测定其Cd 含量[24]。收集金叶六道木的根际基质进行后续分析。
1.3 土壤微生物磷酸脂肪酸组成的分析
采用修正的Bligh-Dyer 方法,以甲酯19:0 做内标,用 Aligent 6890 气相色谱仪测定,用 MIDI Sherlock 微生物鉴定系统[25]。其中脂肪酸15:0,17:0,i15:0,i16:0,i17:0,a15:0,a17:0,16:1ω7c,18:1ω7c,cy17:0 和cy19:0 用于指示细菌PLFAs,18:2ω6,9c 用于指示真菌PLFAs[26],16:1ω5c 用于指示AM真菌PLFAs[27]。
1.4 PCR 与测序
对每份土壤样品,菌根真菌采用一对特异性的引物扩增,引物序列为:AMV4.5NF(5′-AAGCTCGTAGTTGAATTTCG-3′)和AMDGR(5′-CCCAACTATCCCTATTAATCAT-3′)[28]。体系为25 μL,包括12.5 μL Buffer(2×)、2 μL dNTP、5 μL DNA 模板(20 ng)、正反引物各1 μL(10 μmol·L–1)和3.5 μL的灭菌双蒸水。阴性对照用灭菌双蒸水代替DNA作为反应模板。反应程序为:95℃ 10 min;95℃15 s,60℃ 30 s,72℃ 30s,40 循环。上述PCR 产物纯化后由天昊生物科技股份有限公司利用Illumina HiSeq 测序平台完成测序。
1.5 数据分析
生物转移系数(translocation factor,TF)=C地上部/C根。式中,C地上部表示地上部分的重金属含量,C根表示地下部分的重金属含量。
对于下机的测序数据,进行拼接、质控和嵌合体过滤,得到可用于后续分析的有效数据。使用UPARSE 去除singleton 序列,同时使用denovo 模式去除嵌合体序列,最终产生用于物种分类的操作分类单元(Operational Taxonomic Unit,OTU)。使用qiime 软件,找出与OTU 序列相似度最高且可信度达80%以上的物种信息用于OTU 的注释。应用软件mothur(http://www.mothur.org/)计算香农指数、Chao 1 指数和覆盖率指数(good’s coverage)。根据 OUT 分布情况,进行聚类分析(principal co-ordinates analysis,PCoA)。
所有结果用平均数±标准偏差表示。利用SPSS 22.0 统计软件对结果进行单因素方差分析,并利用Tukey 法检验同一因素下各处理间差异的显著性。
2 结 果
2.1 不同苗木对Cd 的吸收
如图1 所示,加Cd 后,12 种绿化苗木叶片浓度变化范围为0.25~2.59 mg·kg–1。与对照相比,加Cd 对金森女贞和滨柃影响不显著。其余十种绿化苗木叶片Cd 含量由小到大顺序为:茶梅、桂花、金禾女贞、花叶女贞、金边胡颓子、小叶蚊母、红王子锦带、红叶石楠、金叶六道木、花叶锦带。花叶锦带叶片Cd 浓度最高,为2.59 mg·kg–1,其次为金叶六道木,叶片Cd 浓度为2.16 mg·kg–1。除桂花和滨柃外,接种AM 真菌处理组的叶片Cd 含量均高于不接菌处理组,接种AM 真菌后显著增加了植物叶片Cd 含量。相比未接种对照,接种AM2 后金叶六道木叶片中Cd 含量增加了147.9%。表明金叶六道木对土壤重金属Cd 具有较好吸收和富积能力,可以作为土壤Cd 污染修复的优良绿化苗木。
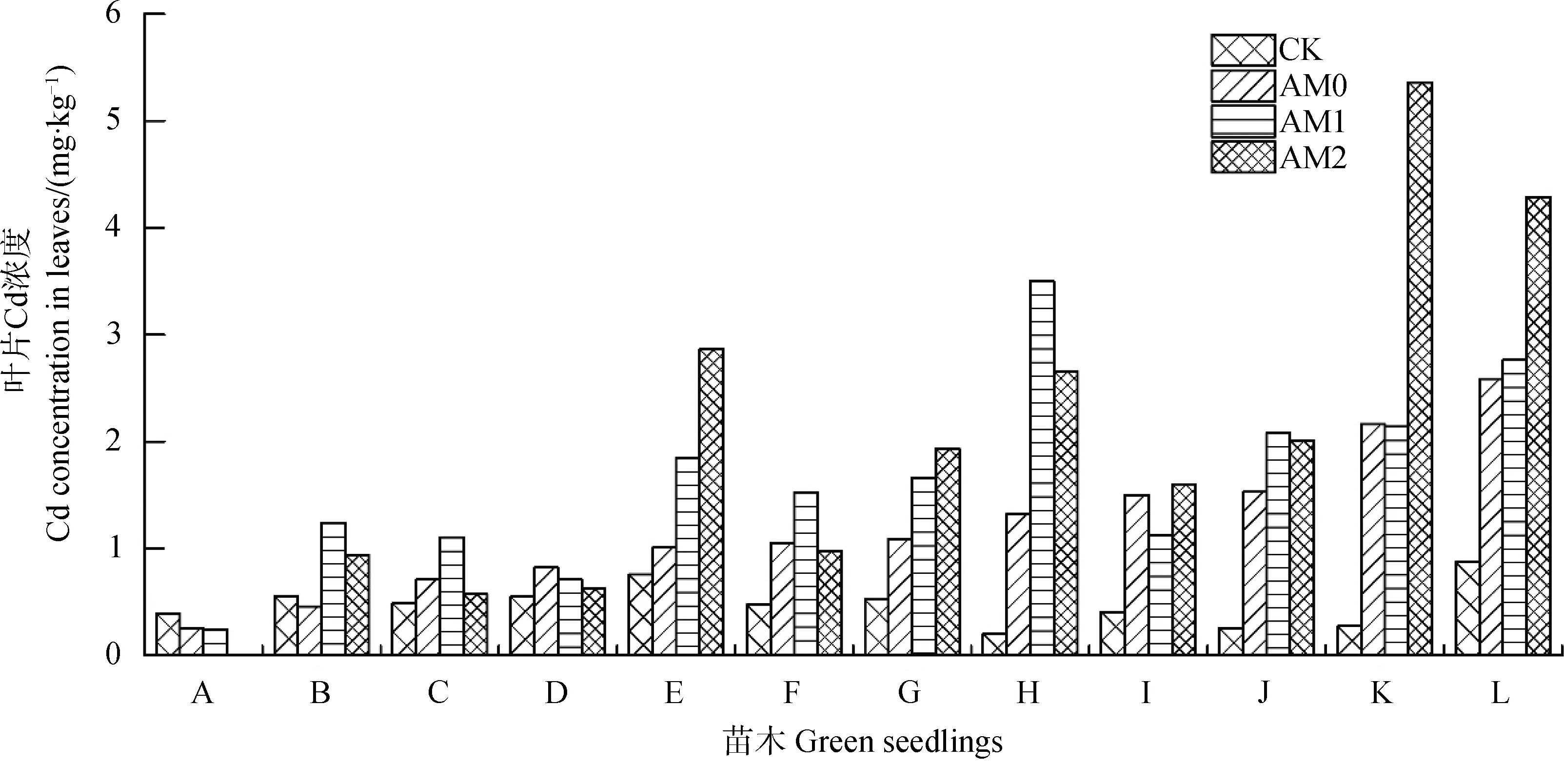
图 1 不同绿化苗木叶片Cd 浓度(6 个月)Fig. 1 Cd concentration in leaves of green seedlings(6 months)relative to species
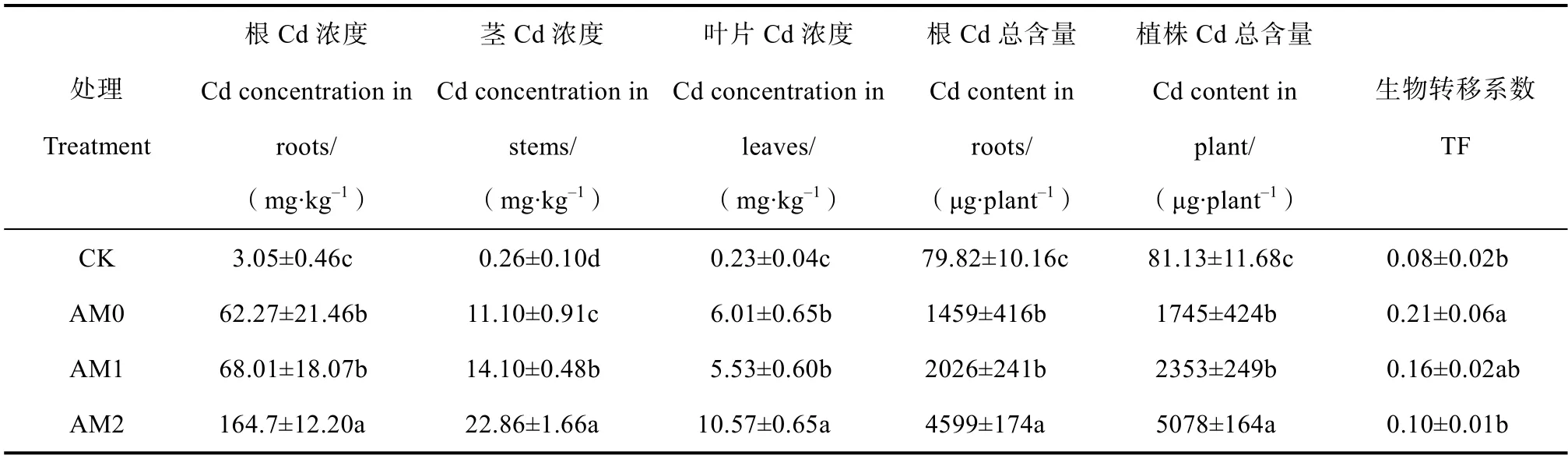
表1 培养12 个月金叶六道木不同部位Cd 浓度与含量Table1 Cd concentration and contents in different parts of A. grandiflora(12 months)
由表1 可知,种植12 个月后,AM0 处理金叶六道木根、枝、叶片Cd 浓度分别为62.27、11.10和6.01 mg·kg–1。叶片Cd 浓度增加为6 个月前的2.78倍。添加AM2 菌剂后,金叶六道木对Cd 的吸收显著增加,根、茎、叶Cd 浓度分别为164.7、22.86和10.57 mg·kg–1,为AM0 处理的2.64 倍、2.06 倍和1.76 倍,说明添加丛枝菌根真菌后可以增加金叶六道木对Cd 的吸收。Cd 胁迫条件下,金叶六道木地上部和全株Cd 含量分别为1 459 和1 745 μg·株–1,转移系数为0.21。接种AM2 后,金叶六道木体内Cd 含量为5 078 μg·株–1,其转移系数为 0.10,说明接种AM 真菌后可以降低转移系数,并将其更多吸收的Cd 固定在根内。
2.2 接种AM 真菌对金叶六道木根际土壤微生物生物量的影响
Cd 胁迫条件下,土壤中总PLFA 生物量、细菌PLFA 生物量、真菌PLFA 生物量分别为101.7、32.91和5.60 nmol·g–1(见表2),显著高于对照。这说明Cd 在一定的浓度范围内可刺激根际土壤微生物数量增加。与不接菌相比,接种AM 真菌降低了六道木根际土壤微生物总PLFA 生物量、细菌PLFA 生物量及真菌PLFA 生物量,但增加了AM 真菌PLFA 生物量。AM1 和AM2 处理间总PLFA 生物量、细菌PLFA 生物量和AM 真菌PLFA 生物量差异不显著。
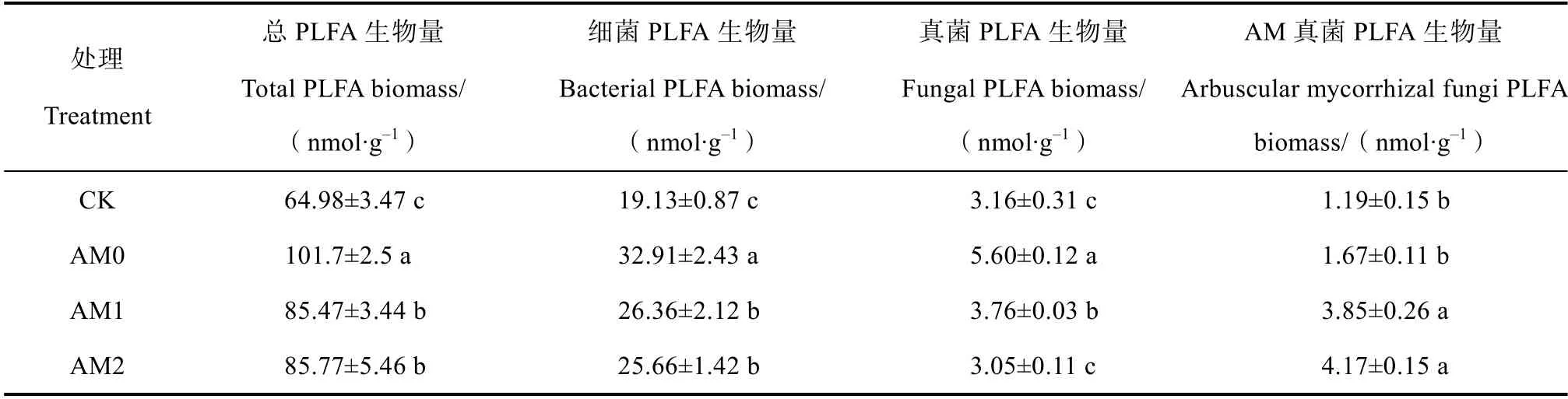
表2 金叶六道木根际土壤微生物PLFA 量Table2 PLFA biomass of microorganisms in the rhizosphere soil of A. grandiflora
2.3 根际土壤微生物群落结构
表3 为高通量测序优质序列的分布结果,各样品测序量在97 411 条至119 212 条之间,优质序列占有效序列的 98 %以上。序列长度集中分布在212~218 bp 之间,平均长度222 bp。四个处理用于物种分类的OTUs,分别为365、357、347、311,其中CK 处理的OTU 数最高,但与其他处理间差异不显著。在对照样品中香农指数最低,为2.79;Cd胁迫下后增加了金叶叶六道木根际AM 真菌香农指数,接种AM1 和AM2 后香农指数分别为2.92 和3.21。Cd 胁迫对根际AM 真菌Chao1 指数的影响不显著,接种AM1 和AM2 后丰富度下降,特别是接种AM2,下降幅度达21%。不同样品间的覆盖率指数差异不显著。
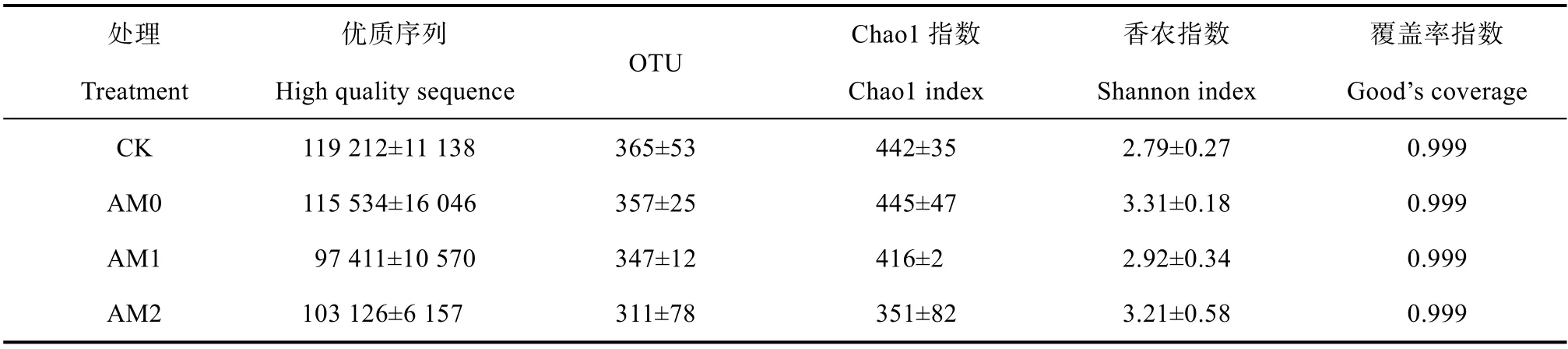
表3 AM 真菌的丰度、多样性指数及丰富度指数Table3 Abundances,Diversity and Richness indexes of AMF
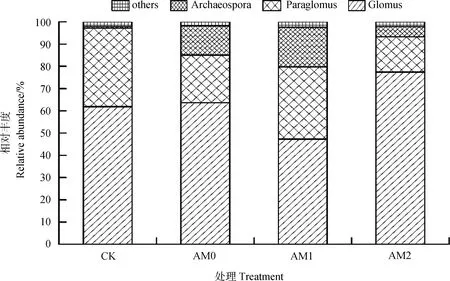
图2 群落结构组成Fig. 2 AMF community structure
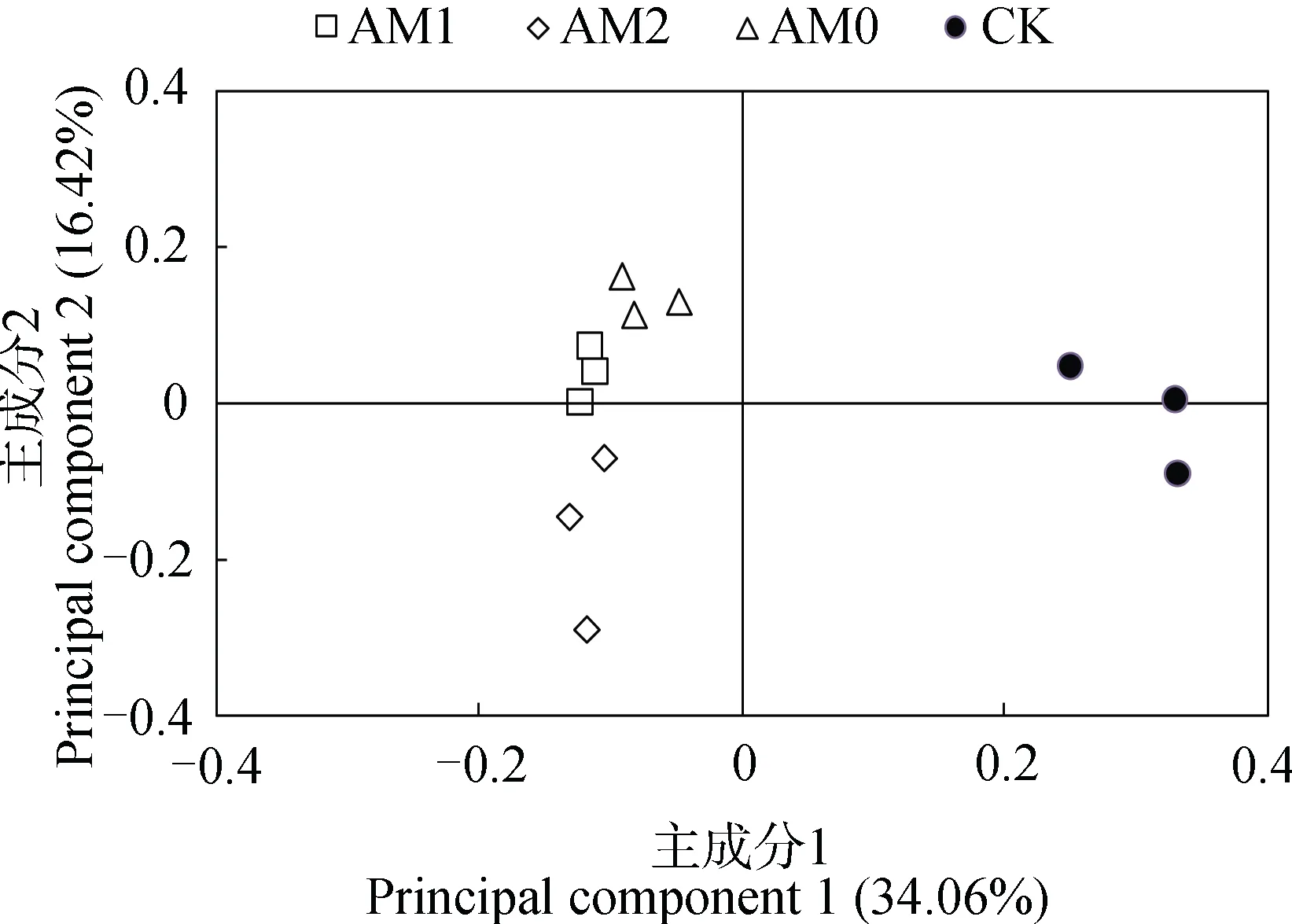
图3 主成分分析图Fig. 3 Principal component analysis
从群落结构组成图(图2)可以看出,所有样本中的AM 真菌主要分属于三个科,分别是球囊霉科(Glomus)、类球囊霉科(Paraglomus)和原囊霉科(Archaeospora)。其中球囊霉科占总AM 真菌的55%以上,占绝对优势。在不同处理间,球囊霉科和类球囊霉科的相对丰度具有显著变化。Cd 胁迫条件降低了类球囊霉的丰度,增加了原囊霉科的丰度。相比未接菌,接种AM2 后球囊霉科丰度显著增加,由63.7%上升至77.4%。接种AM1 后类球囊霉科丰度显著增加,由对照的13.1%上升至17.8%。主成分分析结果显示(图3),Cd 胁迫会显著影响植物根际真菌群落结构。2 个主成分的贡献率分别为34.06 %和16.42 %,累计贡献率为50.48 %。主成分1 可以区分加Cd 处理组和对照组,主成分2 可以区分接种AM2 和不接菌处理。因此,Cd 和AM 真菌接种可以改变金叶六道木根际AM 真菌群落结构。
3 讨 论
Cd 胁迫条件下,花叶锦带和金叶六道木叶片Cd 浓度分别为2.59 和2.16 mg·kg–1。考虑到花叶锦带属于落叶灌木,故选择属于常绿灌木的金叶六道木作为后期研究的对象。本试验中由于采用基质培养,基质具有强大的缓冲性,添加Cd溶液150 mg·kg–1后,其基质淋溶液Cd 浓度为10 mg·kg–1,相当于一般试验中土壤中Cd 添加量为50 mg·kg–1。目前,国内外发现的Cd 超积累植物有17 种,主要为草本植物,而超积累植物生长缓慢、生物量低[29]。比如,当Cd 浓度为50 mg·kg–1时,杂草龙葵的茎、叶中Cd 浓度分别为121.16、118.23 mg·kg–1,但每株龙葵的Cd 含量仅为14.61 μg[7];东南景天的的茎、叶中Cd 浓度分别高达1 750、500 mg·kg–1,总Cd 含量小于1 000 μg·盆–1[30]。本试验中,种植12 个月后,金叶六道木的根、茎、叶Cd 浓度分别为62.27、11.10和6.01 mg·kg–1,植株体内总Cd 含量达1 745 μg·株–1,远高于龙葵和东南景天,表现出了良好的Cd 修复能力。相比于其他修复植物后期处理的风险,绿化苗木可以通过移栽,将固定的Cd 进行转移并实现绿化功能。移栽3 个月后苗木所吸收的Cd 仍主要固定于体内,移栽后Cd 释放的风险较小,是一种环境友好的修复技术[16]。当然,被移栽的地点需要慎重选择,以避免带来新的风险[31]。研究结果显示,金叶六道木根系吸收的 Cd 含量占总植物体的78%~93%,而植物根系却难以从土壤中收集。今后可以研发合适的技术将植株体连同根系一起收获,以保证植物提取修复效率,同时可预防二次污染的发生。
提高植物的修效率,探讨植物修复的强化措施对于植物修复的应用仍显得尤为重要。接种AM 真菌后,金禾女贞、小叶蚊母、金叶六道木等10 种苗木叶片Cd 含量均显著增加,其中增幅最大的为金叶六道木,为未接种的2.47 倍。12 个月后,接种AM2 处理金叶六道根、茎、叶Cd 浓度分别为不接菌处理的2.64 倍、2.06 倍和1.76 倍。上述结果表明,AM 真菌可促进植物对 Cd 的吸收。其他学者也发现了类似的结果。Liu 等[7]研究发现,接种AM 真菌后龙葵枝和根的吸收量分别为131.79 和51.42 μg·盆–1,远高于未接菌的51.30 和21.76 μg·盆–1。陈良华等[32]研究结果表明接种AM 真菌引起美洲黑杨雄株叶片、茎、粗根、细根Cd 积累量及总积累量分别增加85%、53%、81%、236%和160%,显著提高美洲黑杨Cd 积累能力。在本研究中,Cd 在金叶六道木地上部枝叶内浓度较低,根系内浓度相对较高,接种AM2 后降低了转移系数,降低了Cd 转运至地上部的比例,增加了根系对Cd 的富集能力,从而减少了Cd 对茎叶的毒害作用,增强了植物根系Cd 的固持作用,进一步强化了金叶六道木对Cd 修复的效率。宁楚涵等[33]研究结果也表明,相比对照,接种摩西斗管囊霉抑制了芦苇和狼尾草根系Cd 向地上部的转移作用,增加了根系对Cd 的富集能力,减少了Cd 对植物茎叶的毒害作用。
在本研究中,不同苗木品种对AM 真菌也表现出不同的偏好性。对于金叶六道木而言接种AM2的强化效果优于接种AM1;而红叶石楠和小叶蚊母则相反。陈雪等[34]研究发现,相比异形根孢囊霉,接种摩西管柄囊霉对龙葵 Cd 富集系数的效应最大。杨秀敏等[35]的研究表明,相比摩西管柄囊霉,接种根内球囊霉对东南景天Cd 提取量增加效果更优。因此,有必要针对不同的修复植物,筛选与培育最佳的植物-AM 真菌联合修复的组合。
研究发现利用外源加入有益微生物,对 Cd 胁迫下土壤根际环境有一定的改善作用。杜俊卿[36]发现接种丛植菌根能增加大叶女贞、法国冬青等绿化植株土壤中细菌、真菌、放线菌的数量。但在本研究中,接种AM 真菌后细菌PLFA 生物量、真菌PLFA生物量、微生物总PLFA 生物量反而下降。这可能是由于苗木种植所采用的基质均预先灭菌过,所接菌种与新生微生物产生了竞争关系。结果显示,相比不接菌处理,接种AM2 后,AM 真菌PLFA 生物量显著增加,但AM 真菌的群落多样性、丰富度却下降,意味土壤AM 真菌群落中优势种的相对比例增加, 群落向着更加集中的方向发展。Martínez-García 等[37]观察到在宿主植物根际中的AM 真菌群落多样性远低于土壤中的AM 真菌群落多样。
群落结构分析结果表明,金叶六道木根际的主要AM 真菌分别为球囊霉科(Glomeraceae)、类球囊 霉 科( Paraglomeraceae ) 和 原 囊 霉 科(Archaeosporaceae),其中球囊霉科占总AM 真菌的55%以上,是绝对优势种群。该结果与Sun[38]、Wei[39]等的研究结论相一致。相关性分析结果显示,土壤Cd 含量与球囊霉科含量呈显著正相关(R2=0.786,P<0.05)。与其他种属相比,球囊霉的产孢速度更快,也更能适应于胁迫环境。但Schneider 等[40]则发现在巴西一处金矿土壤中主要的AM 真菌为类球囊霉、无梗囊霉和球囊霉。这说明不同生境条件下,土壤中AM 真菌群落结构并不完全相同。AM 真菌在植株根际定植成功,形成的共生结构使植物受益,反之植物也会选择对其有益的AM 真菌[41]。因此,在应对Cd 胁迫时接种球囊霉将较类球囊霉对金叶六道木产生更大的益处,这也正是接种AM1后类球囊霉科增加对金叶六道木的促吸收效果不明显的原因。
4 结 论
通过苗木筛选,发现金叶六道木对土壤重金属Cd 具有较好吸收和富集能力。种植12 个月,植株体总Cd 含量达1745.46 μg·株–1。Cd 胁迫条件下,接种AM2(摩西球囊霉)后,金叶六道木根、茎和叶Cd 浓度分别为不接菌处理的2.64 倍、2.06 倍和1.76 倍。接种AM 真菌后根际土壤AM 真菌PLFA生物量增加,AM 真菌群落多样性和丰富度下降,群落向着优势种球囊霉科更加集中的方向发展。AM真菌强化了金叶六道木对土壤Cd 的吸收和修复能力,其联合修复技术可扩展Cd 污染土壤植物修复的应用范围。

