珠子参总皂苷超声-微波协同提取工艺优化
何 芳,余学英,李思齐
(十堰市太和医院·湖北医药学院附属医院 药学部,湖北 十堰 442000)
珠子参,别称扣子七、钮子七等,为五加科植物珠子参Panax japonicas C. A. Mey. var. major (Burk.)C.Y.Wu et K.M.Feng 或羽叶三七Panax japonicas C.A. Mey. var. bipinnatifidus(Seem.)C. Y. Wu et K. M.Feng 的干燥根茎[1]。性温、平,味辛、甘、苦,入肺、胃、肝经,具有补肺降气、祛瘀生新、补血止血的功效,主要用于治疗气阴两虚、烦热口渴、虚劳咳嗽、跌打损伤、关节痹痛、咳血、吐血、衄血、崩漏、外伤出血等症[2]。珠子参民间有炖猪脚的记载,用于妇女产后温补与催乳,是一种药食两用的植物[3]。其主要含有皂苷[4]、多糖[5]、黄酮、挥发油[6]等成分。现代药理学研究发现,珠子参中的皂苷类成分具有保护心脑系统[7]、心肌组织以及抗凝血[8]等药理活性。
高培红等[9]采用正交试验法优化珠子参总皂苷回流提取工艺,但正交试验法精密度与预测性较差,且回流提取时间长;张延妮[10]采用超声法对珠子参总皂苷进行提取并与温浸法进行比较,但温浸法耗时长,提取率低。目前,采用超声微波提取珠子参总皂苷的工艺尚未见报道。本研究拟以珠子参为原料,以微波功率、超声功率、提取时间、液料比为考察因素,采用Box-Behnken 效应面法优化珠子参总皂苷的超声-微波协同提取工艺,并与超声提取法、微波提取法进行比较,以期为珠子参的分离纯化、药理活性的研究提供参考。
1 材料
1.1 仪器
XH-300A 型电脑微波超声波组合合成/萃取仪(北京祥鹄科技发展有限公司);UV-2550 型紫外可见分光光度计(日本岛津公司)。
1.2 试药
珠子参药材(批号:20191123,安徽信远中药科技有限公司)经十堰市太和医院陈吉炎教授鉴定为五加科植物珠子参Panax japonicas C. A. Mey.var.major (Burk.)C. Y. Wu et K. M. Feng 的干燥根茎;人参皂苷Re 对照品(批号:110754-201626,中国食品药品检定研究院);香草醛(批号:20150110,天津市科密欧化学试剂有限公司);醋酸(批号:20190425,武汉市中天化工有限责任公司);乙醇(批号:20190615,武汉市中天化工有限责任公司)。
2 方法与结果
2.1 对照品溶液的配制
精密称取人参皂苷Re 对照品6.8 mg,转移至10 mL 容量瓶中,用甲醇适量溶解,定容至刻度,配制成浓度为0.68 mg/mL 的对照品储备溶液。
2.2 供试品溶液的制备
珠子参药材粉碎,过筛。准确称取药材2 g,加入70%乙醇适量,进行超声-微波协同提取,过滤。取滤液适量,用甲醇定容至25 mL,即得供试品溶液。
2.3 总皂苷的测定方法
采用香草醛-冰醋酸-高氯酸显色法测定珠子参总皂苷含量[11]。精密吸取对照品溶液100 μL,置于具塞试管中,低温挥干溶剂,加入7%香草醛冰醋酸试液0.2 mL,60 ℃水浴20 min, 冷却至室温,加入0.6 mL 高氯酸溶液,混匀;在550 nm 处测定吸光度。
2.4 标准曲线的制备
将对照品储备溶液配制成6 个不同浓度的对照品溶液,分别按“2.3”项下的测定方法进行显色并测定吸光度,得回归方程为:Y = 8.236X-0.037 1,相关系数R2= 0.999 6,表明人参皂苷Re 在0.028 6 ~0.109 0 mg 内与吸光度呈良好的线性关系。
2.5 统计学方法
采用SPSS 20.0 等软件进行数据处理,计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t 检验。以P <0.05 为差异具有统计学意义。
2.6 单因素试验分析
2.6.1 微波功率对珠子参总皂苷提取率的影响珠子参药材粉碎,过筛。准确称取药材2 g,共5 份,用70%乙醇提取珠子参总皂苷,其中液料比为35(mL/g),超声功率为300 W,提取时间为8 min,微波功率分别为100、200、300、400、500 W,提取液过滤。取滤液适量,用甲醇定容至25 mL,测定吸光度,计算总皂苷得率,结果见图1。
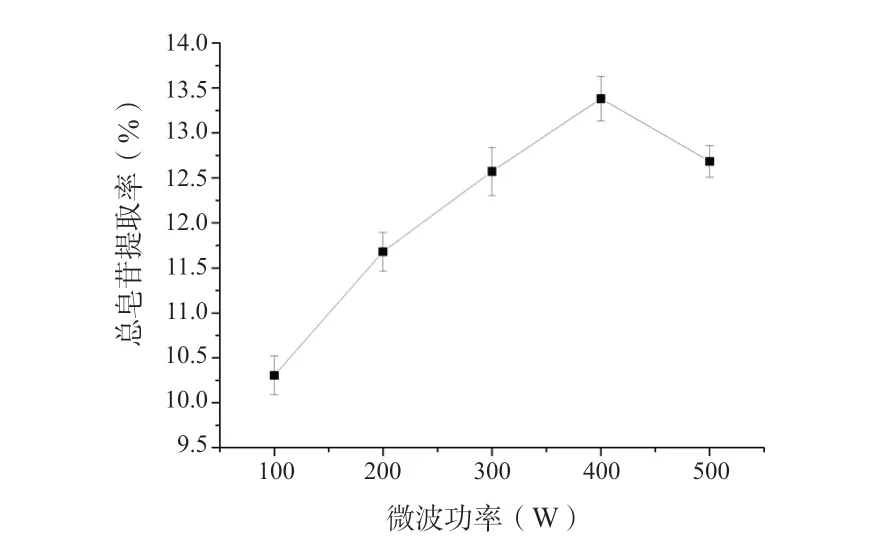
图1 微波功率对珠子参总皂苷得率的影响(n = 6)Fig. 1 Effect of microwave power on the extraction rate of total saponins in Panacis Majoris Rhizoma(n = 6)
从图1 可知,珠子参总皂苷得率随着微波功率的增大而增大,当微波功率达到400 W 时,总皂苷得率达到最大,随后总皂苷得率随微波功率的增大而呈现下降的趋势,这可能是由于微波功率过大,产生的热效应较大,造成部分皂苷的结构受到破坏,从而导致总皂苷得率减小。因此选择400 W 的微波功率作为后续条件优化的参数。
2.6.2 超声功率对珠子参总皂苷提取率的影响
准确称取2 g 珠子参药材5 份,超声功率分别为100、200、300、400、500 W,微波功率为400 W,其余按“2.6.1”项下的条件进行试验,测定吸光度,计算总皂苷得率,结果见图2。
从图2 可以看出,珠子参总皂苷得率随着超声功率的增大而增大,超声功率为300 W 时,总皂苷得率达到最大,超声功率继续增大,总皂苷的得率有轻微下降,这可能是由于超声功率达到300 W 时,总皂苷成分已基本提取完全,超声功率继续增加对珠子参药材细胞中的物质选择性差异减小,少量杂质溶出,导致总皂苷得率轻微下调。因此选择300 W的超声功率作为后续条件优化的参数。
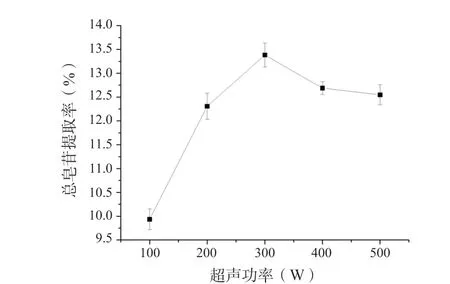
图2 超声功率对珠子参总皂苷提取率的影响(n = 6)Fig. 2 Effect of ultrasonic power on the extraction rate of total saponins in Panacis Majoris Rhizoma(n = 6)
2.6.3 提取时间对珠子参总皂苷提取率的影响
准确称取2 g 珠子参药材5 份,提取时间分别为4、6、8、10、12 min,其余按“2.6.1”项下的条件进行试验,测定吸光度,计算总皂苷得率,结果见图3。
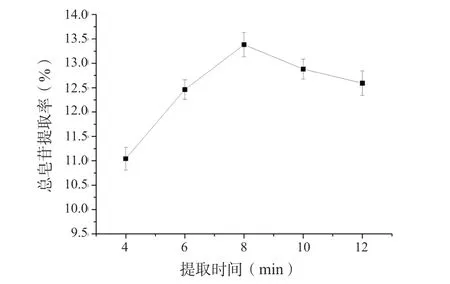
图3 提取时间对珠子参总皂苷提取率的影响(n = 6)Fig. 3 Effect of extraction time on the extraction rate of total saponins in Panacis Majoris Rhizoma(n = 6)
从图3 可以看出,提取时间延长,珠子参总皂苷的得率提高,提取时间达到8 min 时,总皂苷的得率最大,这可能是由于提取时间增加,超声-微波协同提取的各种效应增强,有利于总皂苷的溶出,提取时间过长,部分皂苷成分降解,杂质溶出增多,导致珠子参总皂苷得率下降。因此选择8 min 的提取时间作为后续条件优化的参数。
2.6.4 液料比对珠子参总皂苷提取率的影响准确称取2 g 珠子参药材5 份,液料比分别设为15 ∶1、25 ∶1、35 ∶1、45 ∶1、55 ∶1(mL/g),其余按“2.6.1”项下的条件进行试验,测定吸光度,计算总皂苷得率,结果见图4。
从图4 可以看出,液料比增加,珠子参总皂苷得率呈现先升高后下降的趋势,当液料比为35(mL/g)时,总皂苷得率最高。这可能是由于液料比低时,珠子参总皂苷与溶剂接触不完全,当液料比达到35(mL/g),总皂苷的溶出达到饱和,总皂苷得率达到最大;液料比继续增加,杂质溶出增加,导致总皂苷得率下降。因此选择35(mL/g)的液料比作为后续条件优化的参数。
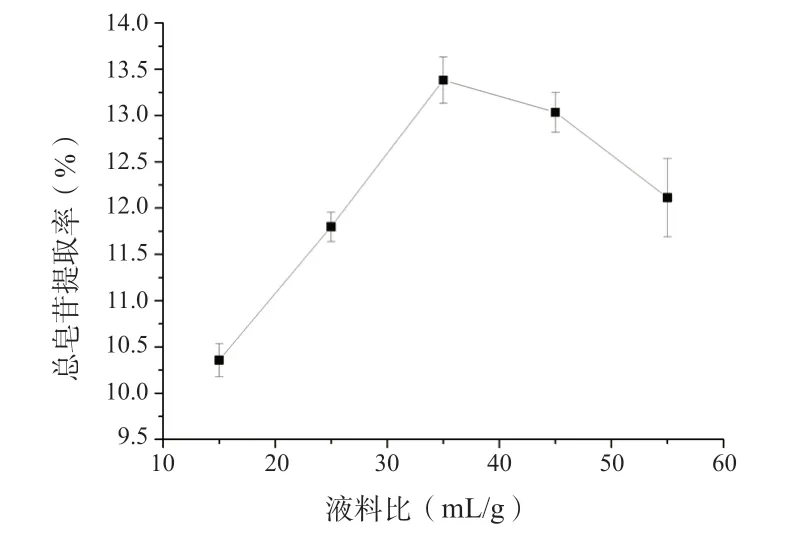
图4 液料比对珠子参总皂苷得率的影响(n = 6)Fig. 4 Effect of liquid/ solid ratio on the extraction rate of total saponins in Panacis Majoris Rhizoma(n = 6)
2.7 Box-Behnken 效应面法优化珠子参总皂苷的超声-微波协同提取工艺
2.7.1 Box-Behnken 效应面试验 在单因素试验的基础上,以珠子参得率为响应值,微波功率、超声功率、提取时间、液料比为自变量,利用Design-Expert 8.0.6 软件进行Box-Behnken 设计,对珠子参总皂苷的提取工艺进行优化。试验因素与水平见表1,设计方案及结果见表2。
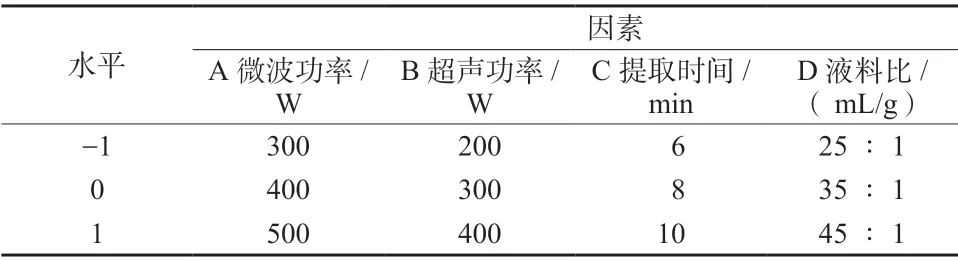
表1 Box-Behnken 响应面法试验的因素与水平Tab. 1 The factor level table of Box-Behnken response surface methodology
2.7.2 回归模型的建立及数据分析 根据Box-Behnken 效应面法试验结果,利用Design-Expert 8.0.6软件对表2 中的数据进行多元二次回归,得到二次多项回归方程为:Y =13.17 +0.210 833A +1.063 333B +0.344 167C-0.295D-0.092 5AB-0.4AC-0.085AD +0.552 5BC +0.27BD +0.31CD-0.247 08A2-1.085 83 B2-0.707 08C2+0.458 33D2,该模型的决定系数R2=0.950 1,调整系数R2Adj=0.900 2,表明该模型准确性较高,可用于珠子参总皂苷得率的预测分析。对回归方程进行方差分析,结果见表3。
2.7.3 效应面分析 交互项的响应面图见图5,响应面图的最高点就是交互因素的最佳条件[12]。从图5 可知超声功率与提取时间的交互作用中等高线呈椭圆形,曲面较陡峭,微波功率与提取时间交互作用的曲面坡度稍缓,微波功率与超声功率、微波功率与液料比、超声功率与液料比以及提取时间与液料比的交互作用的坡度均平缓,说明超声功率与提取时间的交互作用对珠子参总皂苷提取的影响较显著、微波功率与提取时间的交互作用对珠子参总皂苷提取的影响次之,微波功率与超声功率、微波功率与液料比、超声功率与液料比以及提取时间与液料比的交互作用对珠子参总皂苷提取的影响不显著,与回归分析的结果相符,进一步表明所建立的模型较准确可靠。
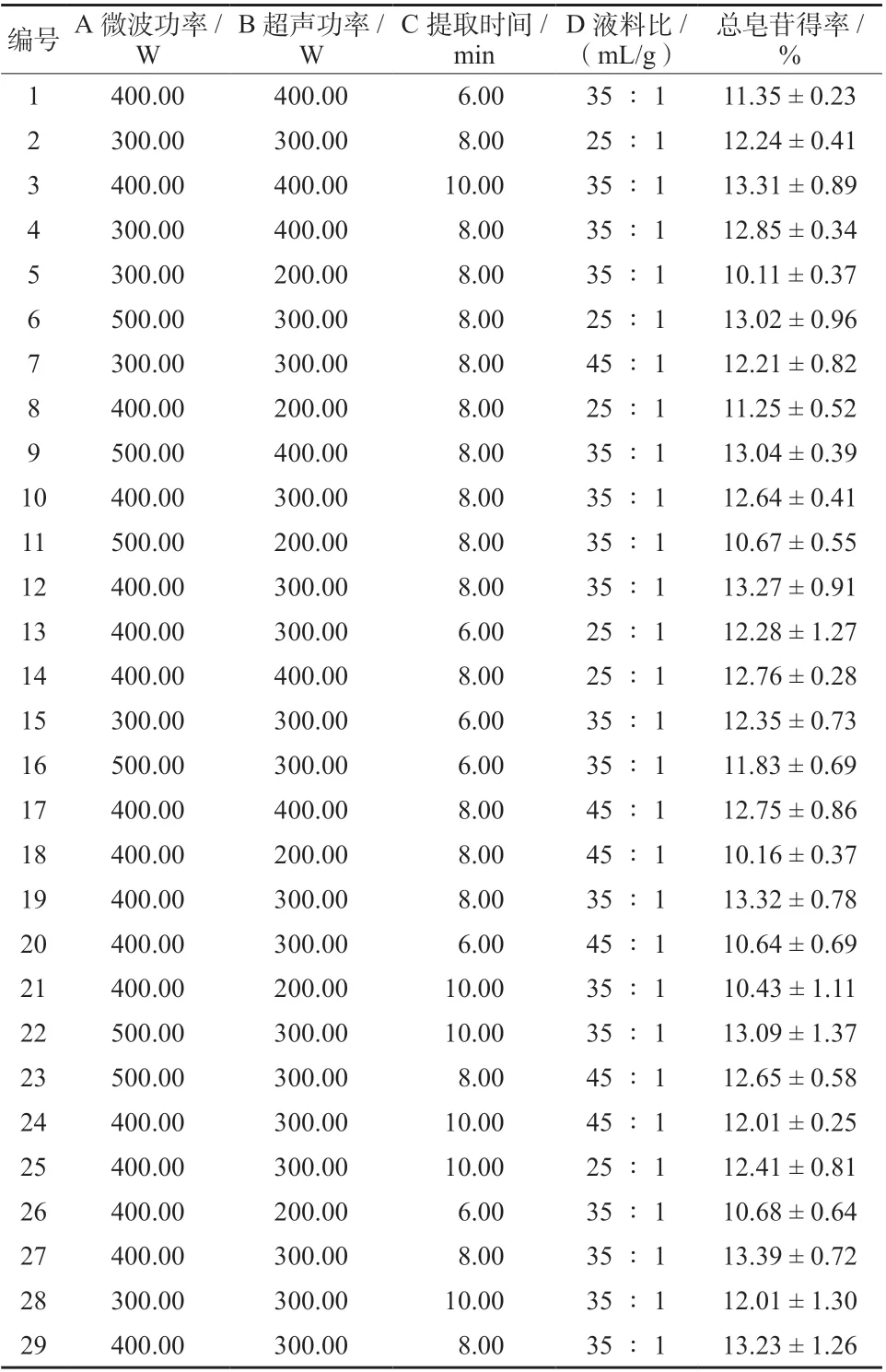
表2 Box-Behnken 响应面法试验设计Tab. 2 Experimental design and results of Box-Behnken response surface methodology
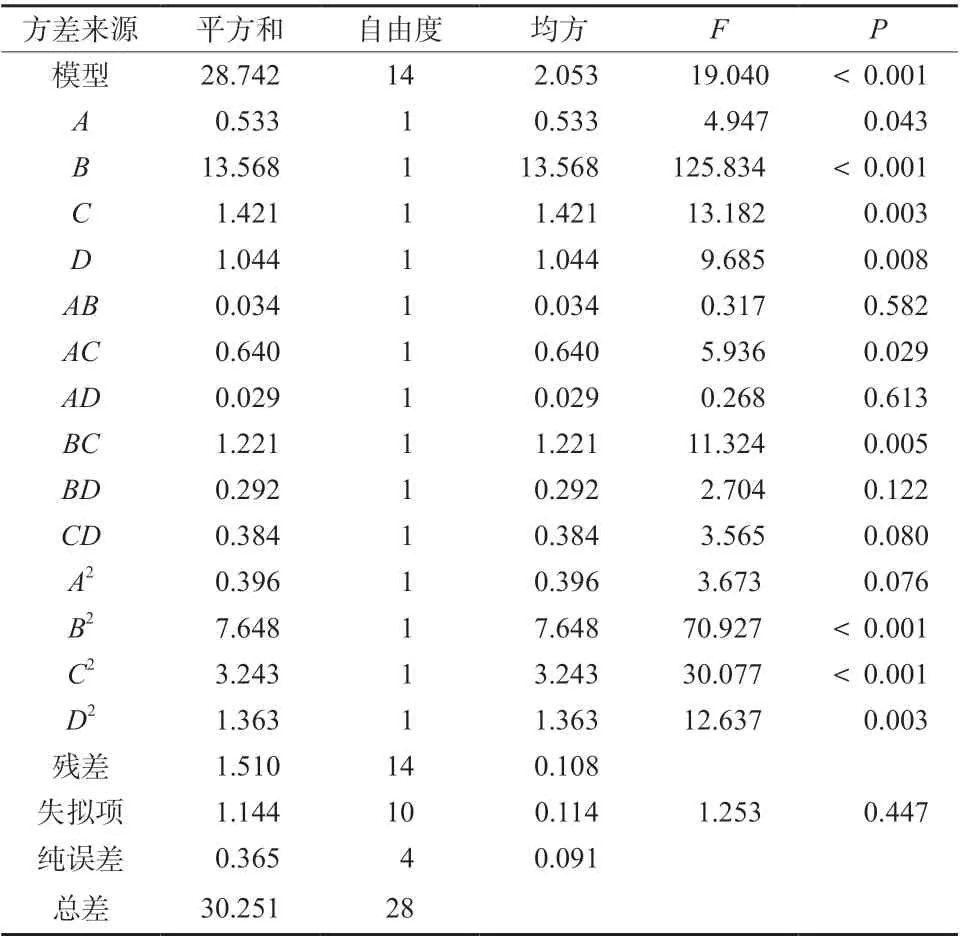
表3 回归模型的方差分析Tab. 3 Analysis of variance (ANOVA) regression model model
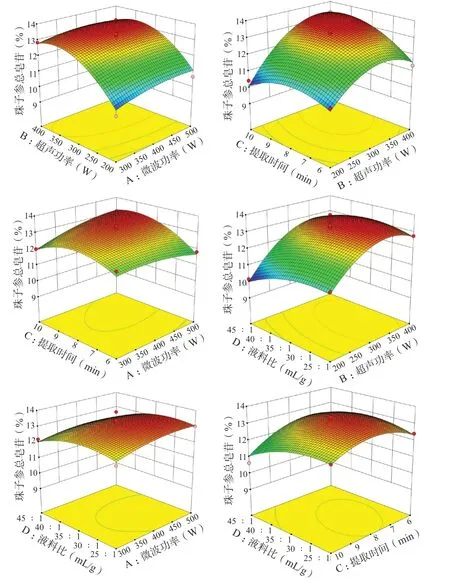
图5 各因素的交互作用对珠子参总皂苷得率影响的响应面图Fig. 5 Response surface map of various factors
由表3 数据可知,效应面法所得的回归模型的F =19.040,P <0.001,说明所建立的回归方程模型极显著,具有统计学意义;失拟项P =0.447 >0.05,表明该试验选择的因素合理。 根据P 值大小可知,各因素对珠子参总皂苷得率的影响顺序:超声功率>提取时间>液料比>微波功率。其中,B、B2、C2对珠子参总皂苷得率影响较大,达到极显著水平(P <0.001),C、D、BC、D2对珠子参总皂苷得率的影响为非常显著水平(P <0.01),A、AC 的影响为显著水平(P <0.05),AB、AD、BD、CD、A2对珠子参总皂苷得率的影响不显著。
2.8 工艺验证及不同提取方法比较
Box-Behnken 效应面法所拟合的响应面形状和已建立的回归模型,得到珠子参总皂苷的最佳提取工艺参数为微波功率:466.034 W,超声功率:358.65 W,提取时间:9.2 min,液料比:34.962 mL/g, 此条件下珠子参总皂苷的预测提取率为13.72%。为便于操作,将最佳提取工艺参数修正为微波功率:466 W,超声功率:359 W,提取时间:9 min,液料比:35 mL/g。按照最佳工艺参数分别进行超声-微波协同提取、微波提取和超声提取,同时与参考文献报道的回流提取方法[13]进行比较,结果见表4。
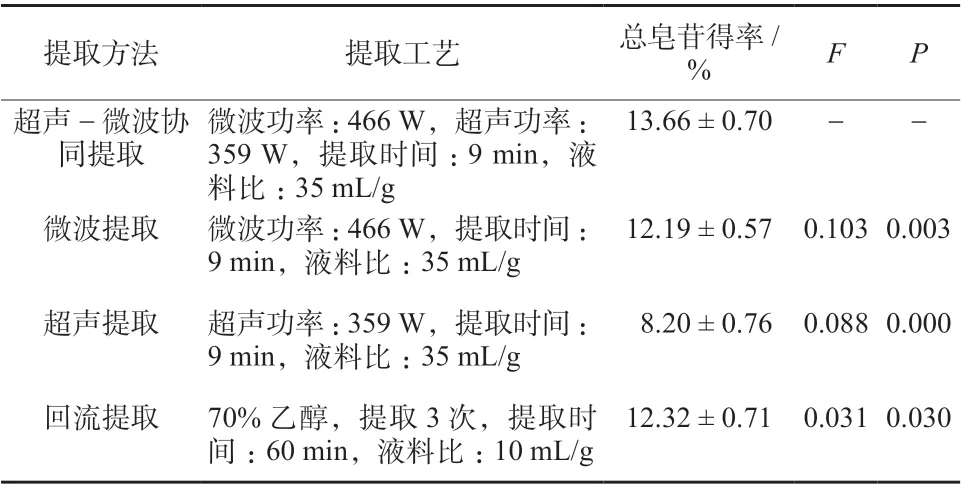
表4 不同提取方法所得珠子参总皂苷的比较(n = 6)Tab. 4 Comparison of total saponins in Panacis Majoris Rhizoma obtained from different extraction methods(n = 6)
从表4 可知,不同提取方法珠子参总皂苷得率存在差异,其中,超声-微波协同提取法与微波提取相比,差异非常显著(P <0.01);与超声提取相比,差异极显著(P <0.001);与回流提取相比,差异显著(P <0.05),且提取时间明显缩短。超声-微波协同提取法具有提取率高、节约时间和减少能耗等优点。
3 讨论
采用超声-微波协同提取方法,珠子参总皂苷得率高于单一超声提取以及微波提取的得率,可能是超声-微波协同提取方法将超声波的空化作用、震动作用与微波的破壁、加热作用相结合,使药材结构更加疏松多孔,从而使珠子参总皂苷的溶出增多。结果表明,超声-微波协同提取珠子参总皂苷具有提取率高、提取时间短、能耗较低以及节约成本等特点。
预实验考察了不同浓度的乙醇(10%、30%、50%、70%、90%)对总皂苷得率及总皂苷纯度的影响,结果表明,选择70%乙醇作为提取溶剂,既能最大限度的保留皂苷类成分,又能减少多糖、蛋白质的溶出,降低提取液的黏度。珠子参总皂苷得率随着微波功率的增大呈现先上升后下降的趋势,可能与微波功率过大,产生的热效应较大,造成部分皂苷的结构受到破坏有关。提取时间过长,导致皂苷类成分降解,杂质溶出增多。由于皂苷具有较强的表面活性,提取过程中会产生大量泡沫,容易造成成分的溢出,故应严格控制好温度及时间。
4 结论
本研究在珠子参总皂苷的提取中,采用超声-微波协同提取法,具有工艺操作简单、模型准确度高、预测性好、重现性较好的优点,且有利于皂苷的提取。但本研究仅对珠子参总皂苷的提取工艺进行了研究,而总皂苷的纯化工艺、药理活性等还有待进一步的研究,以便于珠子参药材的质量控制和临床应用。

