口腔运动干预改善早产儿脑功能发育的随机对照研究
章容 陈羽 张莲玉 王瑜 董文斌
(西南医科大学附属医院新生儿科,四川泸州 646000)
近年来各地区早产发生率升高[1],持续气道正压通气、机械通气和外源性肺表面活性物质的使用提高了早产儿的存活率,但神经系统后遗症的发生风险仍较高[2]。台湾地区一项多中心研究显示,胎龄越小,存活率越低,神经发育障碍的风险越高[3]。神经系统发育障碍,如脑性瘫痪、精神发育迟滞、认知障碍、孤独症谱系障碍等,不仅影响患儿近期运动、认知、感觉功能,还造成成年期生活困难,严重影响患儿生活质量和人口素质,给家庭及社会带来巨大的精神、经济负担[4]。
单一和多感官刺激能促进神经发育[5]。口腔运动干预(oral motor intervention, OMI)是一种对婴儿脸颊、口唇、牙龈、舌,以及与吸吮-吞咽-呼吸相关的组织或肌肉群进行感官刺激的方法,包括口腔刺激(oral stimulate, OS)和非营养性吸吮(non‐nutritional sucking, NNS),是一种感觉运动干预方法[6]。口咽部有丰富的感觉传入神经,而早产儿的吸吮行为反映神经行为的成熟。研究证实OMI可以促进早产儿喂养进程和体重增长、缩短住院时间[7‐10],促进神经运动协调[6]。中国脑性瘫痪指南提出早期感觉运动干预可以改善高危儿的神经行为,但如何进行干预尚无明确定论[11],因此本研究对30~33+6周早产儿进行OMI,探讨其对神经发育的作用,现报道如下。
1 资料与方法
1.1 研究对象
选择2018年3~12月收治于我院新生儿科的早产儿为研究对象,根据一项多中心研究进行样本量估算[12],选用振幅整合脑电图(amplitude‐integrated electroencephalogram, aEEG)的振幅下边界(μⅤ)作为核心观察指标,根据文献获知样本标准差s=2 μⅤ,设总体标准差σ=2 μⅤ,α=0.05,1‐β=0.90,预计脱落率为20%,则每组需要28例。采用分层随机方法,将入组对象按胎龄分为小胎龄(30~31+6周)及大胎龄(32~33+6周),再采用随机数字表法分为对照组和干预组,共计112例。研究过程中,小胎龄对照组发生1例严重感染、2例新生儿坏死性小肠结肠炎、2例治愈出院,小胎龄干预组发生1例严重感染、3例治愈出院;大胎龄对照组和大胎龄干预组分别有6例、5例因治愈出院而退出研究,无一例因不耐受OMI而脱落,最终纳入92例。同年龄层内对照组和干预组早产儿及父母一般情况比较,差异无统计学意义(P>0.05),具有可比性,见表1。
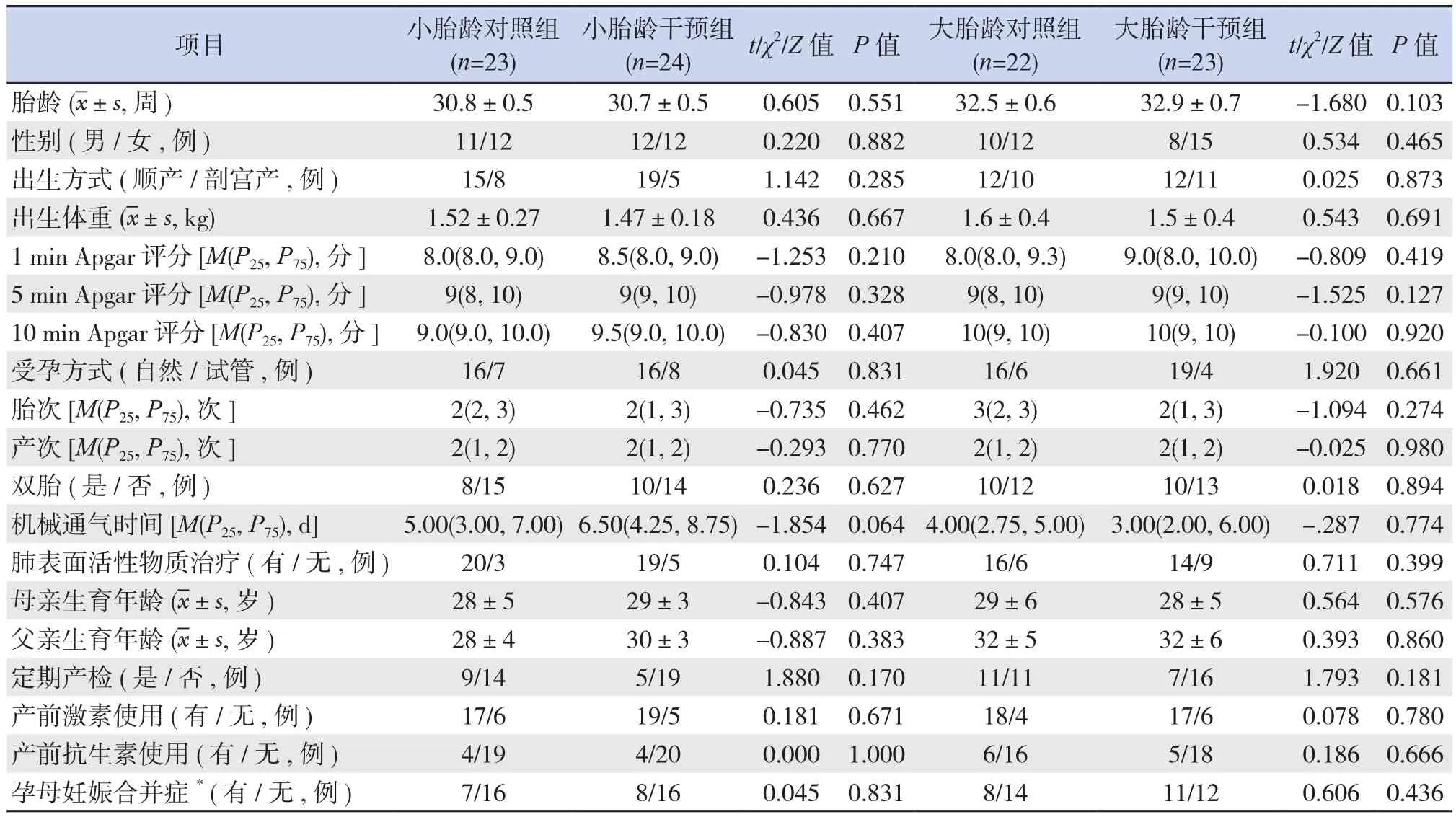
表1 各组早产儿及父母一般情况比较
1.2 纳入和排除标准
纳入标准:(1)胎龄30~33+6周;(2)生后24 h内入院并完成头颅超声检查;(3)生命体征平稳。排除标准:(1)患有神经系统疾病:颅内出血(Ⅰ~Ⅳ级)、颅脑结构畸形;(2)有各种先天性疾病;(3)患有代谢性疾病;(4)患有围生期窒息;(5)各种原因放弃治疗、自动出院或不耐受干预;(6)aEEG监测前使用过镇静镇痛药。各疾病诊断标准参照第4版《实用新生儿学》[13]。本研究经西南医科大学生物医学伦理委员会批准(20180108‐12),取得监护人知情同意。
1.3 干预方法
对照组按《早产儿管理指南》[14]进行监护和治疗,包括体温管理、营养支持、呼吸道管理、预防感染等。干预组在此基础上于入组第1天开始,分别于9 : 00 am、3 : 00 pm喂奶1 h后及下次喂奶前10 min时间段内进行OMI。方法按Fucile口腔运动干预步骤[15]依次对左右脸颊、上下嘴唇、上下牙龈、左右脸颊内侧、舌头边缘、舌头中央部位进行按压,用手指刺激上颚行诱导吸吮、无孔安慰奶嘴(中国Ivory,型号C03)进行NNS,2次/d,15 min/次,持续14 d。干预过程中,持续监测心率、经皮血氧饱和度等,若出现血氧饱和度下降、呕吐等不耐受情况立即停止干预。
1.4 aEEG电生理指标
aEEG监测分别于入组第1、7、14天进行。采用美国Olympic公司Nicolet One 32 导联的脑功能监护仪,按照国际10/20标准电极安放系统进行信号采集,电阻阈值为20 Ω,输出速度6 cm/h,单位为μⅤ,连续描计4 h。aEEG图形采用半对数公式进行电压测量,包括:(1)连续性电压:带宽规则,最小振幅>5 μⅤ,最高振幅>10 μⅤ;(2)成熟的睡眠-觉醒周期(sleep‐wake cycle, SWC),图形有明显的正弦样变化,时程≥20 min;(3)窄带、宽带上下边界值;(4)带宽:指电压跨度,即上下边界电压差值;(5)aEEG评分:按Burdjalov综合评分系统对aEEG等进行成熟度评估,得分范围0~14分,得分越高,脑发育越成熟[16]。
1.5 新生儿行为神经评估
采用新生儿行为神经测定(Neonatal Behavioral Neurological Assessment, NBNA)量表,于入组第1、7、14天由经过专业培训的人员进行评估,包括行为能力、被动肌张力、主动肌张力、原始反射和一般评价5部分,共20项,总分40分,得分越高,脑发育越成熟。若双人评分差异大于1分,予重新评估。该量表已被证实适用于评估早产儿脑发育,具有经济、无创、操作性强的特点[17]。
1.6 统计学分析
采用SPSS 20.0软件进行数据分析。符合正态分布计量资料以均数±标准差(±s)表示,两组间比较采用两样本t检验;非正态分布以中位数(四分位数间距)[M(P25,P75)]表示,两组间比较用Mann‐WhitneyU秩和检验;计数资料用百分率(%)表示,率的比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同胎龄组早产儿aEEG电压比较
相同年龄层内,干预组和对照组第1天的aEEG电压情况差异无统计学意义(P>0.05)。小胎龄干预组第7天宽带及窄带的上界电压和电压差低于小胎龄对照组,第14天宽带及窄带的下界电压高于小胎龄对照组,第14天窄带电压差低于小胎龄对照组(P<0.05)。大胎龄干预组第7、14天宽带及窄带的上界电压和电压差低于大胎龄对照组,宽带及窄带的下界电压高于大胎龄对照组(P<0.05),见表2~4。
2.2 不同胎龄组早产儿成熟SWC比较
小胎龄干预组干预第14天后,成熟SWC比例高于小胎龄对照组(P<0.05);OMI第7、14天,大胎龄干预组成熟SWC比例高于大胎龄对照组,但差异无统计学意义(P>0.05),见表5、图1。
2.3 不同组早产儿aEEG评分比较
相同年龄层内,干预组和对照组第1天aEEG评分差异无统计学意义(P>0.05)。干预组第7、14天aEEG评分高于对照组(P<0.05),见表6。
2.4 不同组早产儿NBNA评分比较
小胎龄干预组和小胎龄对照组第1、7天NBNA评分差异无统计学意义(P>0.05),第14天小胎龄干预组NBNA评分高于小胎龄对照组(P<0.05)。大胎龄干预组和大胎龄对照组第1、14天NBNA评分差异无统计学意义(P>0.05),第7天大胎龄干预组NBNA评分高于大胎龄对照组(P<0.05),见表7。
表2 各组早产儿干预第1天aEEG电压比较 (±s,μⅤ)
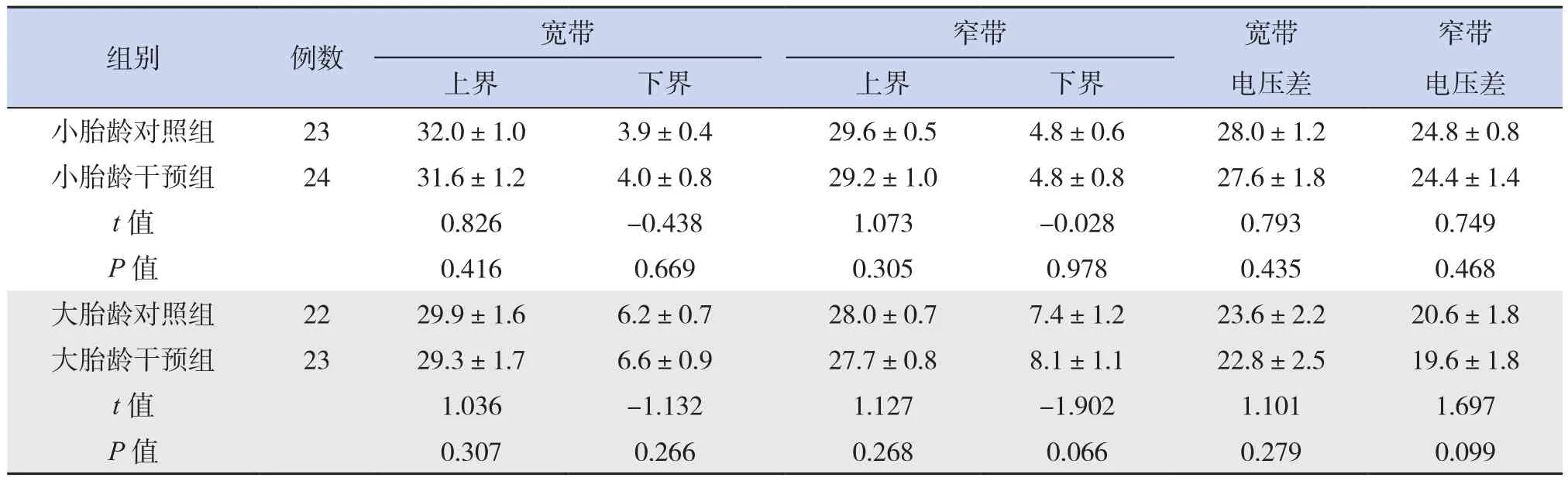
表2 各组早产儿干预第1天aEEG电压比较 (±s,μⅤ)
组别 例数 宽带 窄带 宽带 窄带上界 下界 上界 下界 电压差 电压差小胎龄对照组 23 32.0±1.0 3.9±0.4 29.6±0.5 4.8±0.6 28.0±1.2 24.8±0.8小胎龄干预组 24 31.6±1.2 4.0±0.8 29.2±1.0 4.8±0.8 27.6±1.8 24.4±1.4 t值 0.826 -0.438 1.073 -0.028 0.793 0.749 P值 0.416 0.669 0.305 0.978 0.435 0.468大胎龄对照组 22 29.9±1.6 6.2±0.7 28.0±0.7 7.4±1.2 23.6±2.2 20.6±1.8大胎龄干预组 23 29.3±1.7 6.6±0.9 27.7±0.8 8.1±1.1 22.8±2.5 19.6±1.8 t值 1.036 -1.132 1.127 -1.902 1.101 1.697 P值 0.307 0.266 0.268 0.066 0.279 0.099
表3 各组早产儿干预第7天aEEG电压比较 (±s,μⅤ)

表3 各组早产儿干预第7天aEEG电压比较 (±s,μⅤ)
组别 例数 宽带 窄带 宽带 窄带上界 下界 上界 下界 电压差 电压差小胎龄对照组 23 31.0±0.6 5.4±0.8 28.6±0.5 6.2±0.7 25.7±1.2 22.4±1.1小胎龄干预组 24 30.3±0.4 5.8±0.7 27.6±0.6 7.3±1.0 24.5±0.6 20.3±1.7 t值 3.652 -1.660 4.240 -3.022 2.994 3.572 P值 0.001 0.109 <0.001 0.010 0.006 0.003大胎龄对照组 22 27.6±1.1 7.3±1.0 26.9±1.4 9.0±0.5 20.3±1.9 17.9±1.7大胎龄干预组 23 26.3±1.0 8.3±1.0 24.3±1.9 9.9±0.4 18.0±1.8 14.4±2.2 t值 3.824 -2.909 4.635 -5.437 3.476 5.322 P 值 0.001 0.006 <0.001 <0.001 0.001 <0.001
表4 各组早产儿干预第14天aEEG电压比较 (±s,μⅤ)

表4 各组早产儿干预第14天aEEG电压比较 (±s,μⅤ)
组别 例数 宽带 窄带 宽带 窄带上界 下界 上界 下界 电压差 电压差小胎龄对照组 23 28.9±1.2 5.9±0.4 27.7±0.6 8.1±1.0 22.9±1.5 19.6±1.4小胎龄干预组 24 28.4±1.2 6.0±0.3 26.7±0.6 9.1±1.0 22.5±1.4 17.5±1.5 t值 1.052 -2.495 4.481 -2.608 1.565 3.703 P值 0.303 0.020 <0.001 0.015 0.130 0.001大胎龄对照组 22 26.0±0.7 8.4±0.3 24.2±2.7 9.7±0.3 17.6±0.8 14.5±2.8大胎龄干预组 23 25.5±0.5 9.0±0.3 21.5±2.0 10.4±0.2 16.5±0.7 11.1±2.0 t值 2.231 -5.626 3.510 -8.148 3.914 3.975 P 值 0.032 <0.001 0.001 <0.001 <0.001 <0.001

表5 各组早产儿成熟SWC比例比较 [例(%)]
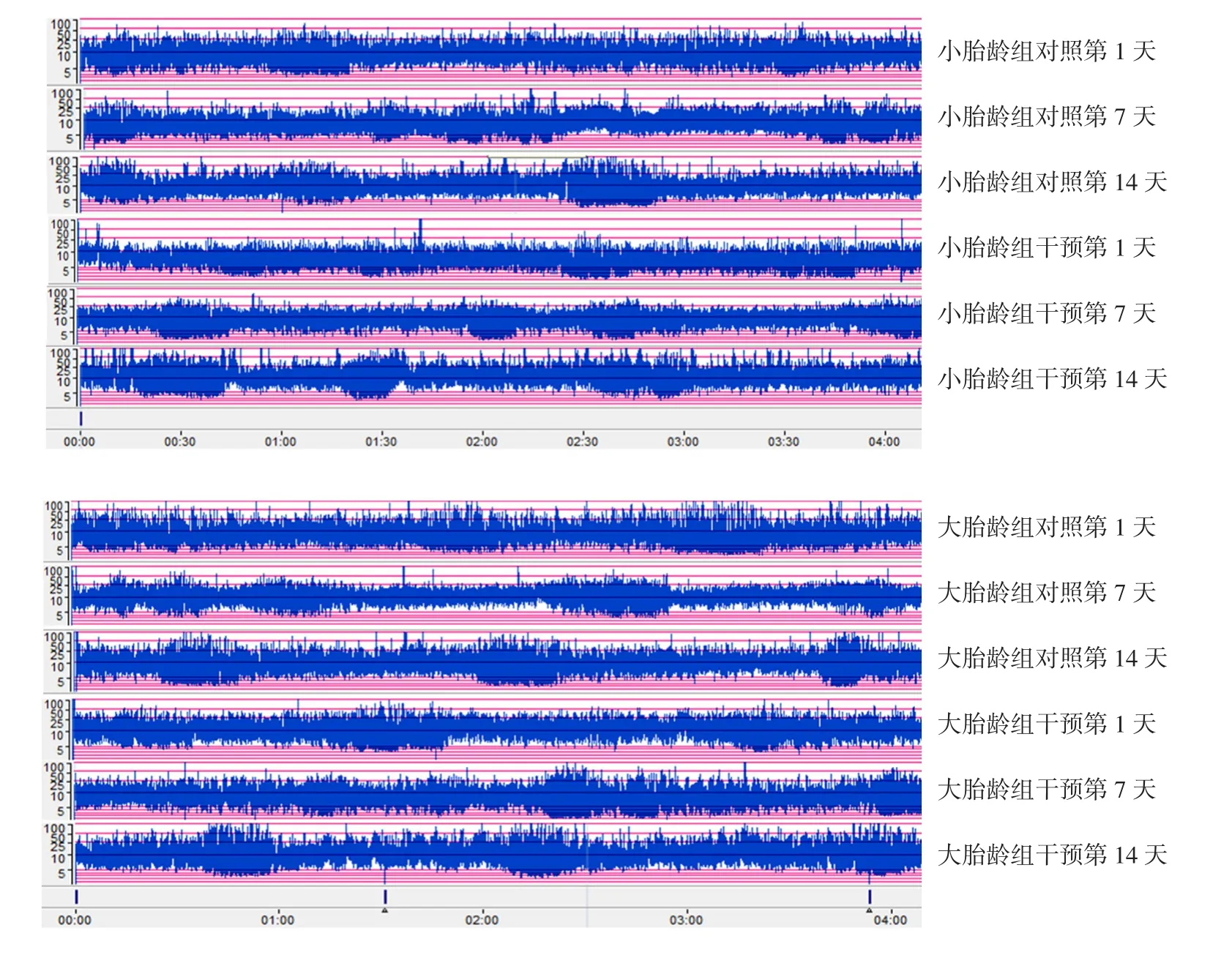
图1 不同年龄层对照组和干预组各时间点SWC比较 小胎龄组干预第1天时均无成熟SWC(明显的正弦样波形),第7 天时开始出现不成熟的SWC,第14 天时均有明显的成熟SWC。大胎龄组干预第1 天时部分早产儿首次出现波形,但周期不明确,第7 天时周期逐渐明显,第14 天时70%以上早产儿已出现成熟SWC。
表6 各组早产儿aEEG评分比较 (±s,分)
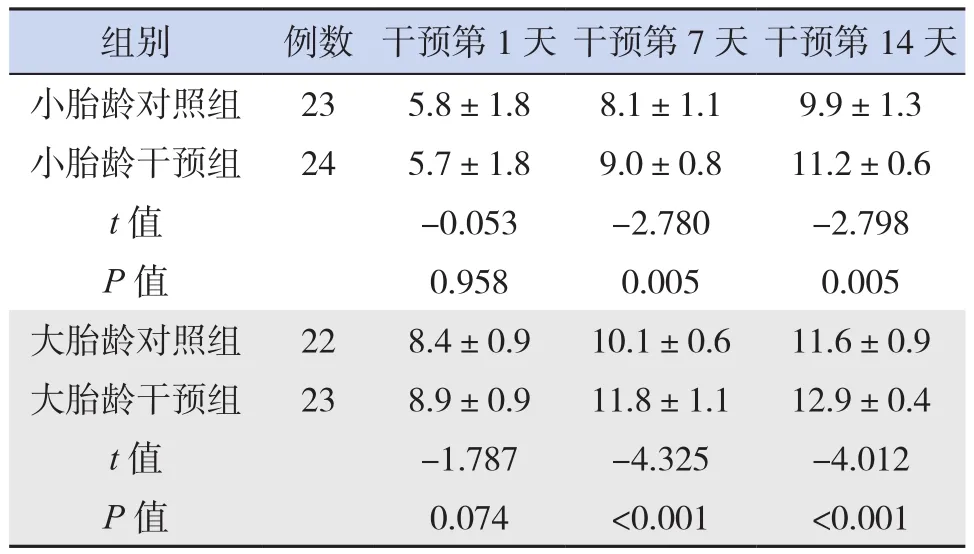
表6 各组早产儿aEEG评分比较 (±s,分)
组别 例数 干预第1天 干预第7天 干预第14天小胎龄对照组 23 5.8±1.8 8.1±1.1 9.9±1.3小胎龄干预组 24 5.7±1.8 9.0±0.8 11.2±0.6 t值 -0.053 -2.780 -2.798 P值 0.958 0.005 0.005大胎龄对照组 22 8.4±0.9 10.1±0.6 11.6±0.9大胎龄干预组 23 8.9±0.9 11.8±1.1 12.9±0.4 t值 -1.787 -4.325 -4.012 P值 0.074 <0.001 <0.001
表7 各组早产儿NBNA评分比较 (±s,分)

表7 各组早产儿NBNA评分比较 (±s,分)
组别 例数 干预第1天 干预第7天 干预第14天小胎龄对照组 23 30.1±0.9 31.5±0.9 32.9±0.7小胎龄干预组 24 29.8±0.8 32.3±0.9 34.1±0.9 t值 -0.884 -1.902 -2.964 P值 0.377 0.057 0.003大胎龄对照组 22 31.6±0.8 33.0±0.6 34.1±0.8大胎龄干预组 23 31.8±0.8 33.8±0.4 34.6±0.7 t值 -0.650 -3.809 -1.952 P值 0.575 <0.001 0.071
3 讨论
早产儿出生后大脑仍处在持续发育中,若受到宫外非生理环境的影响,可导致发育程序受阻,出现神经发育不良结局[18]。aEEG背景活动与常规脑电图一样可较好地反映早产儿神经发育的成熟程度,且具有无创、连续、易识别等优点,近年来已广泛运用于早产儿脑功能的监测[19]。程国强等[12]研究显示,早产儿的aEEG背景活动随着日龄增长越趋于成熟,表现为上界电压逐渐下降,下界电压逐渐增高,电压差变小。本研究显示,在行OMI第7、14天,aEEG的上、下界电压和电压差呈现相似的发育特点。由aEEG综合评分可以看出,经过OMI,干预组早产儿加快aEEG背景活动更加成熟,表明OMI促进了神经发育进程。
SWC可以反映新生儿行为状态的周期性变化,是判断脑发育的重要指标[20]。本研究显示,小胎龄组的早产儿经过OMI干预14 d后,成熟SWC比例增加,表明OMI能有效改善脑发育。大胎龄组早产儿经过OMI干预后,干预组成熟SWC比例高于对照组,但差异无统计学意义,这可能与入组时早产儿胎龄相对较大,SWC部分已基本建立,甚至基本成熟有关。同时表明SWC单独作为评估指标的灵敏度欠佳,OMI干预对于早产儿具有安全性,因此干预宜早期进行[12]。邢珊等[17]研究结果显示早产儿NBNA得分随着日龄增长而增长,但呈减速上升趋势。本研究中,OMI干预后的第7、14天,小胎龄组早产儿的神经行为表现更佳,大胎龄组在干预7 d时差异有统计学意义,14 d时尽管NBNA评分高于对照组,但差异无统计学意义,这可能与早产儿脑发育后期增长速度减慢,NBNA增长幅度减小有关。可见早期进行OMI干预可以取得良好效果。
OMI通过对口颊、牙龈、舌等相关组织或肌肉群进行拉伸和刺激,可以增强口腔的感知觉定向反馈能力,促进原始反射的形成。有学者提出,吸吮紊乱可能是脑发育障碍的首发迹象,Carstens等[21]发现口腔的感觉可以通过口腔中的特殊感受器细胞,经三叉神经传递给大脑孤束核,引起大脑皮质功能改变。此外,对口咽部进行刺激,能同时兴奋三叉神经、面神经、舌咽神经、副神经、舌下神经等多对参与支配吸吮-吞咽-呼吸的颅神经,从而引起大脑中枢模式发生器功能的改变。研究表明,神经系统的发育与吸吮组织的协调和成熟相互平行,同时早期吸吮模式可以预测后期神经发育结局[22],因此在生后大脑发育的关键期进行感觉运动干预,可能通过周围与中枢神经间的相互作用,改善脑发育进程。
充足的营养是大脑生长及发育的重要条件[23]。早产儿因延髓-吸吮-吞咽呼吸中枢发育不成熟,常采用肠外营养方式,导致胃肠道功能刺激减少,出现多种并发症。早产儿口腔运动能力的建立与胃肠功能的协调需要持续而有力的吸吮能力,OS和NNS可以激活口周肌肉收缩,增强抵抗力量,刺激吸吮反射的成熟[24]。前期研究证实,OMI可以促进胃动素和胃泌素分泌[25],对于胃肠道黏膜生长、消化道功能的正常建立和适应性发育有重要作用。生后早期营养摄入会影响大脑发育和成熟[26],且持续到儿童和青少年期,微生物群-肠-脑轴的观点表明微生物群可以通过免疫学、内分泌和神经途径直接或间接地改变大脑的发育轨迹和后期功能[27]。早产儿处于大脑发育的敏感期,OMI通过改善早产儿营养供给及胃肠道功能,从而对脑发育产生积极效应。
综上所述,OMI作为一种感觉运动干预方法,有助于早产儿脑功能发育成熟,临床上值得推广。本研究的局限性:本研究为分层随机对照试验,低于30周的早产儿因有创通气、病情危重等因素未纳入研究,群体有待进一步扩大;仅就OMI对脑发育的近期效果进行了评价,远期效果尚需进一步随访。
利益冲突声明:所有作者声明不存在利益冲突关系。

