长链非编码RNA HAGLROS在食管鳞癌组织中的表达及其对食管鳞癌细胞生物学行为的影响
姚洁琼,任景丽,胡桂明
(郑州大学第二附属医院病理科,河南 郑州 450014)
食管癌是具有高度侵袭性、高发病率和高致死率的消化道恶性肿瘤之一[1-2]。根据WHO数据显示,食管癌是我国第六常见的恶性肿瘤,也是死亡人数第四多的肿瘤,仅2020年我国食管癌发病患者约为32.4万,死亡人数达到30.1万,严重威胁我国人民生命健康。与欧美国家好发的食管腺癌不同,我国食管癌患者的病理类型大多数为食管鳞癌,且多数患者前期临床症状不明显,易出现漏诊现象,错过最佳治疗时机[3-4]。然而,有关食管癌的研究迄今为止却较为缺乏,人们对食管鳞癌的演变过程及变化机理仍不甚清楚。近年来,食管癌的临床治疗研究进展相对缓慢,目前治疗方式以手术加新辅助放化疗为主,许多食管鳞癌患者术后的预后没有明显改善,5 a生存率常常低于20%,大多数病例死于食管鳞癌细胞的复发和恶性转移[5]。因此深入研究食管鳞癌的发病机制对于提高食管鳞癌的诊治率及改善患者预后具有重要的意义。
长链非编码RNA(long non-coding RNA,lncRNA)虽然不具有编码蛋白质的能力,但是可以以组织特异性或细胞特异性的方式作为调控分子,构建体内的RNA调控网络,在细胞分化、胚胎发育、基因转录及肿瘤细胞的生命活动等几乎全细胞水平上发挥重要的作用[5-6]。LncRNA数目众多,家族庞大,目前还有许多的lncRNA分子未被发现。LncRNA可以通过多种不同的分子机制来调控肿瘤相关基因及信号通路的活性,参与肿瘤进展,研究显示某些lncRNA可以发挥类似原癌基因或抑癌基因的作用,控制肿瘤的发生、发展[7-8]。例如,乳腺肿瘤相关RNA 25 (mammary tumor associated RNA 25,MaTAR25)是一种新近发现的lncRNA分子。MaTAR25通过在转录水平调控Tns1基因来促进乳腺癌的进展。乳腺癌细胞MaTAR25表达缺失后,Tns1基因在mRNA和蛋白质的表达水平均下降,导致细胞内骨架重组,细胞间的黏连及微绒毛减少,从而增强细胞的运动能力,导致肿瘤扩散和转移[9]。NEAT1是一种在多种肿瘤中广泛表达的lncRNA,具有2个转录变异本,即NEAT1-1和NEAT1-2[10]。NEAT1可以发生高水平的m6A修饰,其m6A水平与前列腺癌患者的骨转移呈正相关,与患者的预后生存负相关。经过m6A修饰的NEAT1可以通过m6A位点与CYCLINL1富含R的C末端结构域相互作用,从而激活CYCLINL1的表达,诱导形成CYCLINL1/CDK19复合物,并通过RNA/DNA杂交将该复合物募集到RUNX2启动子区域,增强RUNX2表达。RUNX2通过RUNX2相关信号通路介导前列腺癌的骨转移过程[11]。关于lncRNA在食管鳞癌中报道日益增多,lncRNA由于在食管鳞癌中的重要调控作用也受到关注。LncRNA AGPG是一个与葡萄糖代谢密切相关的lncRNA,在食管鳞癌组织及细胞中表达增高,且AGPG的表达与患者不良预后相关。机制上,AGPG通过特异性结合PFKFB3并阻断其与APC/C复合物的相互作用,从而抑制APC/C介导的PFKFB3的泛素化途径降解,增强其稳定性,促进细胞糖酵解和细胞增殖,导致肿瘤发生、发展[12]。在食管鳞癌细胞中,lncRNA EZR-AS1一方面通过与RNA聚合酶II形成复合物,另一方面lncRNA EZR-AS1募集SMYD3到EZR启动子下游序列中富含GC的区域,促进SMYD3结合EZR启动子,最终增强EZR转录和表达,促进食管鳞癌细胞的迁移和侵袭,加速食管鳞癌的发展[13]。因此,从lncRNA角度研究食管鳞癌的发生、发展,可能为食管鳞癌的治疗提供新思路,有助于发现新的食管鳞癌肿瘤标志物,开发新的食管鳞癌治疗靶标。
1 材料与方法
1.1 一般资料
1.1.1 细胞来源 食管上皮细胞Het-1A及食管鳞癌细胞EC109、KYSE30购自中国科学院上海细胞库。
1.1.2 临床标本 42对食管鳞癌组织及配对的癌旁组织收取自郑州大学第一附属医院胸外科经食管癌根治术切除后的手术标本,经病理证实为食管鳞癌。纳入研究的食管鳞癌患者的临床病理信息的界定,参照美国癌症联合会第8版食管癌分期标准。所有纳入患者在手术前未接受过放疗、化疗、靶向治疗等与食管癌有关的治疗。同一患者的正常食管组织取自肿瘤远端至少5 cm以外。本研究得到了郑州大学第一附属医院伦理委员会的批准,所有患者均已签署知情同意书。
1.1.3 主要仪器 NanoDrop 2000超微量分光光度计(美国Thermo公司);反转录PCR仪器(美国Thermo公司);QuantStudio5实时荧光定量PCR仪(美国Thermo公司);分光光度计(美国Molecular Devices公司);倒置光学显微镜(日本Olympus公司)。
1.2 试验方法
1.2.1 细胞培养 Het1A、EC109、KYSE30细胞培养在含有体积分数10%胎牛血清、质量分数1%双抗(青霉素、链霉素)的高糖DMEM培养基,放置于环境温度为37 ℃及含有体积分数5% CO2的培养箱中。
1.2.2 细胞及组织RNA提取 采用Trizol法提取食管鳞癌组织及细胞中的RNA。RNA提取过程全程在冰上操作进行,所用实验耗材如枪头,EP管等均需无酶处理。提取组织RNA时,首先取出适量组织,置于高通量组织研磨仪中研磨组织,使其充分破碎。针对食管鳞癌细胞,通常选取处于对数生长期的细胞,胰酶消化收集细胞后用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次后,得到细胞沉淀,置于无酶处理过的EP管中。随后向EP管中加入1 mL Rrizol裂解液,充分摇匀后置于冰上裂解10~20 min。随后12 000 r/min,4 ℃离心10 min后取上清放入新的EP管中,向EP管中加入200 μL提前预冷的氯仿,充分震荡,上下颠倒混匀数次,冰上静置10 min。4 ℃、12 000 r/min、离心15 min,可见管内溶液分层现象,RNA即存在于上层的无色水相中。向各个EP管中加入等体积的预冷的异丙醇,上下轻柔颠倒混匀数次,冰上静置5 min。4 ℃,12 000 r/min,离心15 min后,可见EP管管底出现白色沉淀,即为RNA沉淀。使用1 mL的体积分数75%无水乙醇洗涤RNA沉淀2次,7 500 r/min,5 min。最后一次洗涤完成后,弃去上清,最后微量残余液体可用吸水滤纸除去,注意不要吸走RNA沉淀。将EP管倒扣在实验台,室温15 min后晾干RNA沉淀,根据沉淀量大小加入适量的双蒸水,待其充分溶解后,NanoDrop 2000测量RNA浓度及其纯度。
1.2.3 细胞转染 细胞转染方法采取脂质体转染,所用试剂为美国Invitrogen公司的Lipofectamine 3000转染试剂。实验所用的靶向HAGLROS的小干扰RNA(small-interfering RNA,siRNA)序列及其阴性对照序列由上海吉玛公司设计合成。其序列如下:HAGLROS siRNA:GGCUAAGACUGCUGUUGAATT;对照siRNA:UUCUCCGAACGUGUCACGUdTdT。食管鳞癌细胞胰酶消化后,收集细胞,制成单细胞悬液,然后进行细胞计数,调整其浓度为2×105个/mL,然后接种到六孔板中,每孔2 mL,确保细胞均匀接种在六孔板中,置于37 ℃、体积分数5% CO2培养箱中培养24 h。镜下观察细胞生长密度,若密度达到30%~50%时,即可进行转染操作。取经过无菌无酶处理的EP管若干,分别做好标记为A管和B管。向A管和B管中各加入150 μL无血清培养基,然后向A管中加入10 μL Lipofectamine 3000转染试剂,充分混匀。B管中加入siRNA,轻柔混匀,室温孵育5 min。待孵育结束后,将A管中液体加入B管中,轻柔充分混匀,室温静置15 min。取出六孔板,根据实验分组加入配置好的转染复合物,放入培养箱中继续培养。48 h后观察细胞生长密度,若密度达到80%以上,则可进行RNA提取,PCR实验检测siRNA的敲减效率。
1.2.4 实时荧光定量PCR 应用日本Taraka反转录试剂盒(DRR047A)及Taraka SYBR Green I荧光定量PCR试剂盒,按照说明书进行实验操作,所有的实验过程在冰上进行。实验所用的引物由尚亚公司设计合成。引物序列如下:HAGLROS-F: 5’-TGTCACCCTTAAATACCGCTCT-3’; HAGLROS-R: 5’-CTTCCTCCCACACAAATACTCC-3’;GAPDH-F: 5’-AGCCACATCGCTCAGACAC-3’;GAPDH-R: 5’-GCCCAATACGACCAAATCC-3’。
1.2.5 细胞增殖检测 采用CCK-8实验检测HAGLROS对于细胞增殖能力的影响。所用试剂购自日本DOJINDO公司的CCK-8增殖试剂盒。镜下观察转染细胞,若细胞生长状态良好,活动旺盛,则可进行增殖测定实验。胰酶消化细胞后,加入适量完全培养基获得单细胞悬液,镜下测定并调整细胞悬液浓度,96孔板中接种细胞悬液100 μL,每孔2 000个细胞左右,周围的空白孔加入等体积的PBS以防止培养基蒸发。siHAGLROS组及对照组每个时间点均设置4个重复孔,分别在接种24 h、48 h、72 h及96 h后,取出做好标记的对应时间点的96孔板,采用多孔道移液器向各孔中加入10 μL CCK-8工作液,避光操作,加样过程不要产生气泡。置于培养箱中孵育2 h后取出,放入酶标仪中检测其上清液在450 nm处吸光值(OD450 nm)。根据记录的不同时间点的OD450 nm,绘制不同对照组和siHAGLROS组的细胞增殖曲线并进行统计学分析。
1.2.6 Transwell实验 胰酶消化处理siRNA转染的培养48 h后的细胞,用无菌PBS清洗细胞沉淀1~2次,以去除培养基中血清的影响,加入无血清培养基重悬细胞沉淀,轻轻吹打制成单细胞悬液,吸取少量进行细胞计数,调整细胞浓度为2.5×106个/mL,吸取200 μL细胞悬液接种于24孔Transwell上室,下室中加入600 μL含有体积分数15%胎牛血清的培养基,放入培养箱中培养24 h。24 h后从培养箱中取出Transwell小室,弃去小室内培养基,用湿润的棉签轻轻擦去小室上表面残留的未迁移到下表面的细胞,另取一个新的24孔板,加入600 μL的质量分数4%多聚甲醛,将小室放入其中固定30 min,质量分数0.1%结晶紫染色30 min。染色完成后,用PBS清洗小室,去除多余的染色液,洗涤2~3次后倒置小室,室温自然晾干,置于显微镜下随机选取6~8个视野,拍照并计数贴壁细胞数量,实验重复3次,统计并分析各组间细胞数目差异。

2 结果
2.1 HAGLROS在食管鳞癌组织中的表达及与食管鳞癌患者临床病理参数之间的关系通过RT-PCR的方法在42对食管鳞癌患者的肿瘤组织及正常食管组织中,对HAGLROS进行mRNA水平的检测。结果显示:食管鳞癌组织中HAGLROS的相对表达量平2.771±1.647,而正常食管组织中HAGLROS的相对表达量为1.808±1.039; HAGLROS在食管鳞癌肿瘤组织中的表达明显高于正常食管组织,差异有统计学意义(t=2.913,P=0.006)。随后,我们分析了HAGLROS的表达与食管鳞癌患者肿瘤的淋巴结转移、分化程度及TNM分期之间的关系。结果显示,存在淋巴结转移患者中HAGLROS的相对表达量为3.353±1.625,无淋巴结转移患者中HAGLROS的相对表达量为1.996±1.363,HAGLROS的表达与肿瘤的淋巴结转移状态存在明显关联(t=2.866,P=0.007);低分化患者中HAGLROS的相对表达量为3.126±1.919,中、高分化患者中HAGLROS的相对表达量为2.530±1.425,HAGLROS的表达与肿瘤的分化程度无明显关联(t=1.156,P=0.254);Ⅲ~Ⅳ期患者HAGLROS的相对表达量为3.623±1.542,Ⅰ~Ⅱ期患者中HAGLROS的相对表达量为1.920±1.290,HAGLROS在Ⅲ~Ⅳ期食管鳞癌患者中的表达明显高于Ⅰ~Ⅱ期(t=3.882,P=0.001)。见图1。
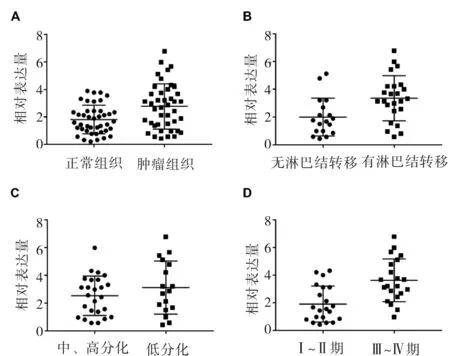
图1 不同食管组织中HARLROS的相对表达量
A:食管鳞癌组织与正常食管组织比较;B:有无淋巴结转移食管鳞癌患者比较;C:不同分化程度食管鳞癌患者比较;D:不同分期食管鳞癌患者比较
2.2 HAGLROS在不同食管细胞中的表达通过RT-PCR对Het1A、KYSE30及EC109细胞中HAGLROS的表达进行检测。结果显示,HAGLROS在KYSE30中的相对表达量最高(4.433±0.620),EC109中的表达次之(3.187±0.444),Het1A最低(1.223±0.236)。与Het1A细胞相比,HAGLROS在KYSE30与EC109细胞中的表达均明显增加,差异均有统计学意义(t=8.384,P=0.001;t=6.767,P=0.003)。见图2。
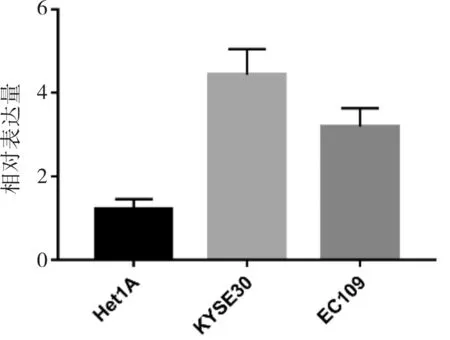
图2 HAGLROS在正常食管上皮细胞及食管鳞癌细胞中的表达
2.3 HAGLROS对食管鳞癌细胞增殖的影响在KYSE30与EC109细胞中,转染小干扰RNA(siRNA)抑制HAGLROS的表达。转染48 h后,RT-PCR检测对照组及敲减HAGLROS组(siHAGLROS)中HAGLROS的mRNA水平。结果显示,针对HAGLROS的siRNA能够有效抑制其在KYSE30与EC109细胞中的表达,敲减效率分别为68%与65%(P=0.001;P=0.001)。随后,通过CCK-8法检测敲减HAGLROS后,2种食管鳞癌细胞增殖速率的改变。结果显示,在KYSE30细胞系中转染siHAGLROS后的72 h,siHAGLROS组的OD450为0.631±0.060,而对照组为0.840±0.064,与对照组相比,siHAGLROS组的细胞增殖速率明显下降(t=4.756,P=0.003);在转染后96 h,siHAGLROS组的OD450为0.941±0.062,而对照组为1.302±0.062,siHAGLROS组的细胞增殖速率同样明显受到抑制(t=8.203,P=0.001)。而在EC109细胞系中转染siHAGLROS后的96 h,siHAGLROS组的OD450为1.020±0.094,而对照组为1.392±0.088,细胞增殖速率明显下降(t=5.790,P=0.001),其他时间点2组细胞的增殖速率均无明显差异。见图3。
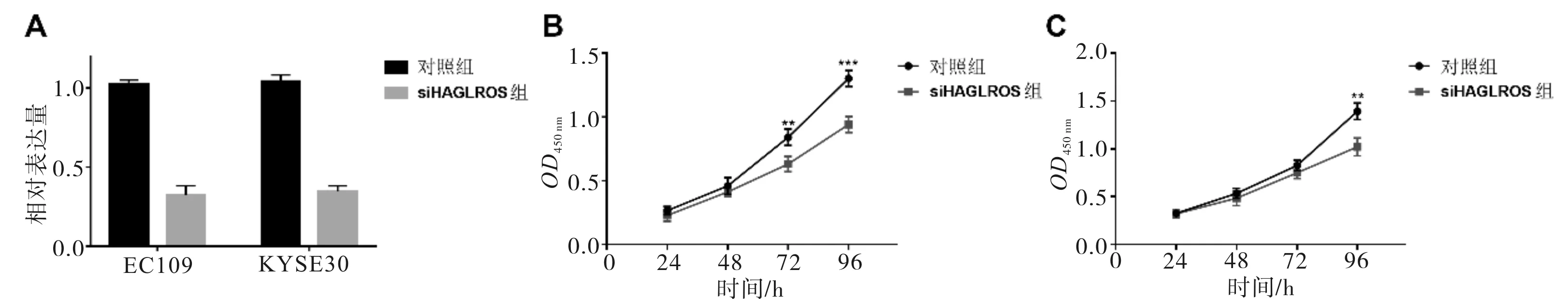
图3 敲减HAGLROS对不同食管鳞癌细胞增殖的影响
2.4 HAGLROS对食管鳞癌细胞迁移的影响在KYSE30与EC109细胞中转染siHAGLROS,48 h后将各组细胞置于Transwell小室的上室中,检测食管鳞癌细胞迁移能力的改变。将细胞在Transwell小室培养24 h后,检测各组细胞迁移至下室的数量。结果显示,在KYSE30细胞中,siHAGLROS组的细胞数量为105.300±17.040,而对照组的细胞数量为179.700±21.220,表明抑制HAGLROS的表达,能够有效抑制肿瘤细胞迁移至下室的细胞数量(t=4.731,P=0.009)。在EC109细胞中,对照组的细胞数量为139.300±14.740,siHAGLROS组的细胞数量为68.670±8.622,Transwell下室中的siHAGLROS组细胞数量与对照组相比同样明显降低(t=7.167,P=0.002)。见图4。
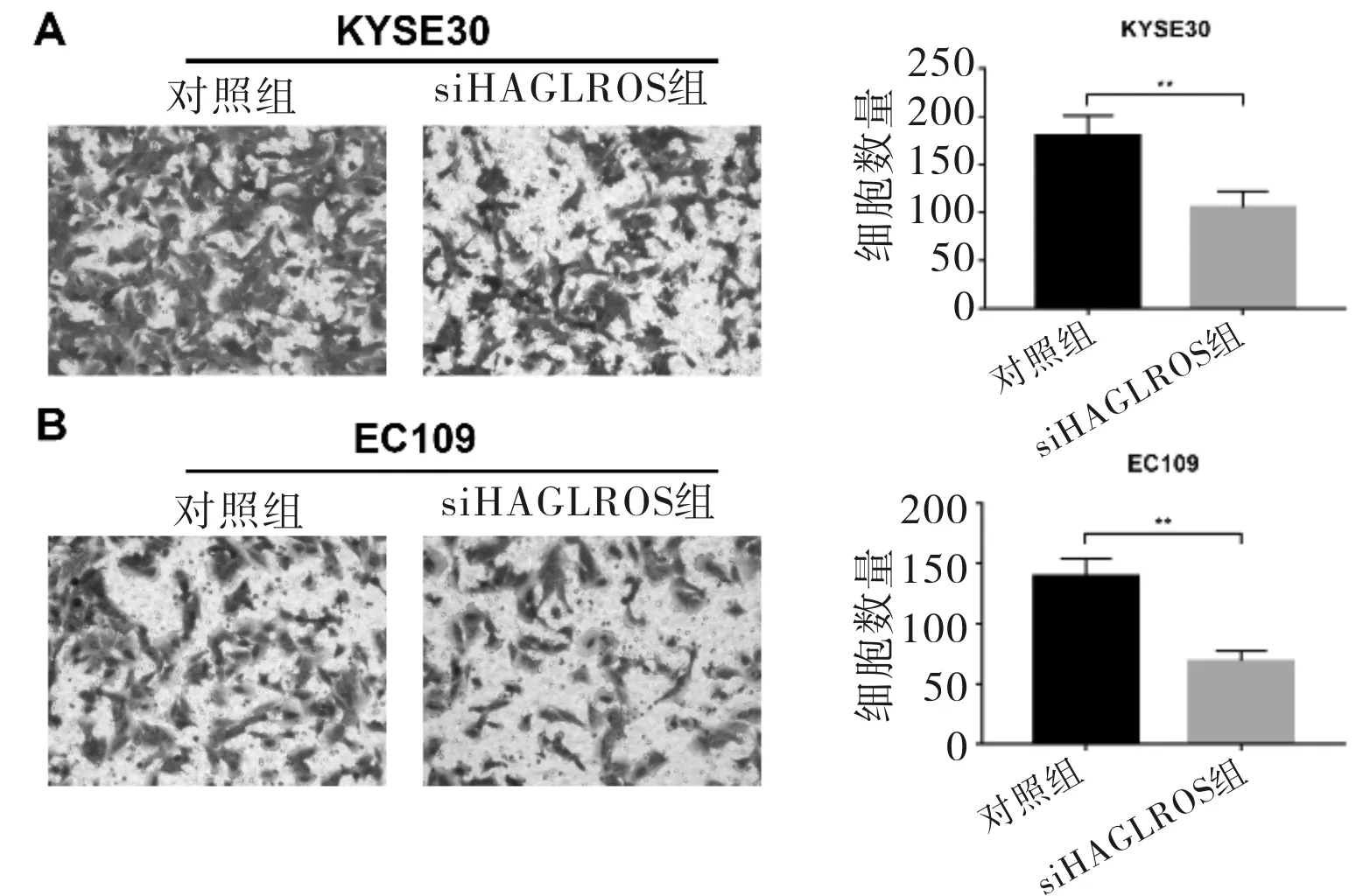
图4 Transwell实验检测敲减HAGLROS后对KYSE30细胞(A)和EC109细胞(B)迁移能力的影响。
3 讨论
HAGLROS是一条全长约699 bp的lncRNA,定位于人类2号染色体q31.1位置,主要表达在细胞质中。HAGLROS最初是在胃癌中被报道其功能, HAGLROS在胃癌组织中表达增加并与胃癌患者的不良预后相关,同时能够促进胃癌细胞的增殖与迁移及侵袭。HAGLROS能够通过吸附miR-100-5p,促进mTOR的表达,抑制细胞自噬;此外其还能够通过直接结合mTOR,促进mTOR信号通路活性,促进胃癌的恶性进程[14]。在结直肠癌细胞中,敲减HAGLROS能够明显促进细胞凋亡并且抑制细胞自噬,并且通过PI3K/AKT/mTOR信号通路抑制肿瘤的发生[15]。HAGLROS在胆管癌细胞中同样发挥促癌作用,HAGLROS能够增强脂代谢相关蛋白的表达,调控脂类代谢重编程并激活mTOR信号通路,促进肿瘤细胞的增殖与转移[16]。由此可见, HAGLROS在多种肿瘤中具有重要的促癌作用,并且这一效应与mTOR信号通路介导的细胞自噬密切相关。此外,Liu等[17]发现HAGLROS在肺炎急性期患者的血浆中表达上升,在肺成纤维细胞中敲减HAGLROS的表达,能够通过促进细胞增殖、抑制细胞凋亡与自噬从而减轻脂质体对细胞的损害,表明HAGLROS在炎症的发病过程中同样起到关键的作用。
然而,关于HAGLROS在食管鳞癌中的表达水平及生物学功能仍未有相关报道。我们的研究结果首次证明,HAGLROS在食管鳞癌组织中表达明显增加,并且具有淋巴结转移的食管鳞癌患者中HAGLROS的表达相较于没有淋巴结转移的患者明显上升;而晚期食管鳞癌患者中HAGLROS的表达也比早期食管鳞癌患者中高,以上结果表明,HAGLROS可能在预测食管鳞癌患者的淋巴结转移及临床分期中具有重要的价值。我们通过在食管鳞癌中敲减HAGLROS的表达,发现食管鳞癌细胞的增殖能力及迁移能力均有所下降,提示HAGLROS可能对食管鳞癌细胞的恶性表型起到促进作用。
综上所述,我们的研究结果对于阐明HAGLROS在食管鳞癌中的表达模式及生物学功能具有深远的意义。鉴于HAGLROS对食管鳞癌细胞增殖及迁移的重要影响,后续对于HAGLROS在食管鳞癌中促癌作用的分子机制研究,将更有助于未来开展针对HAGLROS的靶向治疗。

