高效液相色谱测定D- 阿洛酮糖3 - 差向异构酶酶活力
程娇梅,齐祥明,郭晓华
(1.中国海洋大学食品科学与工程学院,山东青岛 266000;2.青岛蔚蓝生物股份有限公司,山东青岛 266000;3.山东美佳集团有限公司,山东 日照 276826)
D- 阿洛酮糖3 - 差向异构酶(D-psicose 3-epimerase,DPEase) 是一种酮糖3 - 差向异构酶,可以将D- 果糖转化为D- 阿洛酮糖[1]。D - 阿洛酮糖是一种自然界中存在含量极少的稀有糖,其甜度相当于蔗糖的70%,但能量沉积效率仅相当于蔗糖的0.3%(这一数值明显低于目前流行的代糖产品,木糖醇),因此D - 阿洛酮糖具有降血糖[2]、影响脂肪代谢[3-4]等生理功能,是一种潜在的可用于控制肥胖和糖尿病[5-6]的新型低热量甜味剂[7]。目前,如果能实现上述的D- 阿洛酮糖3 - 差向异构酶商业化生产,则有望实现该糖的大规模产业化生产。
酶活力是酶制剂生产、应用中的关键定量指标。然而,目前关于D - 阿洛酮糖3 - 差向异构酶酶活力测定的方法报道还非常有限。尽管该酶相关的研究文献提到了一些酶活力的测定手段[8-10],但大多语焉不详,且不够严谨。
因此,尝试基于该酶产物D - 阿洛酮糖的高效液相色谱定量检测法的建立,确定该酶活力的检测方法。D - 阿洛酮糖和D - 果糖为C3 位差向异构体,结构和性质相似。因此,在酶活力测定的关键在于通过高效液相色谱将底物D - 果糖和产物D -阿洛酮糖分离,实现对D - 阿洛酮糖含量的精确定量。在此基础之上,还对该酶的酶促反应条件进行了系统的研究,进而建立了操作简单、准确可靠的酶活力测定方法,为该酶制剂的生产技术开发提供酶活力检测方法上的支持。
1 材料与方法
1.1 材料与试剂
D - 阿洛酮糖3 - 差向异构酶(液体),蔚蓝生物集团有限公司提供。
D- 果糖(≥99%)、D- 阿洛酮糖(≥98.0%),上海阿拉丁生化科技股份有限公司提供;甲醇、EDTA 二钠钙,均为市售色谱纯;十二水合磷酸氢二钠、二水合磷酸二氢钠、一水合柠檬酸,均为市售分析纯;去离子水,为自制纯净水。
1.2 仪器与设备
E2695、2414 型高效液相色谱仪,美国沃特世公司产品;PHS-3E 型pH 计,上海仪电科学仪器股份有限公司产品;TG16-WS 型高速离心机,湖南湘仪实验室仪器开发有限公司产品;DK-98-IIA 型恒温水浴锅,天津市泰斯特仪器有限公司产品;QT-1 型漩涡混合器,上海琪特分析仪器有限公司产品。
1.3 分析方法
1.3.1 酶活力定义及酶促反应步骤
D- 阿洛酮糖3 - 差向异构酶酶活力定义:在一定温度、pH 值条件下,每分钟生成1 μmol D- 阿洛酮糖的量定义为一个酶活力单位,用U 表示。
酶促反应步骤:取4 mL 一定pH 值、一定质量分数的D- 果糖溶液作为底物,加入1 mL 稀释好的D- 阿洛酮糖3 - 差向异构酶溶液,一定温度下水浴反应一定时间,沸水浴10 min 终止反应,冷却后用高效液相色谱测定D- 阿洛酮糖含量。
D- 阿洛酮糖3 - 差向异构酶酶活力计算公式:
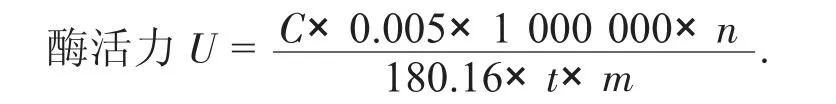
式中:U——D- 阿洛酮糖3 - 差向异构酶酶活力,U/mL;
C——通过标准曲线算得的D - 阿洛酮糖质量浓度,g/L;
0.005 ——反应总体积,L;
1 000 000——g 与μg 的转换系数;
n——稀释倍数;
180.16 ——D- 阿洛酮糖摩尔系数,g/mol;
t——反应时间,min;
m——样品的量,mL。
1.3.2 D - 阿洛酮糖含量测定
色谱条件:色谱柱为Waters Sugar-Pak I 型色谱柱,流动相50 mg/L EDTA 钙溶液,流速0.3 mL/min,柱温90 ℃,进样温度25 ℃,检测器为示差检测器,检测器温度35 ℃,进样量10 μL,运行时间40 min。
在该色谱条件下测定D - 阿洛酮糖含量,对该方法的线性范围、检测限、定量限、重复性、加标收回率进行试验。
1.3.3 酶活力测定过程中最适条件探索
(1) 底物质量分数的确定。分别用pH 值6.5 的缓冲液配制质量分数为4%,8%,15%,30%,40%的D- 果糖溶液,取4 mL 底物溶液,加入1 mL 酶液(此时的实际底物质量分数为3.2%,6.4%,12.0%,24.0%,32.0%),在45 ℃下进行酶促反应30 min,测定反应液中的D - 阿洛酮糖产量,以确定底物质量分数是否过量。
(2) 最适反应温度的确定。用pH 值6.5 的缓冲液配制质量分数为30%的D- 果糖溶液,分别在30,35,40,45,50,55,60,65,70 ℃条件下进行酶促反应30 min,计算每个温度下的酶活力,做温度-酶活力曲线。
(3) 最适反应pH 值的确定。分别用pH 值4.0,5.0,6.0,7.0,8.0 的缓冲液配制质量分数为30%的D- 果糖溶液,在45 ℃下进行酶促反应30 min,计算每个pH 值下的酶活力,做pH 值- 酶活力曲线。
(4) 反应时间的确定。用pH 值7.0 的缓冲液配制质量分数为30%的D- 果糖溶液,在45 ℃下,分别进行5,10,15,20,25,30,60 min 的酶促反应,计算不同反应时间下的酶活力,做反应时间-酶活力曲线。
1.3.4 D - 阿洛酮糖3 - 差向异构酶酶活力测定方法验证
选取10 个不同酶活力的样品,用pH 值7.0 的缓冲液配制质量分数为30%的D- 果糖溶液,在45 ℃下进行酶促反应,计算每个样品的酶活力,重复测定5 次,计算其RSD。
2 结果与分析
2.1 D- 阿洛酮糖HPLC 含量测定
通过前期试验确定较优的色谱条件为Waters Sugar-Pak I 型色谱柱,流动相50 mg/L EDTA 钙溶液,流速0.3 mL/min,柱温90 ℃,进样温度25 ℃,检测器为示差检测器,检测器温度35 ℃,进样量10 μL,运行时间40 min。
果糖与D- 阿洛酮糖色谱图见图1。
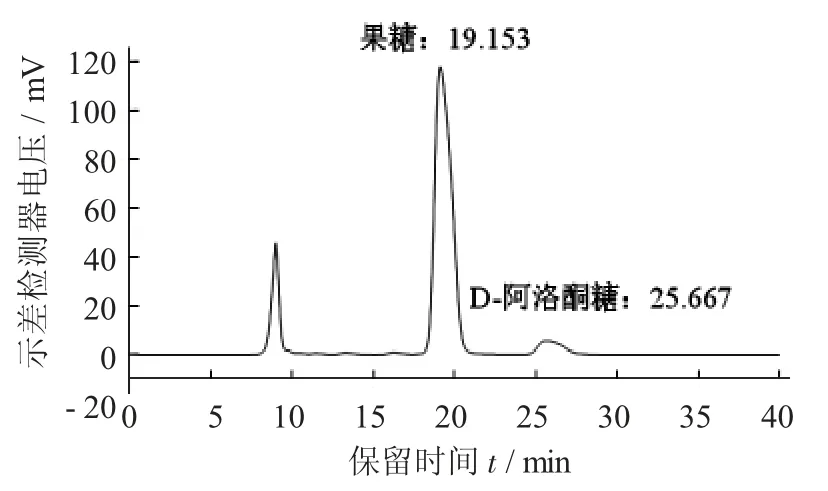
图1 果糖与D - 阿洛酮糖色谱图
由图1 可知,在此条件下,D- 阿洛酮糖在25~28 min 出峰,和反应底物D- 果糖(出峰时间在17.5~21.5 min) 可以实现有效分离。进一步探索可知,D-阿洛酮糖的检测限为4.12 mg/L;信噪比(S/N)=10 的含量为定量限为10.3 mg/L;在测酶活拟采用的产物质量浓度范围0.5~5.0 g/L 内,线性度良好,R2=1。验证试验结果表明,此处建立的该糖检测方法重复性(RSD) 小于1.0%;加标回收率为98.92%。
2.2 酶活力测定过程中最适条件探索
底物质量分数- 酶活力测量值关系见图2。
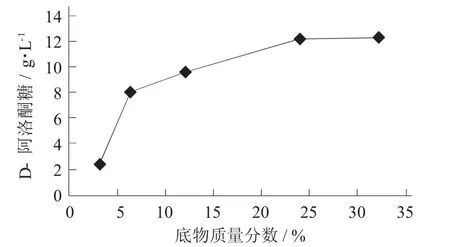
图2 底物质量分数- 酶活力测量值关系
由图2 可知,酶反应体系中底物质量分数为3.2%~24.0%时,产物D - 阿洛酮糖测量值随着底物质量分数的增大而增加,这说明此时的底物质量分数没有达到过量的程度。当底物D - 果糖质量分数超过24.0%时,产物D - 阿洛酮糖测量值不再随着底物质量分数增加而变化,说明当反应体系质量分数超过24.0%时,底物质量分数达到了过量水平。因此,从经济性和酶反应的可操作性角度,最终确定反应体系内底物质量分数为24.0%。底物质量分数再高时,反应液黏度大幅度增加,不利于酶反应充分进行。酶液酶活过高时,则进行适度的稀释后再进行测定。
温度- 酶活力关系见图3。
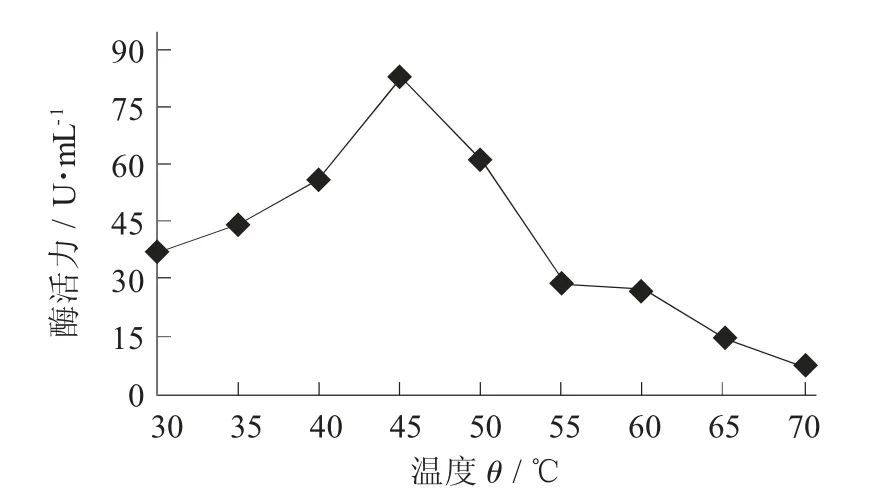
图3 温度- 酶活力关系
由图3 可知,温度为30~45 ℃时,酶活力随温度增加而增加;45 ℃时,酶活力达到最大值;45~70 ℃时,酶活力随着温度增加逐步下降;当温度为55 ℃时,酶活力只有最高酶活力的40%左右。综上所述,45 ℃是该酶最适温度,也是酶活力测定过程中所选用的温度。
pH 值- 酶活力关系见图4。
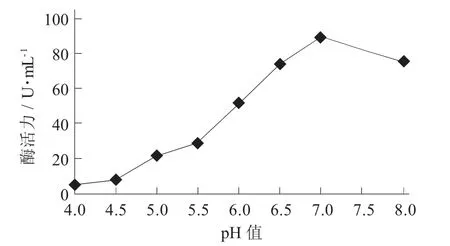
图4 pH 值- 酶活力关系
由图4 可知,pH 值为4.0~7.0 时,酶活力随着pH 值的增加而增加;而pH 值为5.5~7.0 时,酶活力增加较快;pH 值7.0 时酶活力测量值达到最大。综上所述,pH 值7.0 是该酶最适pH 值,也是酶活力测定过程中所选用的pH 值。
反应时间- 酶活力测定值关系见图5。

图5 反应时间- 酶活力测定值关系
由图5 可知,反应时间在5~20 min 时,酶活力测定值和反应时间呈线性正相关关系;反应时间为20 min 时,酶活力测定值达到最大;相应地,D- 阿洛酮糖质量浓度和反应时间之间的关系也近似为线性正相关。反应时间超过20 min 后,体系中D - 阿洛酮糖质量浓度趋于稳定,此时根据酶活力计算公式测得的酶活力测定值随着反应时间增加而降低。这表明,在试验的酶反应体系中,当反应时间超过20 min 时,酶反应达到平衡,此后时间延长将无法正确测得酶活力实际值。因此,为使操作过程时间充足,最终确定D - 阿洛酮糖3 - 差向异构酶酶活力测定的反应时间为20 min。
2.3 D- 阿洛酮3- 差向异构酶酶活力测定方法验证
在上述确定的酶反应条件下,试验对10 个D -阿洛酮糖3 - 差向异构酶样品进行了酶活力测定试验,结果表明,RSD 值均少于5.0%(见表1),符合酶制剂检测方法建立的要求,证明了高效液相色谱法测定D - 阿洛酮糖3 - 差向异构酶酶活力的方法准确可靠。
D- 阿洛酮糖3 - 差向异构酶酶活力检测方法验证见表1。
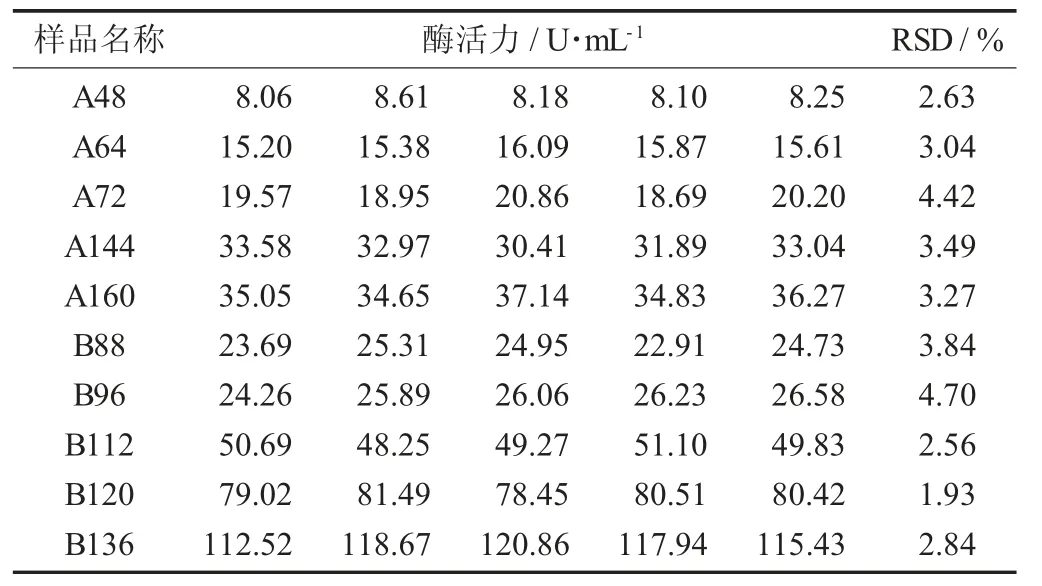
表1 D - 阿洛酮糖3 - 差向异构酶酶活力检测方法验证
3 结论
采用Waters 高效液相色谱仪(E2695,2414)Waters Sugar-Pak I 型色谱柱测定D- 阿洛酮糖含量,该方法的检测限为4.12 mg/L,定量限为10.3 mg/L,在测酶活拟选产物质量浓度0.5~5.0 g/L 范围内线性度良好(R2=1),重复性(RSD) 小于1.0%,加标收回率为98.92%。
在高效液相色谱法测定D - 阿洛酮糖含量的基础上,建立了D - 阿洛酮糖3 - 差向异构酶酶活力测定方法,从底物质量分数、温度、pH 值、反应时间等方面考查了这些因素对D- 阿洛酮糖3 - 差向异构酶酶活力测定的影响,确定了底物质量分数为24%D- 果糖溶液,最适温度为45 ℃,最适反应pH 值为7.0,反应时间为20 min。在该条件下,对D- 阿洛酮糖3- 差向异构酶酶活力测定方法进行验证,10 个样品的RSD 均少于5.0%,说明高效液相色谱法测定D- 阿洛酮糖3 - 差向异构酶酶活力准确可靠。

