植物种子的发育调控研究进展
胡婷婷, 王健康, 丁成伟, 郭荣良, 吴玉玲,徐家安, 王友霜, 赵轶鹏, 何弯弯
(江苏徐淮地区徐州农业科学研究所, 江苏 徐州 221121)
种子发育始于双受精,主要包括胚和胚乳的发育以及种子的成熟,发育过程主要包括胚的不断增长和胚乳的细胞化。因此,不仅有大量基因直接参与调控胚和胚乳的发育,还有大量调节因子形成精细复杂的网络协同调控种子发育。禾谷类种子中的淀粉积累量决定了种子的大小和重量,这与产量、品质密切相关。因而研究种子发育的调控机制,结合现有技术手段利用人类需要的等位突变,对提高农作物产量和品质具有重要的理论意义和应用价值。本文详细综述了调控种子发育的基因及影响种子发育的因素,以期为植物种子发育调控、调控种子发育新基因的鉴定、粮食产量性状遗传改良等相关研究提供理论依据。
1 调控种子发育的基因
种子发育受多个基因的精细协同调控,SHORTHYPOCOTYLUNDERBLUE1(SHB1)、HAIKU1(IKU1)、MINISEED3(MINI3)和HAIKU2(IKU2)启动胚和胚乳的发育,正调控种子的大小[1-2]。IKU1、MINI3和IKU2是IKU途径中的关键基因,在种子发育早期诱导胚乳的发育,突变后抑制游离核时期胚乳核的增殖,使得胚乳发育提前终止,最终导致种子变小。IKU1含有QV motif,其和MINI3直接互作,SHB1增强胚细胞的分化和增殖,是一个正调节子[1]。相反,拟南芥的APETALA2(AP2)基因则通过控制胚的细胞数目和细胞大小负调控胚珠和种皮的发育,从而影响种子的大小[3]。拟南芥中的钙调蛋白CML39抑制营养组织中种子成熟相关基因的表达,cml39突变体角果变短,每个角果内种子数目变少[4]。拟南芥中的亮氨酸重复序列类受体蛋白激酶EMS1及其小蛋白质配体TPD1是花药分化必需的蛋白,在玉米中其同源基因参与调控孢子母细胞分化,在水稻中则影响胚珠发育。异位表达TPD1不仅改变了植物对生长素的响应,同时也影响胚珠中细胞周期基因CYCD3;3和CYCA2;3的表达,调控种子的发育[5]。MADS29是MADSbox家族的一员,在胚珠中高表达,通过调节母体组织的PCD(programmed cell death)过程来调控种子的发育,该基因突变后,种子皱缩、变小[6]。
淀粉是禾谷类种子胚乳的主要组成部分,当淀粉合成受到影响后,种子大小、形态都会发生变化。水稻中鉴定出一大批暗色、糖质、皱缩和粉质等淀粉合成受阻的突变体,这些突变体不仅使淀粉合成有缺陷,还会导致种子大小和形态都发生变化。OsAGPS2和OsAGPL2功能缺失突变体(shr1),错义突变体(shr1a)胚乳中淀粉积累显著减少,形成种子胚乳皱缩表型[7]。FSE1编码一个含DDHD结构域的蛋白,该蛋白与磷脂水解酶A1(PA-PLA1)同源,具有磷脂水解酶活性,突变体fse1胚乳中磷脂组分及其含量发生改变,种子皱缩不透明,成熟种子的千粒重显著下降[8]。Flo16编码一个由332个氨基酸组成的胞质苹果酸脱氢酶,该基因突变后,苹果酸脱氢酶活性降低,主要淀粉合成酶的活性均受到影响,成熟的突变体种子中央完全不透明,并且整个籽粒外表略微皱缩,种子发育有明显缺陷[9]。
2 种子发育的影响因素
除了直接影响种子发育的基因以外,还有其他基因参与这个复杂的过程,包括与线粒体功能相关的亚基、PPR蛋白、激素、基因组印记、泛素化途径的相关蛋白、转录因子、细胞周期蛋白、温度、光照等相关因素(表1),都会影响种子的发育。
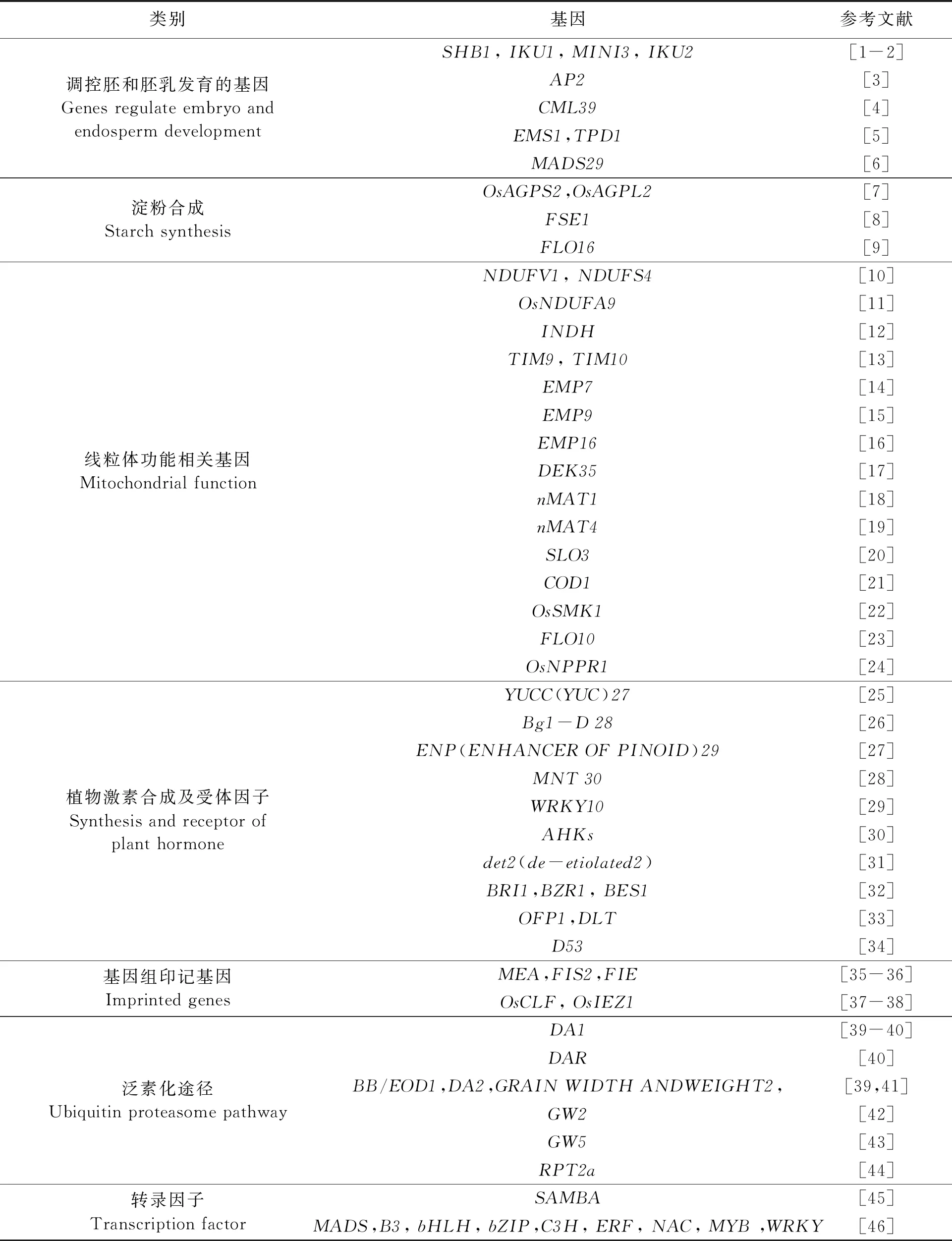
表1 与植物种子发育相关的基因
2.1 线粒体基因功能受损影响种子发育
线粒体基因的突变、异常剪切和编辑都会导致线粒体功能异常,引起呼吸通量的改变和能量供应不足,从而导致种子的胚和胚乳发育缺陷。线粒体核心亚基的突变和附属亚基的突变均会造成胚体细胞和胚乳发育受阻,形成不育或者不能萌发的种子。NDUFV1和NDUFS4分别编码拟南芥中线粒体复合体I中的催化亚基和附属亚基,这2个基因突变后,植株发育变缓。突变体ndufv1、ndufs4氧化磷酸化效率降低,ATP合成减少,种子大小和萌发均受到影响[10]。水稻中OsNDUFA9编码线粒体复合体I的1个附属亚基,该基因突变后线粒体双层膜结构损伤,线粒体嵴的结构被破坏,线粒体和淀粉合成相关基因的表达和蛋白积累量也被改变,从而产生胚致死和粉质胚乳表型[11]。INDH是线粒体复合体I必需的一个铁硫蛋白,其编码基因突变后线粒体蛋白COX2、Nad7和Nad6蛋白水平下降,indh突变体种子不能萌发或幼苗期死亡[12]。线粒体转位酶TIM9和TIM10位于线粒体膜间隙,BIFC试验表明,拟南芥中的AtTIM9和AtTIM10可能形成一个TIM9:10复合物,并无冗余地执行其功能。线粒体蛋白Tim9和Tim10的缺失导致线粒体异常释放细胞色素c,启动胚中的胚体细胞和胚乳发生细胞程序性死亡,突变体早期胚与胚乳停止分裂并死亡[13]。
PPR蛋白是一种由低度保守的31~36个氨基酸基序重复串联组成的蛋白质,在线粒体中主要参与线粒体基因的编辑、剪切和稳定性的维持等。当线粒体复合体相关基因的编辑、剪切和稳定性发生改变后也会导致线粒体功能受损,能量供应受限,从而影响胚和胚乳的发育。玉米中多个籽粒空皮表型由于PPR蛋白的缺失或突变引起,这些PPR突变体中,大多表现为胚乳传递细胞(basal endosperm transfer layer,BETL)发育受阻,能量供应受到影响,导致种子空皮表型或者畸形。EMP7编码E亚家族的PPR蛋白,影响细胞色素C成熟相关蛋白ccmFN的编辑[14];编码E+亚家族的PPR蛋白的EMP9基因突变后,线粒体基因ccmB和rps4不能被正常编辑[15];EMP16编码P型PPR蛋白,影响nad2第4个内含子的顺式剪切[16]。这些PPR基因的突变大多造成线粒体复合体的组装缺陷,影响能量供应和养分传递,最终导致籽粒的胚和胚乳发育缺陷,形成空皮表型。DEK35编码的PPR蛋白影响线粒体基因nad4第1个内含子的顺式剪切,玉米dek35-ref突变体中BETL发育受阻,影响能量供应,导致成熟种子籽粒扁小,胚和胚乳皱缩,表现为籽粒发育缺陷,且种子不育[17]。
II型内含子是存在于线粒体中的一类内含子,其正常剪切需要核编码的成熟相关蛋白(nMAT)参与,拟南芥中的nMAT基因突变后,线粒体复合体活性下降。II型内含子的顺式剪切异常,种子变小、畸形或者不育[18-19]。nMAT1参与nad1第1个内含子的剪切,基因突变后种子不育[19];nMAT4基因参与nad1前体RNA的成熟[18]。P亚家族的PPR蛋白SLO3负责线粒体基因nad7第2个内含子的剪切,SLO3基因突变后种子颜色变深、皱缩[20]。COD1是线粒体E/E+家族的PPR蛋白,负责cox2-253、cox2-698及nad4-1129位点的编辑,该基因突变后胚发育至子叶期后不再分化,种子发育受阻[21]。
此外,水稻中也鉴定出一批PPR蛋白,比如OsSMK1编码的PPR蛋白参与线粒体基因nad7的编辑,当OsSMK1突变后,种子发育异常,淀粉合成受阻,成熟种子表现粉质不透明[22],这类相关的PPR蛋白通过对线粒体基因的编辑或剪切等影响淀粉的合成和积累[17,23]。FLO10编码一个P亚家族的PPR蛋白,定位于线粒体中,该蛋白的突变影响了线粒体复合体I亚基nad1第1个内含子的反式剪切,同时伴有nad1外显子1和外显子2~5前体积累的增加,引起线粒体功能受损,从而影响胚乳发育[23]。OsNPPR1是一个核定位的P亚家族的PPR蛋白,OsNPPR1突变后线粒体功能受损,与野生型相比,突变体fgr1成熟种子粒长和粒宽未受影响,但粒厚减小,千粒重显著下降[24]。
2.2 植物激素信号转导影响种子发育
植物激素是植物自身代谢产生的一类特殊的微量存在的小分子。生长素(auxin)、细胞分裂素(cytokinin,CTK)、油菜素内酯(brassinolide,BR)和赤霉素(gibberellic acid,GA)等均在种子发育过程中发挥了重要作用[46-50]。激素的正常分布和信号转导对胚和胚乳的发育至关重要。因此,激素生物合成相关基因、激素受体因子、受激素调控且与种子发育相关基因的突变、被修饰或者表达量的改变是影响植物种子发育的重要因素。
生长素参与调控胚最终的结构和大小。受精后的胚珠在发育过程中会富集生长素,生长素启动胚乳发育过程中中央细胞的分裂和胚乳的细胞化[49],并影响种子大小。生长素生物合成中,黄素单加氧酶YUCC(YUC)对双受精后胚胎的发生和器官分化有重要作用,拟南芥yuc1、yuc4、yuc10、yuc11四缺突变体不能形成正常的下胚轴和根分生组织[25]。在水稻中,Bg1-D参与生长素的运输和分布,过表达Bg1-D可显著增加种子大小[26]。PIN是一类调节生长素极性运输的蛋白,PIN的结构或构象发生改变会影响生长素在胚中的有序分布,影响胚细胞的正确分裂[27,51]。ENP(enhancer of pinoid)则是丝氨酸/苏氨酸激酶PINOID的增强子,其通过与PID协同控制PIN1极性,从而特异性调控子叶发育[27]。另外,一些生长素应答因子也参与了种子发育调控,如MNT编码的ARF2是受生长素调节的细胞分裂的抑制子,通过结合生长素响应元件(AuxRE)调控响应生长素相关基因表达,该基因突变后种子大小和重量均大于野生型[28]。
细胞分裂素(CTK)能促进细胞分裂,影响细胞周期,对胚后期器官分化和种子发育起着重要作用,影响茎端分生组织的分裂和活性[52]。细胞分裂素氧化酶是调节CTK在植物体内分解代谢的关键酶类,其在胚乳合胞体中高表达,能降解内源CTK。IKU途径的转录因子WRKY10与CKX2直接结合,启动胚乳的生长,最终影响种子发育[29]。细胞分裂素受体能与植物激素专一地结合,通过识别激素信号,参与植物的生理生化过程。拟南芥组氨酸激酶是细胞分裂素的受体,不仅影响根尖分生组织,还参与到胚的发育,ahk2-5、ahk3-7、cre1-2三突变的种子和胚均显著增大,约为野生型2~3倍[30]。
BR在植物双受精和种子发育过程中也承担重要角色,BR缺陷型和不敏感型突变体的种子变小[32,48]。与野生型相比,拟南芥弱BR缺陷型突变体det2(de-etiolated2)育性低,强BR缺陷型突变体dwarf4(dwf4)和cpd则完全雄性不育[31]。水稻中BR缺陷型突变体种子长度变小[32,53],过表达BR生物合成相关基因能增加种子长度,提高产量潜力[54]。除BRI1、BZR1和BES1调控大部分响应BR相关基因的表达[32],OFP1则是水稻中另一个和DLT互作,且受BR诱导调节种子形态的蛋白[33]。
GA、ABA、独脚金内酯等激素也参与调控种子的发育,影响作物产量[34,55]。赤霉素和E3泛素连接酶共同作用,调控种子发育[56];拟南芥中,bZIP蛋白ABI5(ABA-INSENSITIVE 5),ABA响应原件绑定蛋白AREB3、AtbZIP67/AtDPBF2 和 EEL一样,参与ABA应答和响应,主要在种子中表达,参与种子发育的表达调控;D53是SL信号通路的抑制因子,利用不同浓度的磷酸盐处理野生型和d(darf)和d53突变体,结果表明,与野生型相比,d突变体的穗数和空瘪粒率增加,但结实率降低,千粒重下降[34]。
2.3 表观遗传调控胚乳发育
表观遗传是指基因表达或表型的改变可通过有丝分裂或减数分裂遗传,但没有DNA序列的变化,主要受基因组印记调节。胚乳的发育与表观遗传学调控密切相关,通过DNA甲基化、组蛋白甲基化、基因组印记和siRNA(small interfering RNA)等多种方式来实现[35-38,57-58]。基因组印记基因通过调控胚乳细胞分裂、生长及调节养分运输来调控种子发育。聚梳蛋白(PcG)复合体参与种子发育的多个过程[35-36],其中MEA、FIS2和FIE基因的研究较为深入,是胚乳发育的主要调控基因。MEA和FIE互作形成FIS复合体,通过调节胚乳中大量印记基因的表达,影响细胞的增殖和分化,从而影响胚乳的发育。OsFIE1和OsFIE2是水稻中2个重要的PcG蛋白,与拟南芥相似,OsFIE1和MEA的同源基因OsCLF、OsIEZ1互作,OsFIE1通过影响能量养分供应和H3K27me3的基因组修饰调控种子发育。OsFIE1突变后,种子变小,胚发育延迟,糊粉层细胞变小,结实率降低[36]。OsFIE2和OsCLF互作,OsFIE2介导的OsFIE2-PcG聚梳蛋白复合体调控水稻种子发育和灌浆[37-38]。
2.4 蛋白泛素化降解调控种子发育
泛素化是介导植物蛋白降解的重要途径,需要3种泛素酶的协同作用。泛素激活酶E1、泛素结合酶E2激活泛素和泛素连接酶E3形成三聚体,特异性识别靶蛋白并标记泛素,被标记的靶蛋白由蛋白酶体识别降解,泛素化途径参与调控种子大小[39-42,59]。泛素受体、E3泛素连接酶、泛素特异蛋白酶、26S蛋白酶体、植物特异性APC/C调节因子及泛素化途径互作蛋白等,均在调节种子大小和发育中起着重要作用。
泛素受体DA1编码一个含有2个泛素互作基序UIM和1个LIM结构域的蛋白,具有泛素结合酶活性,绑定多聚泛素蛋白后,通过26S蛋白酶体调节其降解。da1-1突变体种子变大,重量增加[39-40]。DA1的同源基因DAR是植物中特有的基因,也参与组织和种子大小调控[40]。环型蛋白E3 泛素连接酶是双子叶和单子叶植物中调控种子大小的主要因子,通过调控细胞分化和扩增影响种子发育。E3泛素连接酶BB/EOD1,DA2在拟南芥中负调控种子大小,过表达BB/EOD1、DA2种子变小;水稻中过表达DA2同源基因GRAINWIDTHANDWEIGHT2,种子也显著变小[39,41]。GW2是一个具有 E3 泛素连接酶活性,且由数量性状位点(QTL)基因编码的环型蛋白,该基因突变后谷粒变宽,种子变大[42]。GW5是水稻中的另一个主效QTL位点,可能和GW2互作参与泛素化调控途径,调节种子发育过程中的细胞分化,影响种子大小[43]。
26S蛋白酶体是降解泛素标记蛋白的主要蛋白酶,具有多个多亚基,其调节亚基RPT2a的基因功能缺失会导致26S 蛋白酶体活性下降,种子变大[44]。细胞周期蛋白调节细胞分化和细胞增殖,E3 泛素连接酶复合物APC/C能识别细胞周期蛋白,调控细胞分裂周期调控,介导细胞周期蛋白降解。SAMBA是植物中特有的APC/C调节子,负调控种子大小,在胚形成时期大量表达。该基因突变后A2型细胞周期蛋白CYCA2;3稳定性增强,启动细胞增殖和核内复制,种子增大[45]。
3 展望
植物种子是裸子植物和被子植物特有的繁殖器官,植物种子中的淀粉、维生素等营养物质不仅为下一代的萌发和发育提供养分,也为人类提供主要粮食来源。种子的发育状态影响其后代的生长发育,也影响农作物的品质和产量。因此,研究植物种子的发育及调控不仅对研究植物发育,同时对作物高产育种具有重要的理论意义和应用价值。
植物种子发育是一个极其精细复杂的过程,在植物种子的发育过程中,不仅有大量基因直接参与调控种子胚和胚乳的发育,还有线粒体复合体上基因的突变、参与线粒体RNA加工的PPR蛋白、植物激素、泛素化相关蛋白,DNA甲基化、组蛋白甲基化、siRNA,miRNA[60]和非编码长链RNA等都会影响植物种子胚和胚乳的发育。除此之外,还有大量转录因子通过组成复杂的转录因子调控网络,这些转录因子分别在种子发育的不同时期通过结构域与顺式元件相互作用调控相应基因的表达,如MADS、B3、bHLH、bZIP、C3H、ERF、NAC、MYB、WRKY等家族的转录因子,在植株种子发育过程中起到了极其重要的调控作用[46]。目前还鉴定到了一些谷蛋白转运关键因子[61]和内质网胁迫应答相关的蛋白[62],这些基因突变后,导致种子中淀粉的积累和谷蛋白含量发生改变,从而影响种子形态、大小。此外,细胞周期蛋白[63],与DNA损伤修复[64]、养分传递等相关的蛋白[65]、温度等相关因素,也会影响种子的发育。
随着分子生物学研究方法和技术手段的不断发展,植物种子发育的分子机制尤其是针对种子大小、数量、品质等发育相关的研究取得了很大进展。但是,这些调控基因之间的互作、不同调控途径之间的交互作用、更多相关基因的发掘还需要进一步研究。明确不同的调控因子在种子发育中的作用,并通过全基因组关联分析选择人类需要的等位突变将有助于提高农作物产量和品质,为人类粮食供给做更大贡献。

