牡丹“大胡红”顶芽组培快繁技术的初步研究
石秀丽,何松林,贾文庆
(河南科技学院园艺园林学院,河南新乡453003)
牡丹(Paeonia suffruticosaAndr.)为芍药科芍药属,多年生落叶亚灌木,为我国所特有[1],主要位于我国的中部、西南部及西北部地区[2].
牡丹繁殖方式为有性繁殖和无性繁殖,主要以有性繁殖为主,用其种子进行,但播种后代会出现分离变异,母本的优良性状不能很好地保存[3],且种子会存在二次休眠和生理后熟的现象,导致播种育苗的周期延长[4];其无性繁殖主要为扦插、嫁接、分株等方式[5],但存在成苗周期长、繁殖系数低、出苗量少且质量参差不齐等问题.与传统的育苗技术相比较,组织培养技术更有利牡丹的育种和快速繁殖[6].目前,国内外针对牡丹组织培养方面已有一定的研究成果[7].外植体种类繁多,主要有鳞芽、土芽、叶片、叶柄、花药等,其中以牡丹鳞芽为外植体进行培养的研究报道居多[8].
牡丹育种的主要困难是育种周期长和杂交败育[9].而牡丹商业化繁殖的主要方式为嫁接和分株,但分株法的繁殖周期比较长,一般分株1次需要3~4年[10],这严重地限制了牡丹育种和繁殖工作的开展.为更好地保存种质资源,用组织培养的方法进行研究非常必要.目前该方法主要集中于基本培养基的筛选以及植物生长调节剂的筛选,有关硝态氮和铵态氮的研究还未见报道,本文在几种基本培养基基础上添加硝态氮和钙元素,探究其之间的关系,以期为牡丹组织培养的繁殖和育种奠定基础,对组培技术方法的开发提供借鉴和参考.
1 材料与方法
1.1 试验材料
所用牡丹顶芽均由洛阳国家牡丹基因库提供,以“大胡红”为试验材料.
1.2 试验方法
1.2.1 材料处理 先用自来水冲洗外植体(顶芽)表面,再用毛刷蘸洗衣粉溶液刷洗每个顶芽,最后用流水冲洗2 h.在超净工作台上用体积分数为75%的乙醇溶液消毒30 s,用无菌水冲洗一次,再用质量分数为0.1%的升汞灭菌7~8 min.灭菌后用无菌水冲洗5~6次,每次大约2 min,在无菌条件下把牡丹顶芽放入带滤纸的无菌培养皿中.
1.2.2 试验方法 以1/2MS、Ca(NO3)2的MS、MS、WPM为四种基本培养基(培养基中分别添加质量浓度为6~7 g/L的琼脂和质量分数为3%的蔗糖,并加入活性炭作为吸附剂).用浓度均为1 mol/L的NaOH和HCl溶液调节pH值至5.8~6.4,高压灭菌锅123℃下灭菌30 min,加入不同浓度的细胞分裂素6-BA和生长素NAA,调整激素配比.将无菌外植体接种在培养基上进行丛生芽诱导,每种基本培养基设4个处理,每个处理有5个重复.共接种80瓶,每瓶接种3个外植体.
接种后先暗培养4~5 d.然后置于光下培养,光照强度1 500~2 000 Lux,每天光照12 h,温度25±1℃.培养时间为30 d.观察不同基本培养基对顶芽愈伤组织的影响;培养条件同上,培养时间为40 d.观察不同基本培养基对顶芽分化率及增殖系数的影响.
1.2.3 测试指标
出愈率/%=诱导出愈伤组织的外植体个数/总接种的外植体个数×100,
分化率/%=已分化的外植体数/接种外植体总数×100,
增殖系数=培养40 d后外植体的总数/接种时的外植体总数.
1.3 数据分析
利用Excel 2010软件对试验数据进行整理,用DPS软件进行数据的处理与分析.
2 结果与分析
2.1 不同基本培养基对愈伤组织的影响
诱导愈伤培养基成分见表1,“大胡红”培养30 d后调查出愈率情况见表2.
由表1和表2可以看出,以Ca(NO3)2的MS和WPM为基本培养基的顶芽愈伤组织诱导率最高.在培养一个月时,在处理B(2)、D(1)中,分别形成1 cm左右浅绿色的颗粒状愈伤组织,植株长势良好,丛生芽数量多,叶片全部展开且为正常绿色.随着6-BA浓度的升高,愈伤组织诱导率下降,在Ca(NO3)2的MS中6-BA浓度为1.0 mol/L时,NAA浓度为0.1 mol/L时,出愈率相对较高.

表1 诱导愈伤培养基成分Tab.1 The culture medium ingredients of the induction injuries mol/L

表2 “大胡红”培养30 d后调查出愈率情况Tab.2 The recovery rate of Dahuhong after 30 days'cultivation
2.2 不同基本培养基对顶芽分化及增殖的影响
诱导分化培养基成分见表3.

表3 诱导分化培养基成分Tab.3 Induction differentiation culture medium ingredients mol/L
“大胡红”培养40 d后调查分化率以及增殖系数情况见表4.

表4 大胡红培养40 d后调查分化率以及增殖系数情况Tab.4 Investigation of differentiation rate and proliferation coefficient of Dahuhong after 40 days'culture
由表4可知,WPM培养基6-BA浓度为1.0 mol/L时,NAA浓度为0.3 mol/L时,其分化率和增殖系数最高.并且芽的长势好,丛生芽数量多,且分化出直径大约1 cm的绿色愈伤组织;Ca(NO3)2的MS培养基,用Ca2+加倍,NO3-代替Cl-和NH4+,发现增殖系数也较高,丛生芽多,长势也较好,同时也有直径大约为0.8 cm的绿色愈伤组织出现,但分化率较低.这可能与培养基中Ca2+的含量有关.1/2MS培养基增殖系数和分化率一般,有部分愈伤组织出现,MS培养基里用1/3CaNO3代替Cl-和NH4+,发现增值系数和分化率较弱,无愈伤组织出现,这可能与培养基中NO3-的含量有关.四种培养基顶芽的生长情况见图1.

图1 四种培养基顶芽的生长情况Fig.1 Growth of terminal buds of four media
2.3 不同基本培养基对顶芽增殖系数的影响
“大胡红”不同基本培养基种类对牡丹顶芽分化的影响见表5.

表5 “大胡红”不同基本培养基种类对牡丹顶芽分化的影响Tab.5 Effect of different basic medium species of Dahuhong on multiplication coefficient of peony
四个牡丹品种的增殖系数方差分析结果见表6.
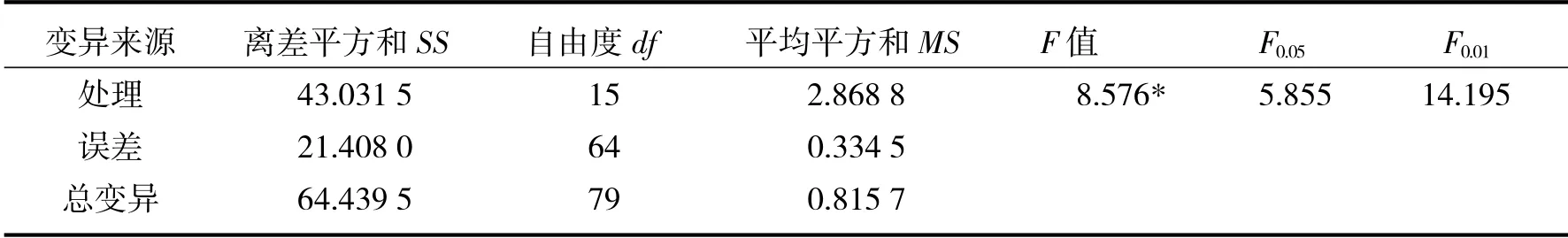
表6 方差分析表Tab.6 Variances analytical tables
从表6方差分析结果表明:四个牡丹品种的增殖系数在不同的培养基上差异显著.不同培养基种类的多重比较结果见图7.
从表7多重比较的结果可知,在培养基对增殖系数的影响中,B、D的效果极显著,明显优于A、C;A和C之间差异不显著.结合试验过程中B和D培养基上顶芽的生长快、分化时间短、增殖系数高和较少发生污染以及褐化的现象,选择B、D为本研究的最佳培养基.

表7 不同培养基种类的多重比较结果Tab.7 The multiple comparative results of different types of culture medium
3 结论与讨论
基本培养基是植物材料赖以生长和发育的基础,为植物生长和发育提供必需的矿质营养.张倩等[11]在试管苗生长的过程中使用的培养基多为MS或1/2 MS;安佰义[12]在研究不同培养基诱导丛生芽的试验中,发现外植体通过低温处理后,可以产生丛生芽,WPM培养基诱导率最高,其次是MS培养基,B5培养基最低;王新等[13]用凤丹鳞芽进行组织培养时,也证实了WPM培养基诱导率最高.本试验以1/2MS、Ca(NO3)2的MS、MS和WPM四种基本培养基为基础,结果表明Ca(NO3)2的MS和WPM的培养基诱导较好,与安佰义[12]、王新等[13]研究结果一致.
为优化组织培养体系,在原有基础上进行组织培养,能够提高植物的再生效率[14].在植物不定芽的诱导增殖研究中,添加的生长调节剂主要为6-BA,浓度介于0.5~3 mol/L之间、NAA浓度介于0.2~3.5mol/L[15].本试验采用加入不同浓度的6-BA和NAA的方法来研究牡丹试管苗的增殖情况,结果表明:在6-BA浓度为1.0 mol/L条件下,在培养基中加入NAA,愈伤组织的生长量最大,芽的增殖系数相对较高.培养基为Ca(NO3)2的MS+6-BA浓度为1.0 mol/L+NAA浓度为0.1 mol/L和WPM+6-BA浓度为1.0 mol/L+NAA浓度为0.3 mol/L时为最佳.这与张玉芳等[16]的观点一致.
蛋白质和核酸的重要组成部分是氮,也是植物需求量最大的矿质元素,硝态氮和铵态氮(NO3--N,NH4+-N)是植物吸收的主要氮源[17].很多研究表明NH4+/NO3-的比值影响组培苗的生长,控制着不定芽的发生,减少NH4+的含量,提高NO3-的含量,降低Cl-的含量,还能够减轻玻璃化的发生,提高组培快繁的有效增殖率.在牡丹组织培养中,Bouza等[18]研究认为将MS基本培养基中Ca2+加倍,能减缓BAP与GA3长期配合使用带来的不良后果,减轻组培苗的顶芽和叶尖坏死现象.本试验以MS和WPM两种基本培养基为基础,通过改变Ca源(用Ca(NO3)2替代或部分替代CaCl2),结果表明添加Ca(NO3)2的MS和WPM的增殖系数和愈伤组织比较高,但分化率较低.这与前人研究的观点一致.分化较低的原因可能是因为品种不同,不同生长时期取材对分化也有影响.
综上所述,诱导丛生芽和愈伤组织,以Ca(NO3)2的MS+6-BA浓度为1.0mol/L+NAA浓度为0.1 mol/L和WPM+6-BA浓度为1.0 mol/L+NAA浓度为0.3 mol/L形成无根苗的培养基为最佳.但有关牡丹组织培养的报道,最早的是关于愈伤组织的报道.本试验仅研究从牡丹顶芽的丛生芽诱导和愈伤组织诱导方面内容,有关生根方面的试验还有待进一步研究.

