小儿卡波西型血管内皮瘤19例临床分析
曹金俊,谢 伟,朱晓东,夏 昊
上海交通大学医学院附属新华医院小儿急危重症医学科,上海200092
卡波西型血管内皮瘤(Kaposi form hemangioendothelioma,KHE)是一种好发于婴幼儿的罕见的血管肿瘤,1993 年 由Zukerberg 命 名[1],发病 率 约 为9.1/100 万[2]。肿瘤为良性,但常呈侵袭性生长,可伴随卡萨巴赫-梅里特(卡梅)现象(Kasabach-Merritt phenomenon,KMP),表现为血小板减少、纤维蛋白原降低、贫血和凝血因子消耗等[3]。由于KHE 整体发病率低,国内学者对该病研究较少[4-5],国外的病例数和治疗经验也有限[6],目前国内外还没有公认的基于循证医学的治疗指南。本研究拟回顾性分析近年来上海交通大学医学院附属新华医院收治的KHE 患儿的临床资料,并进行文献复习,进一步探讨KHE的临床特点和诊疗方案。
1 对象与方法
1.1 研究对象
收集2009 年1 月—2017 年12 月上海交通大学医学院附属新华医院收治的KHE 患儿资料,共19 例。所有病例均经手术病理明确诊断,并术后随访2~5年。回顾性分析患儿的一般资料(性别、发病年龄)、临床表现(肿瘤的发病部位、是否累及皮肤和肌肉、是否伴随KMP)、治疗方法和治疗效果。
1.2 治疗方法
患儿的治疗均征得监护人书面同意。明确诊断KHE并无手术禁忌的患儿首选手术切除。如不伴有KMP,主要根据肿瘤大小和累及范围评估是否手术和手术方案;如伴随KMP,则存在手术相对禁忌,需在输注血制品或药物治疗后,评估临床无活动性出血表现、血小板计数>100×109/L、凝血功能指标处于正常范围后再行手术治疗。除手术外,应用糖皮质激素[2~3 mg/(kg·d)]、普萘洛尔[0.5~2.0 mg/(kg·d)]和长春新碱(每周剂量0.5~1.0 mg/m2)等药物治疗。
1.3 诊断方法
KHE 诊断主要依据临床表现、影像学检查和病理检查。影像学检查主要为超声、计算机断层扫描术(computertomo-graphy,CT) 和磁共振成像(magnetic resonance imaging,MRI)。KHE 典型的病理表现为苏木精-伊红(hematoxylin-eosin,H-E)染色下呈增生的血管团和梭形细胞组成,可见裂隙状血管腔。免疫组织化学染色检测CD31、CD34 和葡萄糖转运蛋白1 (glucose transporter 1,Glut1)的表达;其中CD31和CD34为KHE梭形细胞的标志物,Glut1是血管瘤的特异性标志物。
1.4 统计学分析
使用SPSS 21.0软件对数据进行统计处理,定性资料采用n(%)表示。组间比较采用Fisher确切概率法。P<0.05表示差异具有统计学意义。
2 结果
2.1 一般临床资料
患儿的临床资料见表1。19 例患儿中男性13 例(68.4%),女性6 例(31.6%)。按发病年龄,17 例(89.5%)患儿发病于1岁以内,其中12例(63.2%)为出生时即发现,1例在产前超声检查发现胎儿右腕部占位性病变并最终诊断为KHE。按肿瘤发生部位,头颈部6 例,躯干4 例,四肢9 例,均为单一病灶,未发现多个部位发病或远处转移者。19 例患儿中有13 例(68.4%)表皮受累,表现为较典型的皮肤大面积不规则紫红色、质硬、皮温增高的包块,6 例(31.6%)无明显表皮受累,表现为皮下质硬、活动度差的包块。
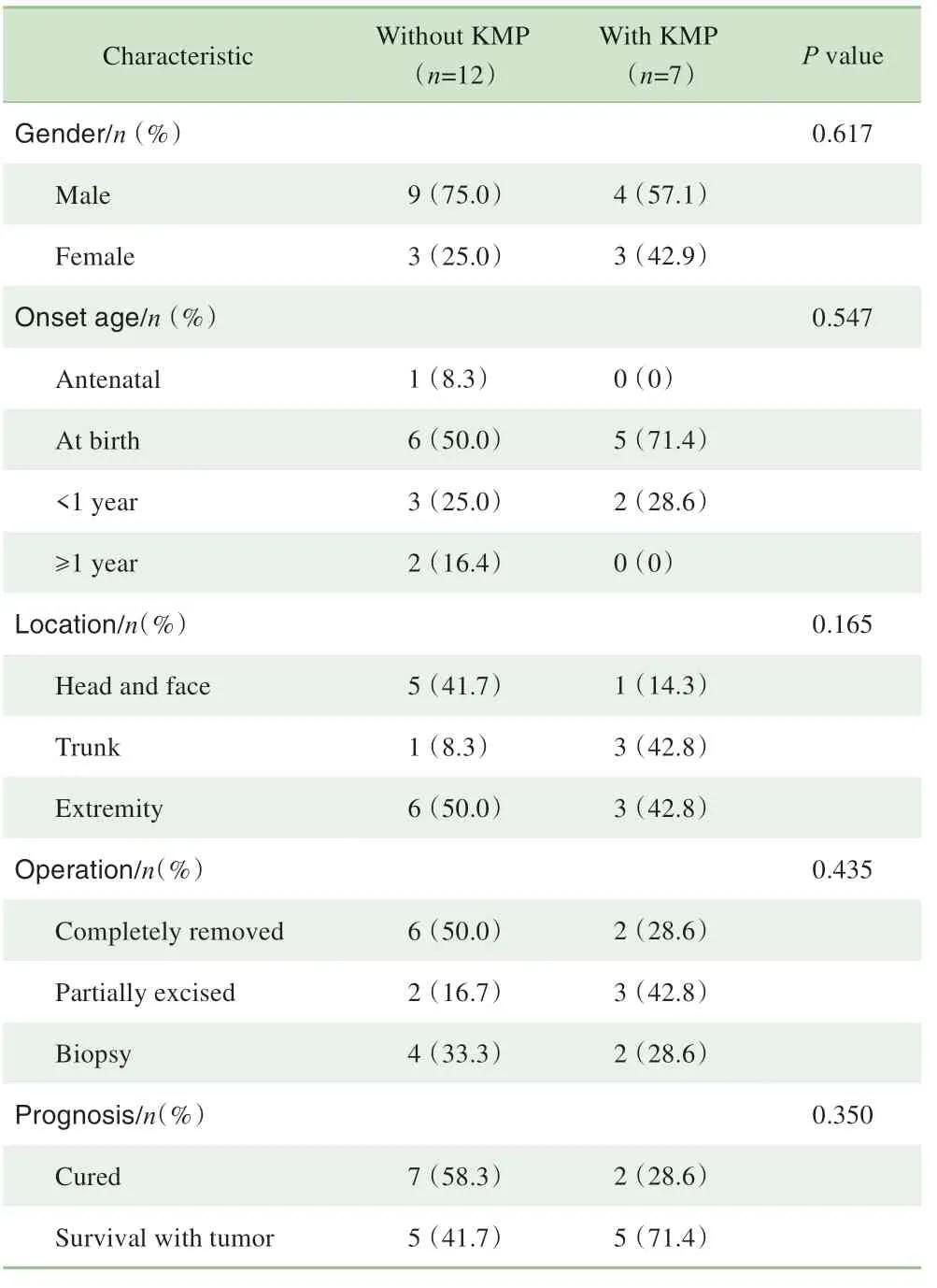
表1 KHE患儿临床资料Tab 1 Clinical data of children with KHE
2.2 影像学资料
超声在本研究病例中主要用于初步诊断和随访,还可用于产前检查,其中1例病例即为产前超声检查发现肿物。患儿的CT 平扫可见肿瘤呈低密度影、与周围组织分界不清,CT增强可见病灶明显强化,偶见粗大迂曲的供养动脉进入瘤体内(图1)。KHE在MRI的T1加权像多呈等信号或低信号影,T2 加权像信号多为不规则高信号(图2)。
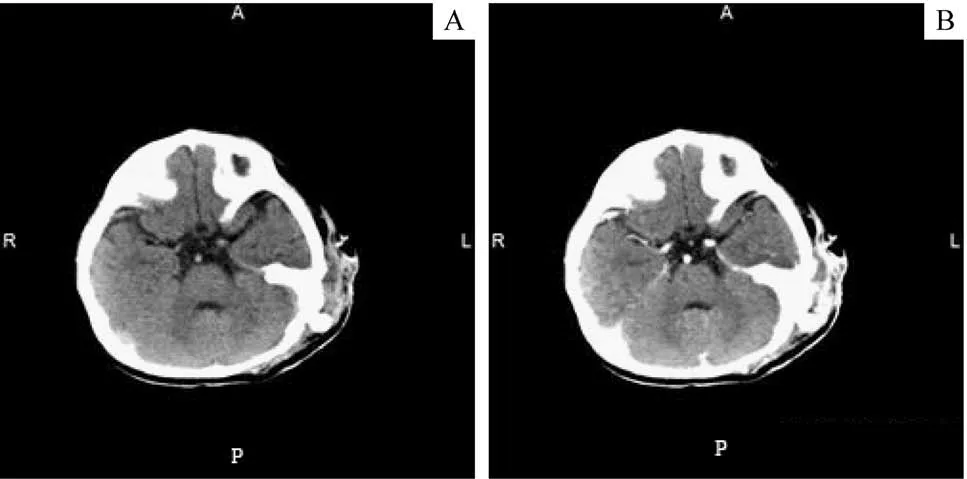
图1 KHE的CT影像Fig 1 CT image of one case of KHE
图2 KHE的MRI影像Fig 2 MRI image of one case of KHE
2.3 病理检查
所有患儿均通过外科手术取得病理资料,其中8例完全切除,5 例部分切除,6 例活检。术中发现肿瘤均呈实质性、侵袭性生长,可达深筋膜,甚至累及肌肉组织。病理大体标本为无包膜的不规则实质性肿块,镜下见肿瘤呈分叶状、浸润性生长,小叶由增生的血管团和梭形细胞组成,可见裂隙状血管腔(图3A);免疫组化染色显示CD31、CD34(图3B)阳性,Glut1阴性。
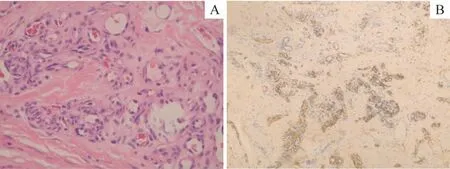
图3 KHE的病理检查结果Fig 3 Pathological examination results of KHE
2.4 KHE的KMP伴随情况
19例患儿中7例(36.8%)发病后有KMP,表现为血小板减少、纤维蛋白原降低、贫血和凝血因子消耗等。采用Fisher 确切概率法比较出现KMP 和未出现KMP 患儿的肿瘤累及情况(表2),发现2 组在肿瘤是否累及表皮上的差异无统计学意义(P=0.617),而2组在肿瘤是否累及深部肌肉上的差异存在统计学意义(P=0.017)。
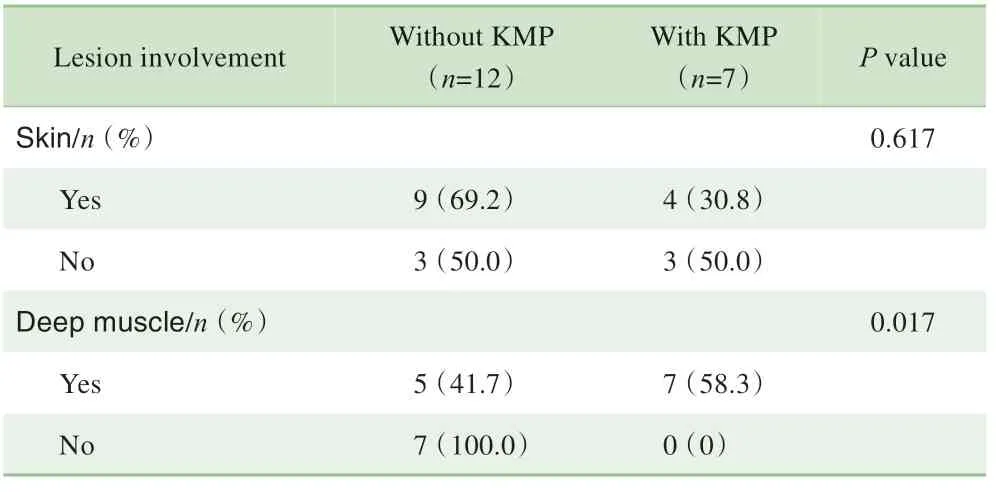
表2 KMP与肿瘤累及部位的关系Tab 2 Relationship between KMP and tumor involvement sites
2.5 治疗结果
患儿术前使用普萘洛尔治疗者7例,剂量0.5~2.0 mg/(kg·d),治疗2周肿瘤均未见明显缩小。术前口服糖皮质激素治疗者10 例,强的松剂量2~3 mg/(kg·d),疗程2 周;5 例(50.0%)肿瘤缩小,后予以手术切除;另外5 例肿瘤缩小不明显,其中2 例联合长春新碱治疗,每周剂量0.5~1.0 mg/m2,强的松剂量同前,联合治疗后肿瘤均缩小。采用Fisher确切概率法比较术前普萘洛尔和糖皮质激素治疗的有效率,两者差异存在统计学意义(P=0.044),糖皮质激素的治疗效果优于普萘洛尔。8 例手术完全切除者术后无特殊药物治疗,11 例未完全切除者(部分切除5 例,手术活检6 例)术后均予以口服糖皮质激素治疗,疗程3 个月,强的松剂量1~2 mg/(kg·d),其中2 例辅以放射治疗。术后随访2~5 年,完全切除者未见复发,手术未完全切除者均实现带瘤生存(图4)。比较无KMP组与伴有KMP组的临床结局,未发现差异有统计学意义(P=0.350)。
3 讨论
KHE 是一种罕见的脉管源性肿瘤,好发于婴幼儿。队列研究[7]表明,52.1%的KHE 患儿为出生时即发现,91.8%的患儿为1岁以内发病。本研究中,63.2%(12/19)的患儿为出生时发病,89.5%(17/19)的患儿发病于1 岁以内,结果与上述研究相近。根据KHE 的生长特点,国际脉管性疾病研究协会将其归类为“有局部侵袭性行为或交界性脉管肿瘤”[8]。本研究中19 例KHE 均为单一病灶,未发现多个部位发病或远处转移者。国际上目前尚未见远处转移的报道,但有多灶性分布的KHE案例[9]。
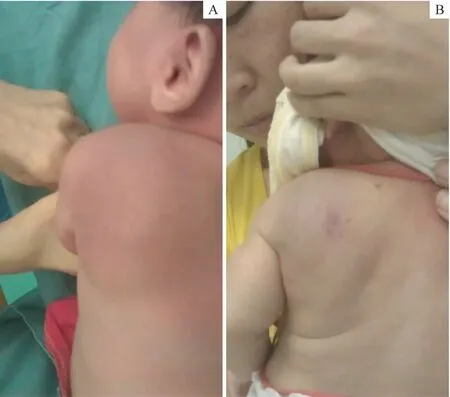
图4 患儿糖皮质激素治疗前后对比Fig 4 Clinical progression of one case with glucocorticoid treatment
在儿童脉管源性疾病中,KHE 比较罕见,临床儿科医师往往对该病不甚了解。但KHE 易出现KMP,引起严重的临床后果,因此KHE 的早期识别非常重要。本研究中大部分患儿(68.4%)有皮肤受累表现,表皮出现大面积不规则紫红色、质硬、皮温增高的包块,这种外观与常见的血管瘤明显不同,结合影像学特点[10]可给出初步诊断;小部分患儿(31.6%)无皮肤受累,表现为皮下触及质硬、活动度差的包块,这类不典型的KHE 可能会被误认为是其他类型的血管瘤[6]。组织病理诊断是诊断的金标准[11]。对于影像学证实的非典型疑似病例或深部血管肿瘤,由于KHE 具有局部侵袭性且进展迅速,故我们认为有必要在条件允许时进行活检等侵袭性诊断;但对于合并KMP的病例,由于出血的可能性,应谨慎行活检。
KHE 引起KMP 的机制仍不完全清楚。KMP 可引起肿瘤明显疼痛和继发性出血,甚至导致患儿死亡。发现与KMP 相关的危险因素有助于临床医生及时治疗,改善预后。本研究中36.8%(7/19)的KHE 患儿发病后出现KMP。对比7 例出现KMP 的患儿和12 例未出现KMP 的患儿,其在肿瘤是否累及表皮上差异无统计学意义(P=0.617),而在肿瘤是否累及深部肌肉上差异存在统计学意义(P=0.017),这提示肿瘤侵犯深部肌肉时出现KMP 的风险更大。美国学者[2]发现随着病情进展KHE 中KMP的发生率可达70%,浅表型、局限于骨组织或年长患儿发生KMP 的概率较低,而浸润型的KHE 更易出现KMP。Gruman 等[12]提出KHE 患者中肿瘤体积较大者(尤其是直径>8 cm)易出现KMP。另外有学者[7,13]发现,肿瘤的解剖位置也与KMP 的发生有关,胸腔和腹膜后的KHE中发生KMP 的比例较高,这可能与胸腔和腹膜后空间较大、肿瘤更容易扩张和浸润有关。
由于整体发病率低,病例数和治疗经验有限,KHE目前还没有基于循证医学的治疗指南。现有的方案多基于有限的回顾性研究和病例报道,采用的证据水平和推荐级别都较低[6,14]。外科手术切除是治疗KHE 的有效方法[6]。本研究中外科手术完全切除的病例也均无复发,但由于KHE 表皮病变广泛、侵袭性生长的特点,手术完全切除和组织重建存在困难,如伴随KMP,则更是存在手术禁忌,因此寻找安全而有效的非手术治疗方案非常重要。目前已报道的常用的非手术治疗方案主要包括糖皮质激素、普萘洛尔、长春新碱、西罗莫司、干扰素、放射治疗、栓塞治疗等[15-26]。
本组病例中术前使用普萘洛尔治疗者7例,剂量0.5~2.0 mg/(kg·d),肿瘤均未见明显缩小,提示肿瘤对普萘洛尔的反应性较差。其他研究也显示普萘洛尔对KHE 治疗效果不确切。Chiu 等[15]报道了11 例普萘洛尔治疗的KHE 病例,最大剂量2 mg/(kg·d),仅有4 例(36.3%)有效。另有学者[16]提出,加大普萘洛尔的剂量可增加其治疗效果,但普萘洛尔可引起心率减慢、低血糖等不良反应。我们认为从治疗周期和用药安全性考虑,加大药物剂量应审慎。虽然我们不主张大剂量普萘洛尔治疗,但作为婴幼儿血管瘤治疗的常用药物,笔者认为其在KHE 的诊治上仍然有应用价值。对于不典型的疑似病例或深部血管瘤,如无手术条件切除或活检,可以将其作为一种诊断性治疗方法。当普萘洛尔治疗无反应时需考虑KHE可能并予以进一步干预。
目前已有多个临床研究[17-19]报道全身应用糖皮质激素治疗对KHE 的有效性。本研究中术前口服糖皮质激素治疗者10 例,强的松剂量为2~3 mg/(kg·d),其中5 例肿瘤缩小后手术切除,另外5例效果不明显;术前单一使用普萘洛尔(7例)和单一使用糖皮质激素(10例)治疗的有效率差异存在统计学意义(P=0.044)。所以我们认为口服糖皮质激素治疗有效率较高,可以作为KHE 的一种一线治疗手段,尤其适用于暂时没有手术条件者的术前干预。本组病例未完全切除者术后采用口服糖皮质激素治疗后均实现长期带瘤生存,治疗的安全性较高。仍需要指出的是,糖皮质激素长期使用可能会出现不良反应,如暂时生长迟缓、感染风险增加、行为改变等[20]。但考虑到KHE 作为一种交界性肿瘤存在生长迅速、侵袭性生长、伴随KMP 等风险,在充分权衡利弊的基础上合理应用糖皮质激素仍然是值得推荐的治疗方法。为了提高治疗效果和减少上述风险,有学者建议糖皮质激素与其他药物联合使用[19]。
一些研究[14,21]也证明了长春新碱在治疗KHE中的效果并推荐使用,常用剂量为每周1.0~1.5 mg/m2或0.050~0.065 mg/kg。Peng 等[22]指出长春新碱一线治疗KHE 的总有效率为72%。本研究中因病例数有限无法对长春新碱的一线治疗效果进行评价,但我们发现单用糖皮质激素治疗无效的5 例患儿中,2 例加用长春新碱(每周0.5~1.0 mg/m2)联合治疗后肿瘤均缩小。文献[18,21]亦指出长春新碱对激素抵抗的患者仍有较好的治疗效果。考虑到长春新碱的不良反应和患儿家属的依从性,我们认为长春新碱可作为激素治疗无效的KHE 的选择性治疗手段,但需扩大样本量进一步研究。
还有一些国内外已有报道但本研究中仅个别采用或未包括的治疗方法,如放射治疗、栓塞治疗、西罗莫司、干扰素等[22-26]。不论何种治疗方法都应充分评估风险效益比,从中寻找安全有效的治疗手段。随着KHE 基础研究的深入和临床研究的开展,个体化治疗和多种方法的联合治疗可能是今后治疗的方向。
本研究中无死亡病例,长期随访显示患儿治愈或长期带瘤生存。目前报道[2-3,24,27]显示KHE 无自愈倾向,预后不佳者多为肿瘤迅速进展出现KMP,而经过积极治疗的KHE总体预后较好,因此仍需强调早期识别和早期干预。
总之,本研究初步表明:KHE作为一种罕见病,多发病于1岁以内;当肿瘤累及深部肌肉时更易出现KMP;临床表现典型者可尽早手术切除,临床表现不典型者、合并KMP或肿瘤巨大无手术条件者可尝试采用糖皮质激素治疗或联合长春新碱治疗,为手术切除或活检创造条件;普萘洛尔虽治疗效果不佳,但可作为一种诊断性治疗的手段。本研究样本量有限,未能对不同治疗方法进行充分的对照研究。今后有待于扩大样本量,开展多中心前瞻性研究,全面评估不同治疗方法的优劣,并进一步改善患儿预后。
参·考·文·献
[1] Zukerberg LR,Nickoloff BJ,Weiss SW. Kaposiform hemangioendothelioma of infancy and childhood. An aggressive neoplasm associated with Kasabach-Merritt syndrome and lymphangiomatosis[J]. Am J Surg Pathol,1993,17(4):321-328.
[2] Croteau SE, Liang MG, Kozakewich HP, et al. Kaposiform hemangioendothelioma: atypical features and risks of Kasabach-Merritt phenomenon in 107 referrals[J]. J Pediatr,2013,162(1):142-147.
[3] Kelly M. Kasabach-Merritt phenomenon[J]. Pediatr Clin North Am, 2010,57(5):1085-1089.
[4] 李冰,张茜,赵志华,等. 新生儿卡波西型血管内皮瘤伴K-M 现象一例[J].中华儿科杂志,2015,53(2):144-145.
[5] 高鹏飞,舒曼,谢钧韬,等. 卡波西型血管内皮瘤13 例临床分析[J]. 中华实用儿科临床杂志,2017,32(11):841-844.
[6] Drolet BA, Trenor CC, Brandão LR, et al. Consensus-derived practice standards plan for complicated Kaposiform hemangioendothelioma[J]. J Pediatr,2013,163(1):285-291.
[7] Ji Y, Yang K, Peng S, et al. Kaposiform haemangioendothelioma: clinical features,complications and risk factors for Kasabach-Merritt phenomenon[J].Br J Dermatol,2018,179(2):457-463.
[8] Dasgupta R, Fishman SJ. ISSVA classification[J]. Semin Pediatr Surg,2014,23(4):158-161.
[9] Nakaya T, Morita K, Kurata A, et al. Multifocal Kaposiform hemangioendothelioma in multiple visceral organs: an autopsy of 9-day-old female baby[J]. Hum Pathol,2014,45(8):1773-1777.
[10] Ryu YJ, Choi YH, Cheon JE, et al. Imaging findings of Kaposiform hemangioendothelioma in children[J]. Eur J Radiol,2017,86:198-205.
[11] Fernández Y, Bernabeu-Wittel M, García-Morillo JS. Kaposiform hemangioendothelioma[J]. Eur J Intern Med,2009,20(2):106-113.
[12] Gruman A, Liang MG, Mulliken JB, et al.Kaposiform hemangioendothelioma without Kasabach-Merritt phenomenon[J]. J Am Acad Dermatol,2005,52(4):616-622.
[13] Duan L, Renzi S, Weidman D, et al. Sirolimustreatment of an infant with intrathoracic Kaposiform hemangioendothelioma complicated by lifethreatening pleural and pericardial effusions[J]. J Pediatr Hematol Oncol,2020,42(1):74-78.
[14] Tlougan BE, Lee MT, Drolet BA, et al. Medical management of tumors associated with Kasabach-Merritt phenomenon: an expert survey[J]. J Pediatr Hematol Oncol,2013,35(8):618-622.
[15] Chiu YE,Drolet BA,Blei F,et al. Variable response to propranolol treatment of Kaposiform hemangioendothelioma,tufted angioma,and Kasabach-Merritt phenomenon[J]. Pediatr Blood Cancer,2012,59(5):934-938.
[16] Filippi L, Tamburini A, Berti E, et al. Successful propranolol treatment of a Kaposiform hemangioendothelioma apparently resistant to propranolol[J].Pediatr Blood Cancer,2016,63(7):1290-1292.
[17] Jiang RS,Hu R. Successful treatment of Kasabach-Merritt syndrome arising from Kaposiform hemangioendothelioma by systemic corticosteroid therapy and surgery[J]. Int J Clin Oncol,2012,17(5):512-516.
[18] Liu XH,Li JY,Qu XH,et al. Clinical outcomes for systemic corticosteroids versus vincristine in treating Kaposiform hemangioendothelioma and tufted angioma[J]. Medicine(Baltimore),2016,95(20):e3431.
[19] Ji Y, Chen SY, Xiang B, et al. Sirolimus for the treatment of progressive Kaposiform hemangioendothelioma: a multicenter retrospective study[J].Int J Cancer,2017,141(4):848-855.
[20] George ME, Sharma V, Jacobson J, et al. Adverse effects of systemic glucocorticosteroid therapy in infants with hemangiomas[J]. Arch Dermatol,2004,140(8):963-969.
[21] Fahrtash F, McCahon E, Arbuckle S. Successful treatment of Kaposiform hemangioendothelioma and tufted angioma with vincristine[J]. J Pediatr Hematol Oncol,2010,32(6):506-510.
[22] Peng SH,Yang KY, Xu ZC, et al. Vincristine and sirolimus in the treatment of Kaposiform haemangioendothelioma[J]. J Paediatr Child Health, 2019,55(9):1119-1124.
[23] Hartman KR, Moncur JT, Minniti CP, et al. Mediastinal Kaposiform hemangioendothelioma and Kasabach-Merritt phenomenon in an infant:treatment with interferon[J]. J Pediatr Hematol,2009,31(9):690-692.
[24] Wang Z, Yao W, Sun H, et al. Sirolimus therapy for Kaposiform hemangioendothelioma with long-term follow-up[J]. J Dermatol,2019,46(11):956-961.
[25] Malhotra Y, Yang CS, McNamara J, et al. Congenital Kaposiform hemangioendothelioma with Kasabach-Merritt phenomenon successfully treated with low-dose radiation therapy[J]. Pediatr Dermatol,2014,31(5):595-598.
[26] Wang P, Zhou W, Tao L, et al. Clinical analysis of Kasabach-Merritt syndrome in 17 neonates[J]. BMC Pediatr,2014,14:146.
[27] Schaefer BA, Wang DH, Merrow AC, et al. Long-term outcome for Kaposiform hemangioendothelioma: a report of two cases[J]. Pediatr Blood Cancer,2017,64(2):284-286.

