唾液菌群微生物与宿主血脂水平的关联分析
赵 芬,晋巧巧,苑克勇,侯秀秀,黄正蔚#,马 瑞,2#
1.上海交通大学医学院附属第九人民医院·口腔医学院牙体牙髓科,国家口腔疾病临床研究中心,上海市口腔医学重点实验室,上海市口腔医学研究所,上海200011;2.上海交通大学医学院附属第九人民医院·口腔医学院浦东分院,上海200125
脂代谢异常是指体内脂质合成、分解、消化、吸收、转运等过程发生障碍,从而导致血液和其他组织中脂类物质的质或量异常,进而影响身体机能的情况[1]。随着人们生活水平的提高和生活方式的改变,在全球范围内,脂代谢异常的发病率逐年升高,现已成为危害人体健康的一大杀手[1]。血脂紊乱作为临床上最常见的脂代谢异常状态,是包括冠状动脉粥样硬化和中风在内的多种疾病的重要危险因素[2],因此,对血脂紊乱的早期预警和个性化预防、诊治等方面的探索具有重要的临床意义。研究[3]表明以口腔菌群紊乱为主要致病因素的口腔感染性疾病(如牙周炎等)与机体的血脂水平存在关联,但口腔菌群微生物本身与宿主血脂水平的相关性鲜有研究。唾液因其具有流动性可与口腔内各个细菌粘附位点(如舌、腭、扁桃体、龈上菌斑等)相接触,故通常认为唾液菌群微生物的组成结构可代表整个口腔微生态的基本情况[4]。此外,有文献[5]报道个体的唾液菌群组成结构可在相当长的时间内保持相对稳定,加之唾液采集具有无需专业器械、技术敏感性低、无创等优点[6],现已广泛用作口腔菌群采样。目前,还未有关于唾液菌群微生物与宿主血脂水平相关性的报道,因此,本研究通过16S rDNA 测序和生物信息学分析技术探究唾液菌群微生物与血脂水平的关联,以期为下一步挖掘唾液菌群微生物作为个体脂代谢异常的个性化预警指标奠定基础。
1 对象与方法
1.1 研究对象
本研究经上海交通大学医学院附属第九人民医院伦理委员会审查批准后,在江西省南昌市进贤县进行健康普查的人群中募集志愿者114 人(男性50 人,女性64人),入组者均在采样前签署纸质版知情同意书。纳入标准:①年龄在45~60岁之间。②自述无器质性疾病。排除标准:①正在服用降脂药物者。②6个月内使用过抗生素持续5 d 或以上者。③患有感染性、传染性疾病及内分泌系统器质性病变者。④良、恶性肿瘤患者。⑤免疫功能异常患者。⑥认知功能、行为能力障碍者。⑦患有各种原因导致的口腔脓肿、口腔癌前病变及口腔癌等口腔疾病的患者。⑧长期大量吸烟者。
1.2 研究对象血脂水平的获取
收集研究对象血脂水平的检查结果,包括血清总胆固醇(total cholesterol,TCH)、三酰甘油(triacylglycerol,TAG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-Ch)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-Ch)。上述数据均经志愿者知情同意后从健康普查数据库中调取。
1.3 唾液菌群样本采集及DNA抽提、扩增
唾液菌群样本的采集按照以往文献[7]中描述的方法在研究对象清晨进食前进行。采集到的唾液菌群样本立即置于液氮罐中运输、保存,直至DNA 抽提。按照QIAamp DNA Mini Kit(Qiagen,美国)说明书中的操作流程抽提唾液菌群样本中的总DNA,随后应用NanoDrop 2000 UV-vis 分光光度计(Thermo Scientific,美国)检测所得DNA 的浓度和纯度,应用1%琼脂糖凝胶电泳检测所得DNA 的完整性。对符合检测标准的DNA 进行16S rDNA V3-V4 区 扩 增。 338F 引 物 序 列 为: 5′-ACTCCTACGGGAGGCAGCAG-3′;806R 引物序列为:5′-GGACTACHVGGGTWTCTAAT-3′。PCR 扩 增 使 用GeneAmp 9700 设备(ABI,美国)的thermocycler PCR系统进行操作,扩增条件为:95 ℃变性3 min,随后进行包括95 ℃变性30 s,55℃退火30 s 及72 ℃延伸45 s 这3 个步骤在内的27 个循环,最后于72 ℃条件下充分延伸10 min。将经上述步骤扩增所得的产物置于−20 ℃中冻存。
1.4 Illumina MiSeq PE300测序
PCR 扩增产物经AxyPrep DNA Gel Extraction Kit(Axygen Biosciences, 美 国) 纯 化 后 按 照 试 剂 盒NEBNext®Ultra ™ DNA Library Prep Kitfor Illumina®(New England Biolabs,美国)说明书中标注的流程进行建库操作,最后使用Illumina MiSeq PE300 测序平台(Illumina,美国) 进行测序。
1.5 统计学分析及生物信息学分析
使用Graphpad Prism 6 软件对研究对象的一般情况及血脂水平进行统计学分析。定量资料用±s表示,采用非配对t 检验进行分析;定性资料用n(%)表示,采用Yates连续性校正χ2检验进行分析。P<0.05 表示差异具有统计学意义。
测序所得的原始数据(raw fastq)经Trimmomatic 工具(https://kbase.us/) 进 行 质 控 后 使 用FLASH 软 件(https://ccb.jhu.edu/software/FLASH/index.shtml)进行拼接,随后按97%的序列相似性使用UPARSE软件(http://drive5. com/uparse/) 对 操 作 分 类 单 元(operational taxonomic units,OTUs)进行聚类分析,并对照SILVA数据库(https://www.arb-silva.de/)对所得OTUs 表进行物种注释。最后,采用Spearman 相关分析挖掘唾液菌群微生物中丰度前50的属与宿主血脂水平的相关关系。
2 结果
2.1 研究对象的一般情况及血脂水平统计
114 名研究对象的一般情况及血脂水平统计结果见表1。
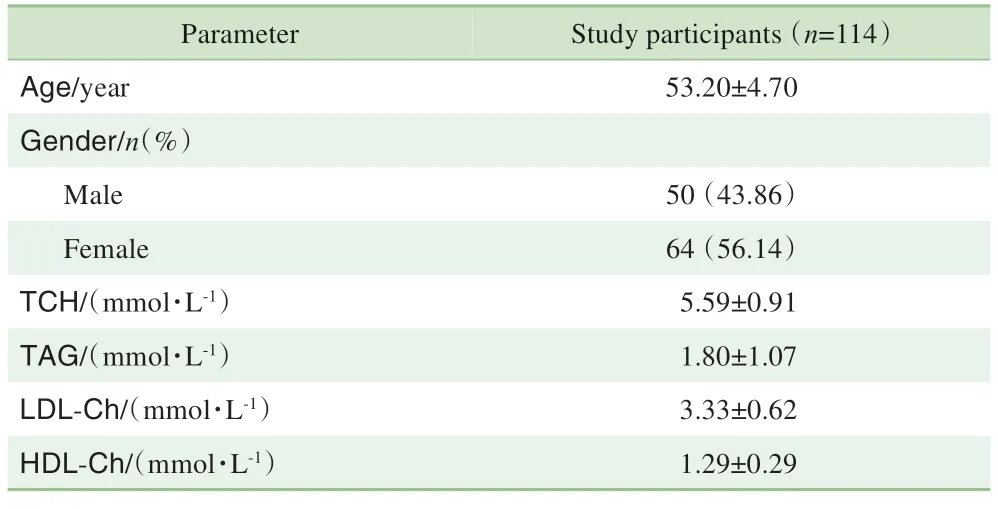
表1 研究对象的一般情况及血脂水平Table 1 Demographic and clinical characteristics of the study participants
2.2 唾液菌群测序结果的物种注释
唾液菌群样本测序后共获得4 683 576 条序列,平均每个样本的序列数为(41 084±4 740)条。聚类所得的OTUs 数为1 153,对照SILVA 数据库共注释到23 个门、43个纲、89个目、147个科和317个属。
2.3 唾液菌群微生物的物种组成分析
114个唾液菌群样本的物种丰度聚类热图如图1(门水平)和图2(属水平)所示,各个样本的微生物组成结构具有相似性,其中唾液菌群微生物门水平的优势物种为:Firmicutes、Bacteriodetes、Proteobacteria、Actinobateria、Fusobacteria 和Saccharibacteria;属水平的优势物种为:Neisseria spp.、Streptococcus spp.、Porphyromonas spp.、Veillonella spp.、 Prevotella spp.、 Fusobacterium spp.、Capnocytophaga spp.、Leptotrichia spp.、Corynebacterium spp.和Actinomyces spp.。
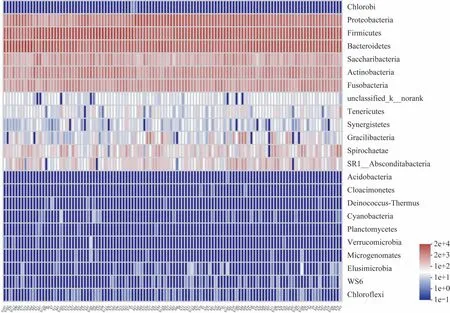
图1 门水平的物种丰度聚类热图Fig 1 Community heat map at phylum level
2.4 唾液菌群微生物与宿主血脂水平的关联分析
Spearman 相关分析显示在唾液菌群微生物丰度前50的属中,Neisseria spp.的丰度与宿主血清TCH、TAG 和LDL-Ch 成负相关;Gemella spp.的丰度与宿主血清TCH、LDL-Ch 水平呈正相关;与宿主血清HDL-Ch 水平成负相关的属有Comamonas spp.,Filifactor spp.和Parvimonas spp.(图3)。
3 讨论
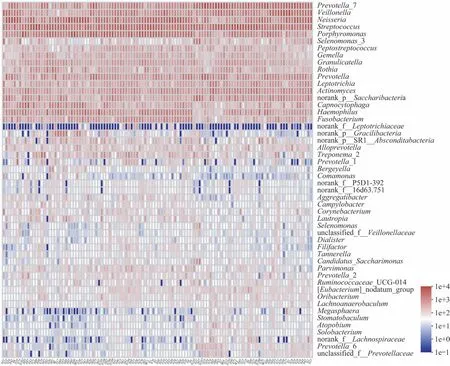
图2 属水平的物种丰度聚类热图Fig 2 Community heat map at genus level
随着人类微生物组计划(The Human Microbiome Project,HMP)第一阶段和第二阶段的顺利完成[8],人们对人体微生物的认识越来越深入。目前认为人体微生物可参与调节机体物质代谢、促进营养吸收,调控免疫机能等生理过程,并与多种系统性和全身疾病的发生发展存在联系[9]。口腔作为人体内仅次于肠道的第二大菌库,其菌群与阿尔茨海默症、动脉粥样硬化、风湿性关节炎、肝硬化、炎症性肠病等多种疾病密切相关[10]。此外,亦有研究表明,口腔菌群与“人体第二基因组”肠道菌群存在千丝万缕的联系:Arimatsu 等[11]报道口服牙龈卟啉单胞菌可显著改变肠道菌群中厚壁菌门与拟杆菌门的比率(Fimicutes/Bacteroidetes ratio,评估肠道菌群健康状况的重要指标);Li 等[12]研究发现,口腔菌群微生物可以克服物理和化学屏障,在无菌小鼠的肠道内定植。以上证据表明口腔菌群可通过影响肠道菌群的结构来与机体的健康状态发生联系,而与肠道菌群相比,口腔菌群具有采样更便捷、干预手段更直接等优势[13],故开发口腔菌群来替代肠道菌群进行人体微生物与系统健康相关的研究前景广阔。唾液为口腔菌群常见的采样形式,其与糖尿病、代谢综合征、肥胖等机体代谢疾病密切相关[14-16],故在一定程度上可反映机体的代谢状态,但唾液菌群微生物与宿主血脂水平的关联尚未被证实。在本研究中,我们发现唾液菌群微生物与宿主血脂水平存在关联,丰富了既往对唾液菌群与宿主代谢状态之间联系的认识,为唾液菌群微生物在脂代谢异常个体的早期预警和个性化精准诊疗中的进一步研究奠定了基础。
人体微生物的组成结构可受遗传基因、生活环境、饮食结构等多种因素影响[17],但某个部位的优势菌在人群中通常保持相对稳定,这些在某个部位出现频率和丰度均较高且随着时间推移变化较小的物种被称为这个部位的核心菌群[18]。有研究[14-16]报道,唾液的核心菌群在门水平主要为Firmicutes、Bacteriodetes、Proteobacteria、Actinobateria、Fusobacteria 和Saccharibacteria;在属水平主要为Neisseria spp.、Streptococcus spp.、Porphyromonas spp.、Veillonella spp.、Prevotella spp.、Fusobacterium spp.、Capnocytophaga spp.、Leptotrichia spp.、Corynebacterium spp.、Actinomyces spp.。以上报道与本研究的结果相符(图1~2)。这表明虽然唾液菌群微生物的组成结构存在个体差异,但其核心菌群在人群中具有相对稳定性,这种特异性及稳定性赋予了唾液菌群微生物作为生物标志物用于宿主血脂水平与脂代谢状态研究的条件。
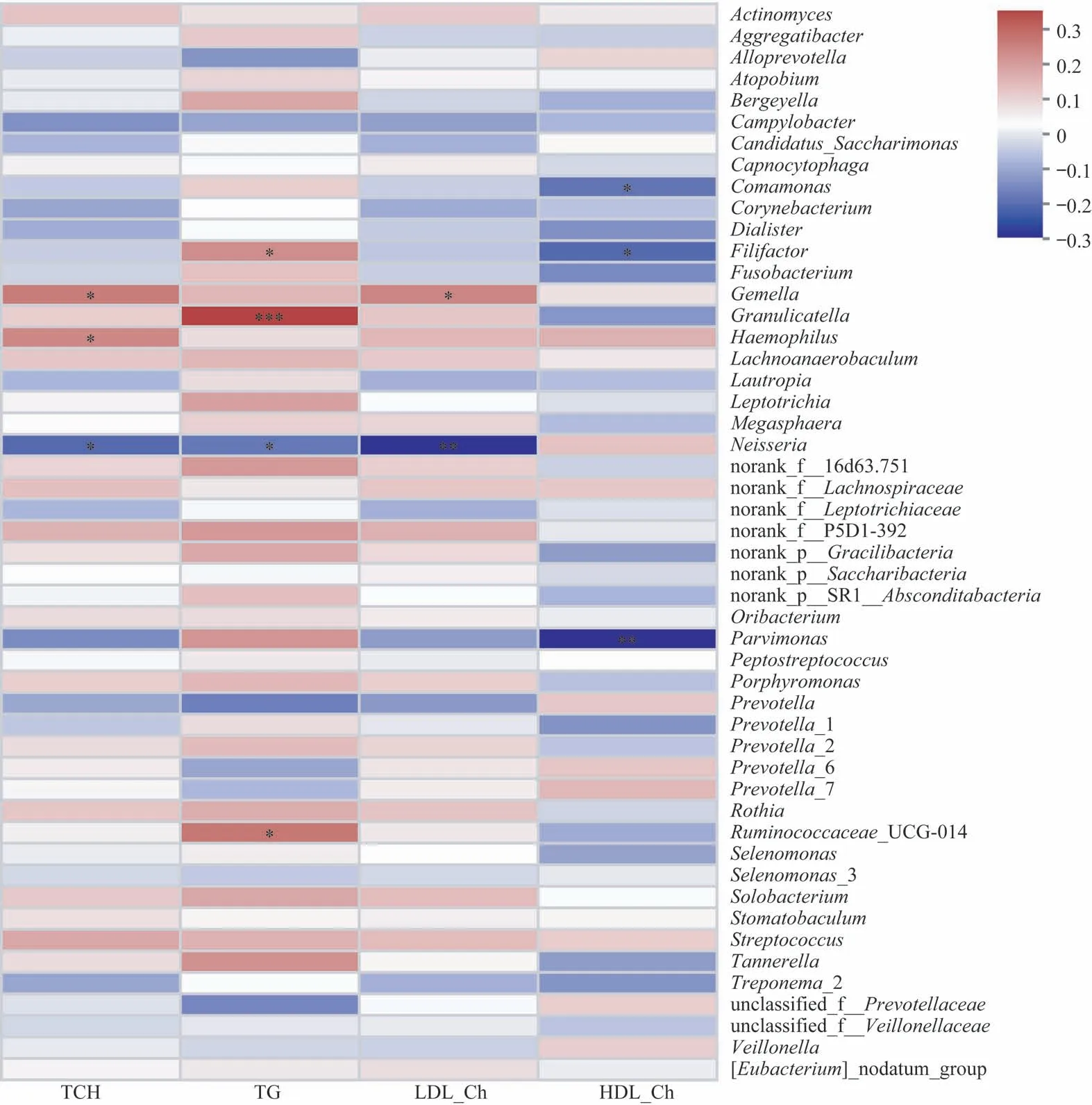
图3 唾液菌群微生物中丰度前50的属与宿主血脂水平的Spearman相关分析热图。Fig 3 Heatmap of Spearman correlation analysis between the top 50 abundant genera of salivary microbiome and the blood lipid levels of hosts
目前,血脂紊乱已成为困扰人们的一大健康问题。在常用的血脂监测指标中,血清TCH、TAG 和LDL-Ch异常升高通常意味着机体存在脂代谢紊乱的情况;而HDL-Ch可通过胆固醇的逆向转运、抗氧化、抗炎等机制实现抗动脉粥样硬化作用,血清中HDL-Ch的含量与患心血管病的风险成负相关[19]。在本研究中,唾液菌群Neisseria spp.的丰度与血清TCH、TAG 和LDL-Ch水平均成负相关,这表明唾液菌群中Neisseria spp.的丰度升高预示着相对健康的血脂状态,这与以往研究[20-21]的结果相符:与牙周病、糖尿病等疾病状态相比,Neisseria spp.的丰度在健康状态下更高。Gemella spp.为革兰阳性、兼性厌氧菌,一般认为其与感染性心内膜炎有关[22],亦有文献[23-24]报道唾液菌群中Gemella spp.的丰度升高与口腔扁平苔藓、炎症性肠病等多种炎症性、免疫性疾病状态相关。在本研究中,Gemella spp.的丰度与宿主血清TCH、LDL-Ch 水平呈正相关,表明Gemella spp.可能为与血脂紊乱状态相关的唾液菌群标志物。与宿主血清HDL-Ch 水平成负相关的3 个属(Comamonas spp.,Filifactor spp.和Parvimonas spp.)在慢性牙周炎、结直肠癌等疾病状态下的唾液菌群中亦表达上调[25-26],提示这3个菌属与机体的多种疾病状态相关。以上结果表明,血脂紊乱状态下,唾液菌群中与免疫性、炎症性疾病相关的细菌丰度增高,而与健康状态相关的细菌丰度降低。其中,Neisseria spp.和Gemella spp.与多个血脂指标存在指向性一致的相关关系,因此,可进一步探究其作为宿主脂代谢紊乱相关生物标志物的可行性。
本研究结果表明,在人群中唾液菌群微生物的构成具有相对稳定性且与宿主血脂水平存在关联。在唾液菌群微生物丰度前50 的属中,Neisseria spp.的丰度与宿主血清TCH、TAG 和LDL-Ch 水平成负相关;Gemella spp.的丰度与宿主血清TCH、LDL-Ch水平呈正相关;与宿主血清HDL-Ch 水平成负相关的属有Comamonas spp.,Filifactor spp.和Parvimonas spp.。因此,可进一步挖掘唾液菌群微生物作为生物标志物用于脂代谢异常个体的早期预警和个性化精准诊疗,但此生物标志物的可靠性尚需在更大样本量的人群和进一步的体内外实验中验证。
参·考·文·献
[1] Bjornstad P, Eckel RH. Pathogenesis of lipid disorders in insulin resistance:a brief review[J]. Curr Diab Rep,2018,18(12):127.
[2] Kopin L, Lowenstein C. Dyslipidemia[J]. Ann Intern Med,2017, 167(11):81-96.
[3] Jaramillo A, Lafaurie GI, Millán LV, et al. Association between periodontal disease and plasma levels of cholesterol and triglycerides[J]. Colomb Med(Cali),2013,44(2):80-86.
[4] Segata N, Haake SK, Mannon P, et al. Composition of the adult digestive tract bacterial microbiome based on seven mouth surfaces,tonsils,throat and stool samples[J]. Genome Biol,2012,13(6):R42.
[5] Wang J, Jia Z, Zhang B, et al. Tracing the accumulation of in vivo human oral microbiota elucidates microbial community dynamics at the gateway to the GI tract[J]. Gut,2020,69(7):1355-1356.
[6] Kodukula K, Faller DV, Harpp DN, et al. Gut microbiota and salivary diagnostics: the mouth is salivating to tell us something[J]. Biores Open Access,2017,6(1):123-132.
[7] Navazesh M. Methods for collecting saliva [J]. Ann N Y Acad Sci. 1993,694:72-77.
[8] Integrative HMP (iHMP) Research Network Consortium. The Integrative Human Microbiome Project[J]. Nature,2019,569(7758):641-648.
[9] Dominguez-Bello MG, Godoy-Vitorino F, Knight R, et al. Role of the microbiome in human development[J]. Gut,2019,68(6):1108-1114.
[10] Gao L,Xu T,Huang G,et al. Oral microbiomes:more and more importance in oral cavity and whole body[J]. Protein Cell,2018,9(5):488-500.
[11] Arimatsu K, Yamada H, Miyazawa H, et al. Oral pathobiont induces systemic inflammation and metabolic changes associated with alteration of gut microbiota[J]. Sci Rep,2014,4:4828.
[12] Li B, Ge Y, Cheng L, et al. Oral bacteria colonize and compete with gut microbiota in gnotobiotic mice[J]. Int J Oral Sci,2019,11(1):10.
[13] Zhang X,Zhang D,Jia H,et al. The oral and gut microbiomes are perturbed in rheumatoid arthritis and partly normalized after treatment[J]. Nat Med,2015,21(8):895-905.
[14] Sabharwal A,Ganley K,Miecznikowski JC,et al. The salivary microbiome of diabetic and non-diabetic adults with periodontal disease[J]. J Periodontol,2019,90(1):26-34.
[15] Troisi J, Belmonte F, Bisogno A, et al. Metabolomic salivary signature of pediatric obesity related liver disease and metabolic syndrome[J]. Nutrients,2019,11(2):274.
[16] 吴宇佳,迟晓培,陈峰,等. 肥胖者唾液微生物宏基因组学特点[J]. 北京大学学报(医学版),2018,50(1):5-12.
[17] Zaura E, Keijser BJ, Huse SM, et al. Defining the healthy "core microbiome" of oral microbial communities[J]. BMC Microbiol, 2009,9:259.
[18] Hu YJ, Shao ZY,Wang Q, et al. Exploring the dynamic core microbiome of plaque microbiota during head-and-neck radiotherapy using pyrosequencing[J]. PLoS One,2013,8(2):e56343.
[19] Kalita S, Khandelwal S, Madan J, et al. Almonds and cardiovascular health:areview[J]. Nutrients,2018,10(4):468.
[20] Hintao J, Teanpaisan R, Chongsuvivatwong V, et al. The microbiological profiles of saliva, supragingival and subgingival plaque and dental caries in adults with and without type 2 diabetes mellitus[J]. Oral Microbiol Immunol,2007,22(3):175-181.
[21] Meuric V, Le Gall-David S, Boyer E, et al. Signature of microbial dysbiosis in periodontitis[J]. Appl Environ Microbiol,2017,83(14):e00462-17.
[22] Shinha T. Endocarditis due to Gemellamorbillorum[J]. Intern Med,2017,56(13):1751.
[23] Wang X,Zhao Z,Tang N,et al. Microbial community analysis of saliva and biopsies in patients with oral lichen planus[J]. Front Microbiol,2020,11:629.
[24] Rengarajan S, Vivio EE, Parkes M, et al. Dynamic immunoglobulin responses to gut bacteria during inflammatory bowel disease[J]. Gut Microbes,2020,11(3):405-420.
[25] Cao Y, Qiao M, Tian Z, et al. Comparative analyses of subgingival microbiome in chronic periodontitis patients with and without IgA nephropathy by high throughput 16S rRNA sequencing[J]. Cell PhysiolBiochem,2018,47(2):774-783.
[26] Kwong TNY, Wang X, Nakatsu G, et al. Association between bacteremia from specific microbes and subsequent diagnosis of colorectal cancer[J].Gastroenterology,2018,155(2):383-390.e8.

