UPLC-MS/MS法同时检测食品中3 种主要牛奶过敏原
宁亚维,刘 茁,杨 正,马俊美,范素芳,李 强,*,张 岩,*
(1.河北科技大学食品与生物学院,河北 石家庄 050018;2.河北省食品检验研究院,河北 石家庄 050000)
近年来,食物过敏在世界范围内迅速增加,已经成为一个备受关注的国际公共卫生问题[1]。牛奶过敏是常见的食物过敏之一,发病率在人群中分布广泛,约0.3%~7.5%[2]。尤其是2 岁以下儿童发病率最高,这可能与婴幼儿长期接触以牛乳为原料的配方奶粉有关[3-4]。而牛奶营养丰富是食品加工中常用的原辅料,不同食品间共用生产线的不充分清洁会增加交叉接触的可能性,增大过敏人群的暴露风险。对此许多国家已经制定了食品过敏原强制标识法规,以保护消费者免受食品过敏侵害[5-7],某些特定产品中已经有“无牛奶”标签[4,8]。而目前我国过敏原研究尚处于初始阶段,仅在GB 7718—2011《预包装食品标签通则》和GB/T 23779—2009《预包装食品中的致敏原成分》中推荐企业自行标识以提醒消费者[9-11]。因此,为降低牛奶过敏消费者的健康隐患,促进过敏原标识规范化和保障我国加工食品的出口贸易,建立可靠、灵敏的检测方法十分必要。
目前,用于牛奶过敏原检测技术主要有酶联免疫(enzyme-linked immunosorbent assay,ELISA)[12-14]法、聚合酶链式反应(polymerase chain reaction,PCR)[15-17]法、环介导等温扩增(loop-mediated isothermal amplification,LAMP)[18-20]法和液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS)[5,21-22]法。目前,ELISA方法最为成熟,但由于各式各样的食品热加工手段会破坏目标蛋白质的空间结构,使目标致敏蛋白不能被特异性抗体识别,从而导致假阴性结果[23]。而PCR法是对致敏蛋白的DNA进行间接检测,不受加工方式的影响,但核酸提取过程繁琐,易发生污染出现假阳性。相比于传统的PCR法,新兴的LAMP法不仅简化了复杂的操作流程,还可以达到更高的灵敏度,但仍面临扩增产物易污染的问题[24-25],且不能对复杂基质中的多种过敏原进行高通量检测。近年来,LC-MS法被广泛应用于牛奶过敏原的检测[4,26-28],可以有效解决ELISA的假阴性及PCR的假阳性弊端,如Lamberti等[4]采用质谱法检测饼干中的αs1-酪蛋白,定量限(limit of quantitation,LOQ)为4 μg/g;Lai Shiyun等[27]采用超高效液相色谱-串联质谱(ultra-high performance liquid chromatographytandem mass spectrometry,UPLC-MS/MS)法检测奶制品中的α-乳白蛋白,LOQ为50 μg/g;Zhang Jingshun等[28]采用UPLC-MS/MS法检测奶制品中的乳铁蛋白,LOQ为3 μg/g。但其忽略了单一致敏蛋白在加工过程中热变性或定量限等问题造成的假阴性。
基于质谱技术高通量检测的优点,本实验拟筛选牛奶过敏原β-乳球蛋白、αs1-酪蛋白和αs2-酪蛋白的特征肽段,开发一种UPLC-MS/MS法对食品中的β-乳球蛋白、αs1-酪蛋白和αs2-酪蛋白进行同时检测,以期为食品中牛奶过敏原的标签监管和准确定量提供技术支持。
1 材料与方法
1.1 材料与试剂
面粉、配料中含牛奶和不含牛奶的8 种样品 市售。
TPEVDDEALEK(96.69%)、VLVLDTDYK(97.26%)、YLGYLEQLLR(98.80%)、HQGLPQEVLNENLLR(95.83%)、FFVAPFPEVFGK(97.33%)、TVYQHQK(96.99%)、FALPQYLK(95.68%)、NAVPITPTLNR(99.91%) 上海强耀生物科技有限公司;β-乳球蛋白(90%,来源于牛乳)、α-酪蛋白(70%,来源于牛乳)、二硫苏糖醇(dithiothreitol,DTT)、碘乙酰胺(iodoacetamide,IAA)、碳酸氢铵、甲酸(均为质谱纯) 美国Sigma-Aldrich公司;正己烷、乙腈(均为质谱纯) 美国Fisher Scientific公司;TPCK-胰蛋白酶(生物级) 美国AB SCIEX公司;实验室用水均为Watsons蒸馏水。
1.2 仪器与设备
超滤离心管(0.5 mL,10 kDa)、Easy-nLC 1000-Q Exactive纳升液相色谱-串联轨道阱高分辨质谱 美国Thermo Scientific公司;UPLC-Triple Quad 6500+超高效液相色谱-串联三重四极杆质谱(配电喷雾离子源及MultiQuant 3.0.1数据处理系统) 美国AB SCIEX公司;C18毛细富集柱(100 μm×4 cm,5 μm,120 Å)、C18毛细分析柱(75 μm×15 cm,5 μm,120 Å) 北京乐润峰科技有限公司;Proteonavi色谱柱(2.0 mm×150 mm,5 μm) 日本Shiseido公司。
1.3 方法
1.3.1 储备液的配制
精密称取TPEVDDEALEK、VLVLDTDYK、YLGYLEQLLR、HQGLPQEVLNENLLR、FFVAPFPEVFGK、TVYQHQK、FALPQYLK、NAVPITPTLNR各1 mg于10 mL容量瓶中,用水溶解并定容,配制成100 μg/mL的特征肽段混标储备液。再分别称取22.22 mgβ-乳球蛋白、28.57 mgα-酪蛋白标准品于10 mL容量瓶中,用水溶解并定容,配制成2 mg/mL的标准蛋白储备液。其中α-酪蛋白包括αs1-酪蛋白和αs2-酪蛋白,且其含量比为4∶1。
1.3.2 样品前处理
采用正己烷对富含脂肪的食品基质进行脱脂处理,取0.1 g样品用蒸馏水稀释至10 mL,取500 μL样品稀释液加入10 μL 500 mmol/L DTT溶液混匀,于70 ℃水浴反应30 min,然后加入30 μL 500 mmol/L IAA溶液于室温下避光静置30 min。向上述混合液中加入420 μL 500 mmol/L NH4HCO3溶液和30 μL 200 μg/mL TPCK-胰蛋白酶溶液混匀,于37 ℃水浴振摇酶解过夜,最后加入10 μL甲酸混匀以终止反应。酶解液于13 000×g离心10 min,取500 μL上清液于10 kDa超滤管中,14 000×g离心20 min,再取200 μL滤液于样品瓶中待测。
1.3.3 设备参数
1.3.3.1 Easy-nLC 1000-Q Exactive测定条件
色谱条件:富集柱:C18毛细色谱柱(100 μm×4 cm,5 μm,120 Å);分析柱:C18毛细色谱柱(75 μm×15 cm,5 μm,120 Å);流动相A为0.1%甲酸,流动相B为乙腈;洗脱程序:0~3 min,97%~93% A,3%~7% B;3~38 min,93%~78% A,7%~22% B;38~48 min,78%~65% A,22%~35% B;48~50 min,65%~10% A,35%~90% B;50~60 min,10% A,90% B;流速300 nL/min;进样体积2 μL。
质谱条件:电离源为电喷雾(正离子)离子源;扫描模式为Full MS/dd-MS2;全扫描分辨率70 000,AGC target为1×106,扫描范围m/z350~1 800;dd-MS2分辨率17 500,AGC target为1×105,隔离窗口为m/z2.0,Fixed first mass为m/z120.0,碰撞能为27 eV。Thermo Proteome Discoverer 1.4软件相关参数:蛋白数据库(bovine)从Uniprot数据库进行下载(http://www.uniprot.org);MS1质量范围350~5 000 Da;最小峰数为1;水解酶为胰蛋白酶;允许漏切位点最多为2;肽段长度6~144;母离子质量误差±10-6Da;碎片离子质量误差±0.02 Da。
1.3.3.2 UPLC-Triple Quad 6500+测定条件
色谱条件:色谱柱:Proteonavi(2.0 mm×150 mm,5 μm);柱温40 ℃;流动相A为0.1%甲酸,流动相B为乙腈;洗脱程序:0~2 min,90% A,10% B;2~5 min,90%~80% A,10%~20% B;5~9 min,80%~78% A,20%~22% B;9~13 min,78%~70% A,22%~30% B;13~18 min,70%~25% A,30%~75% B;18~22 min,25% A,75% B;22~22.01 min,25%~90% A,75%~10% B;22.01~25 min,90% A,10% B;流速300 μL/min;进样体积2 μL。
质谱条件:电喷雾离子源(正离子);多反应监测(multiple reaction monitoring,MRM);离子化电压5 500 V;雾化气压力50 psi;辅助气压力55 psi;气帘气压力30 psi;离子源温度500 ℃。
1.3.4 方法学验证
1.3.4.1 线性、LOD和LOQ
选择面粉作为空白基质,向其中加入标准蛋白储备液配制标准曲线,使其理论蛋白系列质量浓度为1、2、5、10、20、50、100、200、500、1 000、2 000、5 000、10 000、20 000、30 000 ng/mL。以特征肽段的色谱峰面积为纵坐标(Y)、以各组分的质量浓度为横坐标(X)得到线性回归方程。在空白基质中,添加标准蛋白储备液,获得定量特征肽段信噪比为3时,作为其对应过敏原蛋白的检出限(limit of detection,LOD);定量特征肽段信噪比为10时,作为其对应过敏原蛋白的LOQ,以μg/g表示。
1.3.4.2 基质效应
分别精密移取一定量的标准蛋白储备液,用水稀释配制,使其理论蛋白系列质量浓度分别为1、2、5、10、20、50、100、200、500、1 000、2 000、5 000、10 000、20 000、30 000 ng/mL。
基质效应按下式计算:

式中:slopematrix为空白基质标准曲线的斜率;slopestandard为水溶剂标准曲线的斜率。
1.3.4.3 加标回收率与精密度
向空白基质中添加标准蛋白储备液进行回收率测定,β-乳球蛋白、αs1-酪蛋白和αs2-酪蛋白的具体添加量为25、100、500、5 000 ng/mL,每个质量浓度设置6 个平行实验,计算相对标准偏差(relative standard deviation,RSD)以评估方法精密度。为排除基质对3 种过敏原蛋白定量产生的影响,标准曲线均采用添加标准蛋白的空白基质酶解液进行配制。
1.4 数据统计及图表绘制
回归方程及相关系数采用MultiQuant 3.0.1数据处理系统计算得出;色谱图即为Analyst软件原始提取离子流图;采用Excel进行数据计算及分析。
2 结果与分析
2.1 特征肽段的筛选
牛奶中包括3.5%的蛋白质,主要分为两大类:约占总蛋白质80%的酪蛋白和占20%的乳清蛋白[21],其中含量丰富的α-酪蛋白(αs1-酪蛋白和αs2-酪蛋白)和β-乳球蛋白被认为牛奶的主要过敏原成分[24,29]。且研究数据表明,IgE介导的牛奶过敏中60%的病人是对β-乳球蛋白过敏[30],因此本实验选择β-乳球蛋白、αs1-酪蛋白和αs2-酪蛋白作为牛奶过敏原检测的研究对象,其氨基酸序列见图1。

图1 β-乳球蛋白(A)、αs1-酪蛋白(B)和αs2-酪蛋白(C)氨基酸序列Fig. 1 Amino acid sequences of β-lactoglobulin (A), αs1-casein (B) and αs2-casein (C)
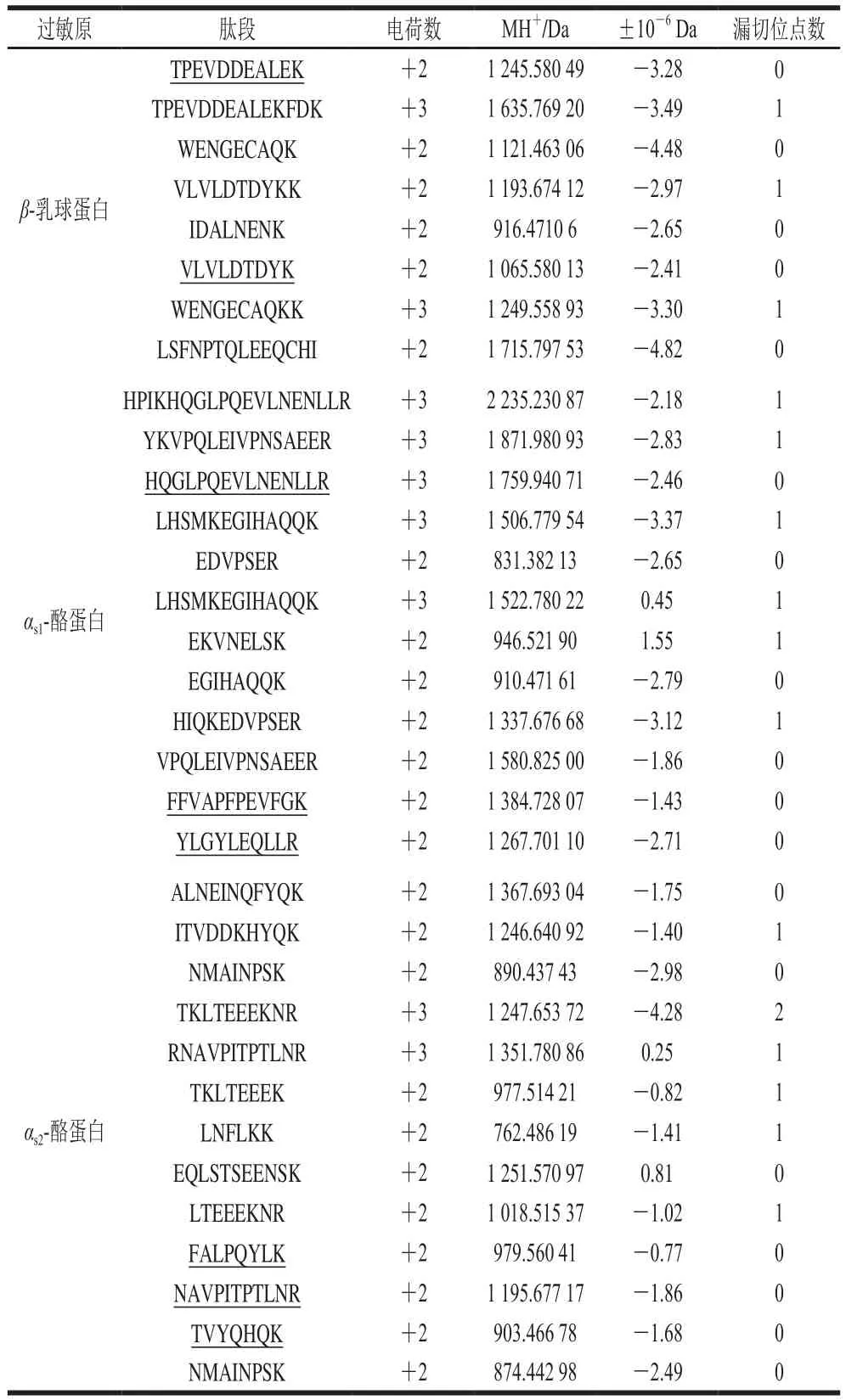
表1 牛奶过敏原鉴定所得全部肽段信息Table 1 Information about all peptides derived from milk allergens
β-乳球蛋白、αs1-酪蛋白和αs2-酪蛋白标准品经胰蛋白酶酶解后,采用Easy-nLC 1000-Q Exactive进行分析。结合Uniprot数据库,将所得谱图信息利用Thermo Proteome Discoverer 1.4软件鉴定匹配。经数据分析后,3 种标准蛋白酶解液所得肽段信息见表1,β-乳球蛋白8 条肽段,肽段覆盖率为40.4%;αs1-酪蛋白12 条,肽段覆盖率为51.9%;αs2-酪蛋白13 条肽段,肽段覆盖率为56.3%。然后根据以下特征肽段的筛选原则筛选特征肽段:肽段长度以7~20 个氨基酸为宜,肽段长度少于7 个氨基酸很难满足其特异性,而长度过长不仅在实验过程中易于断裂且合成价格昂贵[26];不含漏切或错切的酶切位点,以保证肽段良好的可重复性;最好不含甲硫氨酸,因其易被氧化修饰[28];进行定性定量分析时,具有较好的灵敏度和峰形[31-33];经BLAST搜索后具有特异性。最终筛得8 条特征肽段,他们分别是β-乳球蛋白的VLVLDTDYK和TPEVDDEALEK;αs1-酪蛋白的FFVAPFPEVFGK、HQGLPQEVLNENLLR和YLGYLEQLLR;αs2-酪蛋白的NAVPITPTLNR、FALPQYLK和TVYQHQK。
2.2 反应监测参数优化
将8 条特征肽段混标储备液用水稀释至5 000 ng/mL,通过蠕动泵以5 μL/min的速率直接注入Triple Quad 6500+质谱仪中,通过全扫描模式确定特征肽段的前体离子精确质量数,再通过产物离子扫描从产物离子中选择2 个稳定且灵敏度高的特征子离子,以建立MRM离子对。在MRM模式下优化各特征肽段的去簇电压和碰撞能,见表2、图2。根据各肽段灵敏度的高低,分别将VLVLDTDYK、FFVAPFPEVFGK和NAVPITPTLNR作为β-乳球蛋白、αs1-酪蛋白和αs2-酪蛋白的定量肽段。
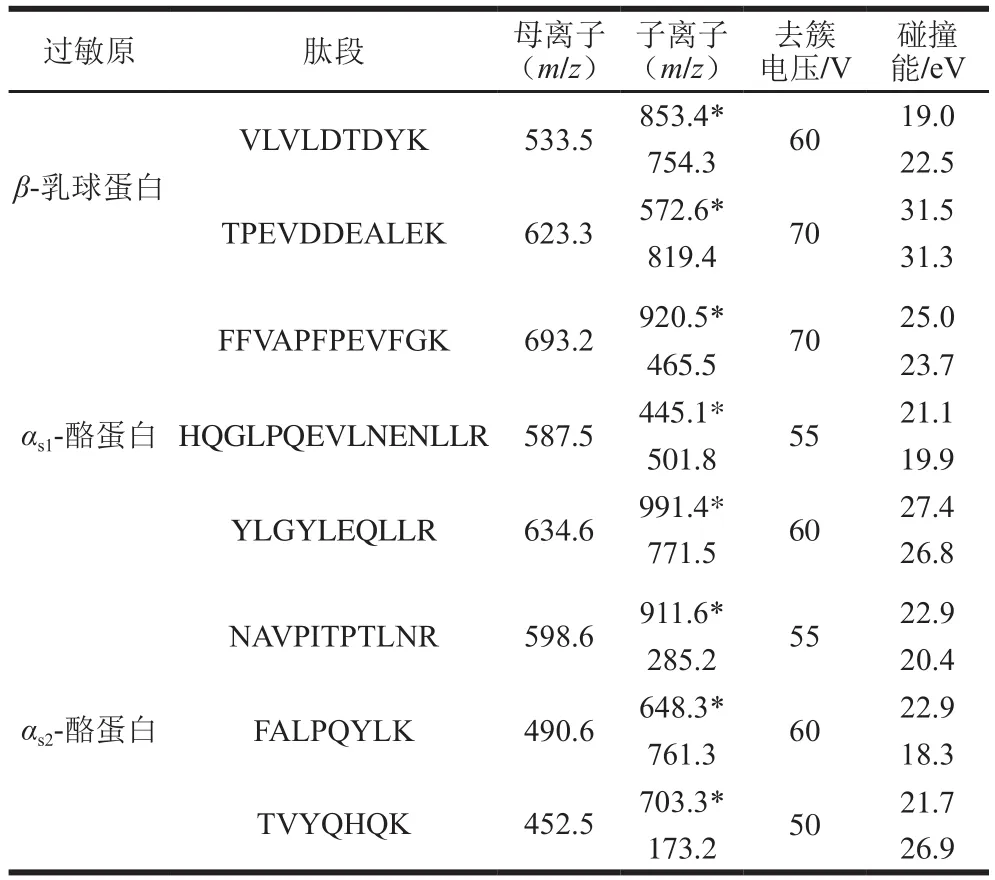
表2 牛奶过敏原特征肽段的MRM参数Table 2 MRM parameters of signature peptides derived from milk allergens
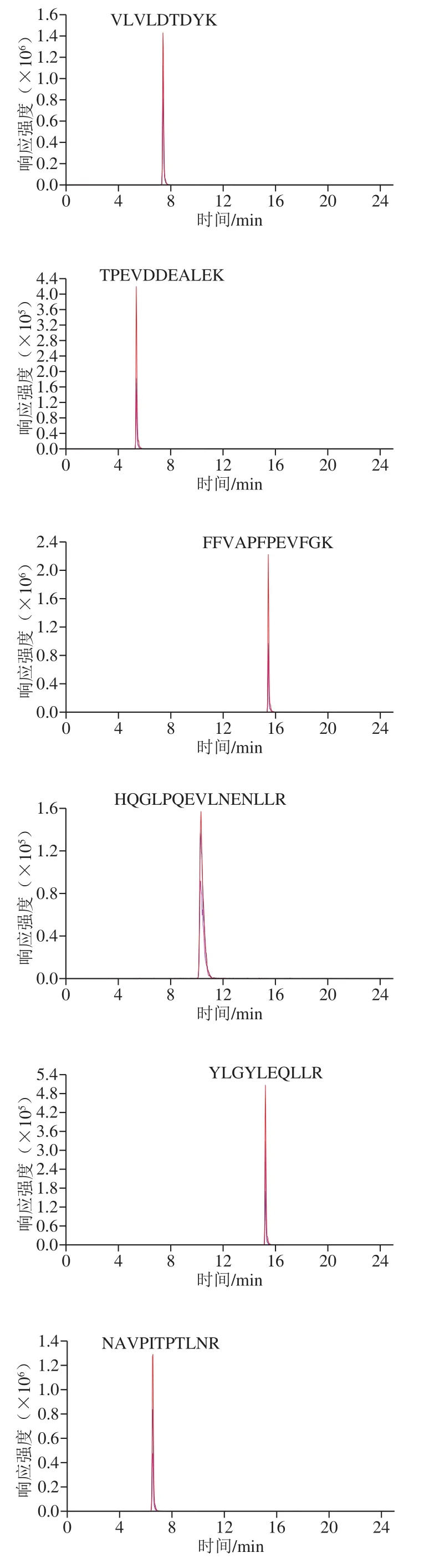

图2 牛奶过敏原8 条特征肽段的色谱图Fig. 2 Chromatograms of eight signature peptides derived from milk allergens
2.3 方法学验证
2.3.1 线性关系和基质效应
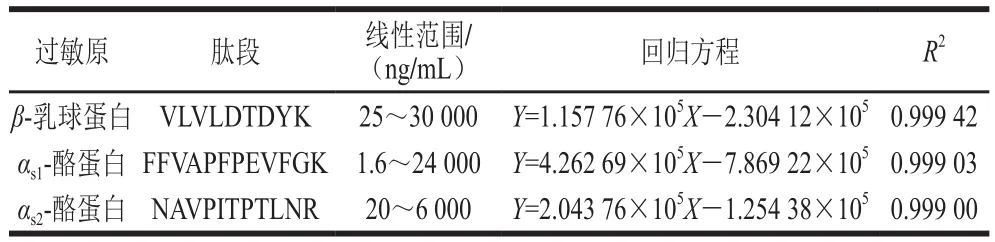
表3 牛奶过敏原定量特征肽段的线性关系Table 3 Linear calibration equations for quantitative analysis of signature peptides derived from milk allergens
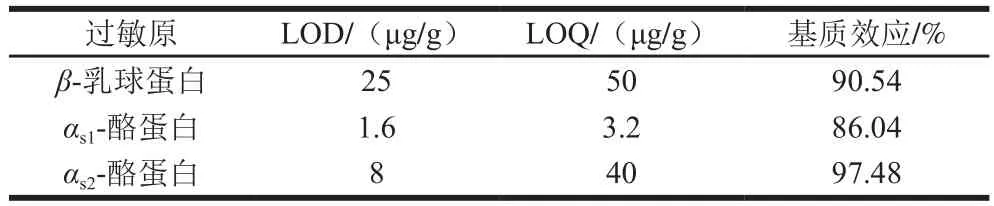
表4 3 种牛奶过敏原的LOD、LOQ和基质效应Table 4 LODs, LOQs and matrix effects of three milk allergens
牛奶过敏原β-乳球蛋白、αs1-酪蛋白和αs2-酪蛋白在面粉基质中的线性关系见表3,其在1.6~30 000 ng/mL的线性范围内线性良好,R2均大于0.999。由表4可知,β-乳球蛋白、αs1-酪蛋白和αs2-酪蛋白LOQ分别为50、3.2 μg/g和40 μg/g。此外,由表4可得β-乳球蛋白、αs1-酪蛋白和αs2-酪蛋白在面粉基质中的基质效应分别为90.54%、86.04%和97.48%,均有不同程度的离子减弱作用,但并不明显,均在20%以内,后续实验均采用空白基质标准曲线补偿基质效应。
传统ELISA线性范围窄,故实际样品需要稀释后再进行定量,但Monaci等[34]研究表明稀释对ELISA法定量牛奶过敏原有显著影响,此外Koeberl等[35]选取3 种市售ELISA试剂盒检测羽扇豆,结果表明阳性样品的假阴性率为50%、12.5%和33.3%,阴性样品的假阳性率为33.3%、16.6%和25%,证明ELISA检测方法的交叉反应及不准确性。PCR技术从DNA水平可有效解决复杂基质中带来的检测困难,但Villa等[15]研究基于β-乳球蛋白基因分别采用定性PCR和实时PCR检测肉制品中牛奶过敏原,结果缺乏可重复性,LOD高达500 μg/g;贾敏等[17]基于GenBank基因建立实时定量PCR法检测α-乳白蛋白,液体样品LOD为1 000 copies/mL,但在实际样品果粒奶优中无扩增曲线,尚不满足痕量检测。与此同时,以上方法均未涉及多重过敏原的同时检测,而基于质谱技术的检测方法,从特异性的肽段水平进行定量,准确性和灵敏度更高,但目前仍大多局限于单一牛奶过敏原的定量检测,如Lamberti等[4]检测饼干中的αs1-酪蛋白,LOQ为4 μg/g;Lai Shiyun等[27]检测奶制品中的α-乳白蛋白,LOQ为50 μg/g。而本方法可以有效同时定量3 种牛奶过敏原,三者可以相互辅助定性牛奶成分的存在,LOQ最低为3.2 μg/g,可以对食品中的痕量牛奶过敏原进行检测。
2.3.2 加标回收率与精密度结果
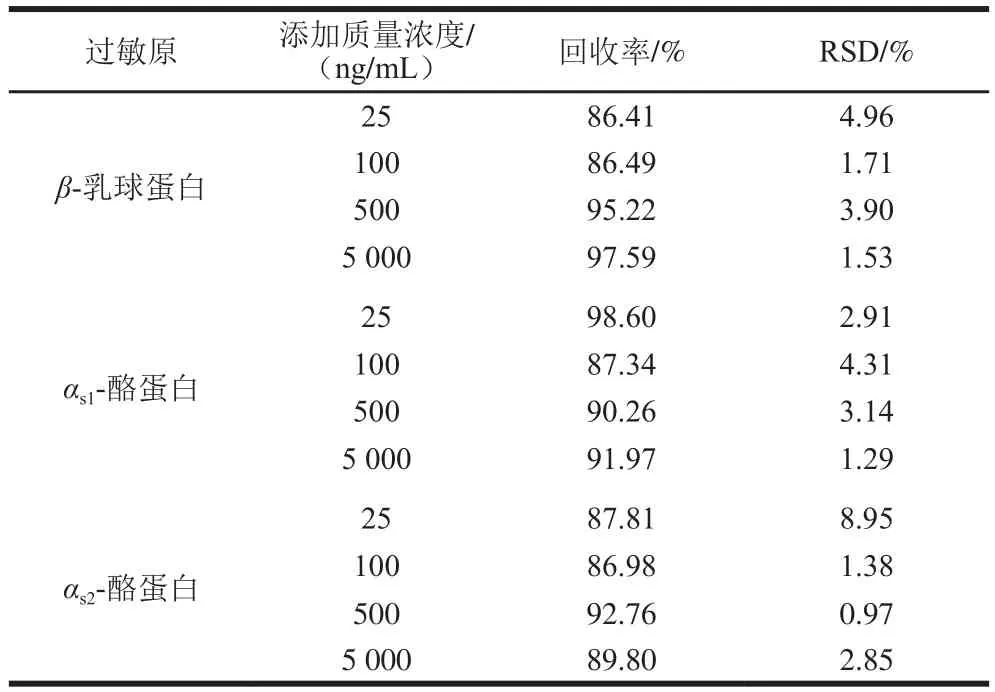
表5 牛奶过敏原的加标回收率和RSD(n=6)Table 5 Recoveries and RSDs of milk allergens from spiked samples (n= 6)
由表5可知,β-乳球蛋白的平均回收率在86.41%~97.59%之间,RSD不大于4.96%;αs1-酪蛋白的平均回收率在87.34%~98.60%之间,RSD不大于4.31%;αs2-酪蛋白的平均回收率在86.98%~92.76%之间,RSD不大于8.95%。相比于Qi Kailun等[36]采用LC-MS法在空白焙烤食物基质中αs1-酪蛋白平均回收率在65.2%~71.5%之间,αs2-酪蛋白的平均回收率在79.6%~86.1%之间,可见本方法回收率更加稳定,重复性高,可作为实际样品的准确定量检测方法。
2.4 实际样品检测结果
为评估本实验所建方法的实用性,从当地超市随机选取8 种实际样品进行检测,其中薯片、奶茶粉、小洋人和早餐包标签信息中含有牛奶但无过敏原标签提示,沙琪玛、蛋黄派、饼干和面粉标签信息中未标明含有牛奶成分且无过敏原提示。如表6所示,标签信息中含有牛奶成分的4 个样品均成功检出β-乳球蛋白、αs1-酪蛋白和αs2-酪蛋白,含量范围分别为(5.502×102±9.451)~(2.402×103±132.4)、(4.917×102±3.484)~(1.003×104±199.1) μg/g和(2.998×102±5.053)~(3.398×103±31.47) μg/g,而不含牛奶的4 个样品中3 种过敏原均未检出。虽然结果并未检出产品中潜在的牛奶过敏原,但不同生产线间的交叉污染现象仍不容轻视,而本方法可有效保障消费者食品安全,为企业的自检提供技术支持,使其可自行标明其可能隐藏的过敏原成分,促进食品过敏原标识市场监管的进一步落实和强化。
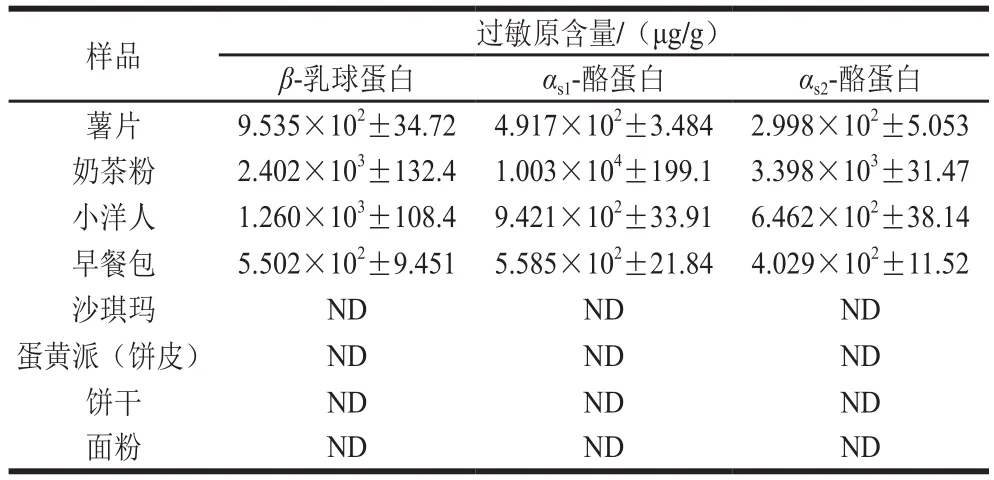
表6 UPLC-MS/MS法检测市售食品中牛奶过敏原含量Table 6 Contents of milk allergens in commercial foods determined by UPLC-MS/MS
3 结 论
基于β-乳球蛋白、αs1-酪蛋白和αs2-酪蛋白的特征肽段,建立UPLC-MS/MS方法,在MRM模式下可用于快速筛查和定量食品中的牛奶过敏原。本方法通过同时检测3 种主要的牛奶过敏原判断食品中牛奶的存在,避免单一致敏蛋白在加工中的降解及定量限等因素导致的假阴性,LOQ分别为β-乳球蛋白50 μg/g、αs1-酪蛋白3.2 μg/g、αs2-酪蛋白40 μg/g。方法学实验证实了本方法良好的准确性和重复性,可为我国牛奶过敏原的标签标识管理及定量检测提供技术支持,还可为其他过敏原的高通量检测提供理论基础。

