产低温蛋白酶动性球菌的筛选及其在低盐鱼露发酵中的应用
周 晶,袁 丽,高瑞昌
(江苏大学食品与生物工程学院,江苏 镇江 212013)
鱼露是一种很受欢迎的传统发酵调味品,有独特的风味和口感。传统鱼露的生产通常以低值鱼虾为原料,混入质量分数30%的食盐,在鱼体自身的酶和嗜盐微生物的共同作用下,发酵数月制得[1]。盐添加量、温度、添加酶或产酶微生物等工艺是影响鱼露风味的主要因素,因此,为了缩短生产周期,保温发酵、外加酶发酵和外加曲发酵等技术陆续被开发出来[2],但鱼露产品仍然存在高盐的弊端。众周所知,高盐给人体健康带来巨大的危害[3],因此对低盐鱼露的开发成为研究方向。低盐发酵会产生原料腐败[4],采用低温发酵则会降低腐败,但是低温条件下微生物和酶的活性又受到抑制,同样会延长生产周期。因此,在发酵过程中寻找加盐量和发酵温度的平衡,是实现低盐鱼露生产的重要问题。理想的起始发酵剂应该具备在低温条件下能够生长并且产生的胞外蛋白酶具有较高酶活力的特性。
温度是影响发酵过程中微生物的生长和酶的产生的重要参数之一。嗜冷菌通过产生冷适应酶生存,这种酶具有应对低温引起化学反应速率降低所需的特性[5]。低温蛋白酶通常是指最适催化温度在40 ℃及以下的一类蛋白水解酶[6]。在中低温条件下,嗜冷酶有更高的活性,并且与嗜中温酶相比,嗜冷酶能够在较低的温度下被灭活[7]。这些性能对于工业应用非常有益。目前,应用在食品工业中的蛋白酶大多属于中高温蛋白酶,温度范围是50~75 ℃[8-10]。在过去几年,许多学者已经分离出大量产冷适应酶的微生物并进一步研究,例如来自冰川土壤的地衣芽孢杆菌[11]、来自北极海冰的科威利亚菌[12]以及来自南极的梭状芽孢杆菌属[13]等。目前,冷适应蛋白酶在冷水洗涤、生物降解以及低温脱毛等工业过程中应用广泛,然而将冷适应蛋白酶应用于食品发酵中却鲜见报道。利用产冷活性蛋白酶微生物作为发酵剂缩短鱼露发酵周期,同时改善风味的研究还鲜见报道,尤其是利用动性球菌属(Planococcus)。因此,本研究从传统虾酱中筛选并鉴定4 株动性球菌,进而探索其作为起始发酵剂应用与低盐鱼露生产的可行性。
1 材料与方法
1.1 材料与试剂
传统发酵虾酱为山东荣成市农家自制;细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′)由北京诺赛基因组研究中心有限公司提供;LB液体培养基、液体Gibbons培养基、牛奶平板、固体Gibbons培养基(干酪素、酵母提取物、胰蛋白胨、脱脂乳粉、柠檬酸三钠、氯化钾、七水硫酸镁、氯化钠、福林-酚、三氯乙酸、碳酸钠) 国药集团化学试剂有限公司。
1.2 仪器与设备
SW-CJ-1FD型单人单面超净台 上海苏净实业有限公司;BXM-30R立式压力蒸汽灭菌锅 上海博迅实业有限公司;LRH-250生化培养箱 上海一恒科技有限公司;UV1601紫外分光光度计 北京瑞利分析仪器公司;Eppendorf AG 22331 Hamburg离心机 德国艾本德股份公司;HBA-1151聚合酶链式反应(polymerase chain reaction,PCR)仪 MJ Research公司;Alphalmager数字通用型凝胶成像分析系统 美国Alapha Innotech公司;恒温水浴锅 金坛市医疗仪器厂;HZQ-2全温振荡器 江苏金怡仪器科技有限公司。
1.3 方法
1.3.1 产低温蛋白酶菌株的筛选及鉴定
1.3.1.1 菌株富集和筛选
为了富集蛋白酶生产菌株,将1 g传统虾酱接种于99 mL的液体Gibbons培养基中。接种的三角烧瓶在25 ℃、150 r/min的旋转摇瓶培养箱中培养2 d。将接种培养的一系列稀释液(10-2~10-6)涂于含1%脱脂乳粉Gibbons琼脂平板表面,15 ℃培养2 d。通过观察菌落周围形成一个清晰透明的区域,检测到产蛋白酶菌株,然后,挑取该菌落进行划线纯种培养并对菌种进行保藏。
1.3.1.2 菌株鉴定
采用加热的方法提取菌体基因组DNA并作为扩增模板。使用细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′)对16S rRNA进行PCR扩增。PCR产物经1%琼脂糖凝胶电泳分析,并进行紫外照射。将细菌16S rRNA基因克隆到T载体并委托北京诺赛基因组研究中心有限公司测序。使用EzBiocloud数据库对序列进行比对,并采用MEGA 6.0版构建系统发育树。
1.3.2 菌株生长特性
活化菌株并按照2%的接种量接种于Gibbons液体培养基中,在不同温度条件下测定菌悬液在660 nm波长处的OD值,表示动性球菌的生长情况。温度梯度设置为5、15、25、35 ℃和45 ℃,pH值梯度设置为4、6、7、8和10,NaCl质量分数梯度设置为0%、5%、10%、15%和25%,培养48 h后测定OD值。
1.3.3 酶学特性
4 株菌的接种量均为1%,培养48 h后,取相同体积的培养液以10 000 r/min、4 ℃离心20 min,将离心得到的沉淀加入相同体积的蒸馏水重悬后用超声进行破碎,即为粗酶液,并将粗酶液保存于4 ℃。蛋白酶活力的测定采用福林-酚法[14],先将10.0 g/L酪蛋白溶液和粗酶液分别放入40 ℃恒温水浴中,预热5 min。将1.0 mL酪蛋白溶液和1.0 mL粗酶液加入试管中并充分混匀,然后在40 ℃处理10 min。温育结束时,取2.0 mL三氯乙酸(trichloroacetic acid solution,TCA)加入试管并混合。混合物4 ℃、10 000 r/min离心5 min。将1.0 mL上清液转移至新的试管中,加入5.0 mL碳酸钠溶液和1.0 mL福林-酚试剂。充分混合后在40 ℃水浴中显色反应20 min。最后,在680 nm波长下测定溶液的吸光度。在其他条件不变的情况下,将TCA灭活的酶液作为空白组。
为测定不同温度条件对蛋白酶活力的影响,分别在20、30、40、50、60、70 ℃进行酶促反应10 min,测定蛋白酶活力。配制pH值为3.0、5.0、7.0、9.0、11.0的缓冲液,用缓冲液配制质量分数为1%的酪蛋白溶液作为底物,将酶液与一系列底物在40 ℃保温,通过测定酶活力,得到酶反应的最适pH值及pH值对酶活力的影响。在最佳pH值和温度条件下,以0、3、6、9、12、15 g/100 mL为NaCl质量浓度梯度,测定其对蛋白酶活力的影响。
1.3.4 低盐鱼露样品的制备
从传统发酵的虾酱(山东威海,冬季采集)中分离得到了4 株动性球菌,分别命名为P. maritimusXJ2、P. plakortidisXJ10、P. dechangensisXJ11和P. rifietoensisXJ12。这4 株动性球菌保藏在中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),编号分别为CGMCC NO.17057、CGMCC NO.17058、CGMCC NO.17059和CGMCC NO.17060。以斑点叉尾鮰碎肉为原料进行鱼露发酵。先添加0.5%中性蛋白酶(Macklin,上海)对鮰鱼碎肉进行预水解(55 ℃,2 h),再加入1%木瓜蛋白酶(SCRS,上海)孵育3 h(45 ℃)。随后将样品冷却至室温,加入8%海盐和3 mL/100 g的混合发酵剂(4 株动性球菌的接种比例为1∶1∶1∶1),得到细胞密度约为106~107CFU/mL。在相同条件下,不添加发酵剂制备对照品。所有处理在21 ℃孵育15 d。添加混合发酵剂的鱼露样品记为A组,未添加混合发酵剂的样品记为B组,原料碎鱼肉记为C组。
1.3.5 氨基酸态氮(amino acid nitrogen,AAN)和总挥发性盐基氮(total volatile base nitrogen,TVB-N)分析
AAN的测定采用比色法[15]。吸取2 mL鱼露样品于10 mL比色管中。加入4 mL乙酸钠-乙酸缓冲溶液及4 mL显色剂(甲醛和乙酰丙酮的混合溶液),用水稀释至刻度,混匀。置于100 ℃水浴中加热15 min,取出,水浴冷却至室温后,移入比色皿内,于波长400 nm处测量吸光度。TVB-N的测定参照GB 5009.44—2016《食品中挥发性盐基氮的测定》中的微量扩散法[16]。
1.3.6 挥发性风味物质的测定
鱼露中的挥发性风味物质通过固相微萃取-气相色谱-质谱法进行检测鉴定[17]。将5 mL液体鱼露样品转移到20 mL样品瓶中并用硅胶垫密封。样品在60 ℃水浴中加热30 min,以获得顶空平衡。使用石英纤维(DVD/CAR/PDMS,50/30 μm,Supelco,Bellefonte,Pa,U.S.A.)吸收顶部空间的挥发性化合物。将纤维引入气相色谱-质谱联用仪的进样口,250 ℃解吸5 min。气相色谱-质谱分析采用初始温度为40 ℃并保持4 min,然后以5 ℃/min速度增加到120 ℃并保持5 min,以15 ℃/min的速度增加到230 ℃并保持10 min。He作为载气,流速为0.8 mL/min。本实验测定3 种样品中的挥发性化合物的相对含量。
1.4 数据分析
2 结果与分析
2.1 产蛋白酶菌株的筛选和鉴定
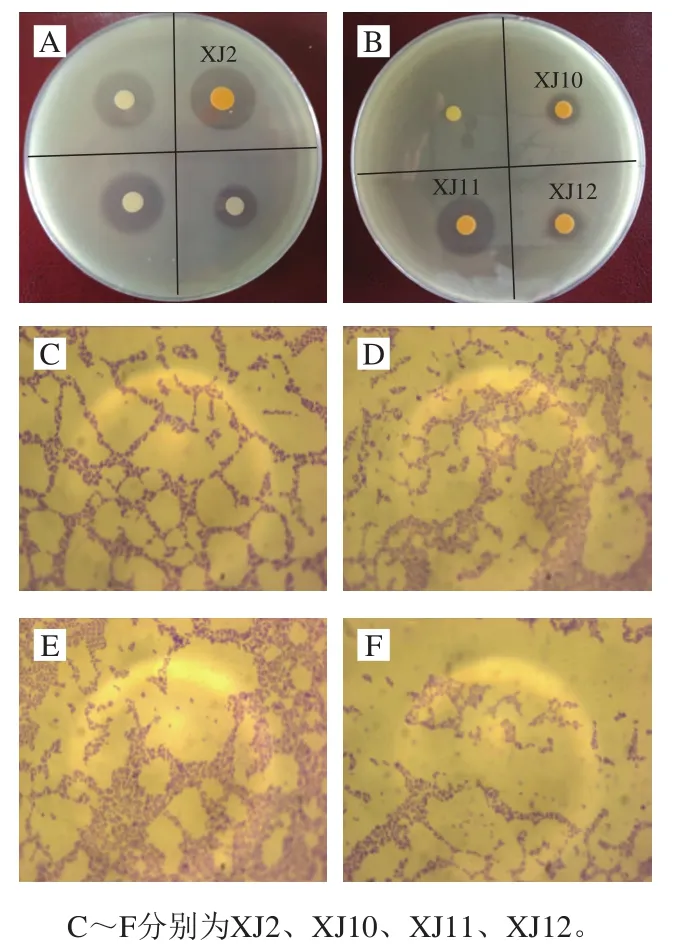
图1 菌株在牛奶平板上产生的水解透明圈(A、B)及菌株的革兰氏染色分析Fig. 1 Hydrolytic transparent circles produced by the isolates on agar plates with skim milk (A, B) and Gram-staining analysis
通过在添加脱脂乳粉琼脂平板上观察水解透明圈的方法,成功从传统发酵虾酱中筛选并分离出4 株有较高蛋白酶活力的细菌。因为在细菌菌落周围产生了清晰的水解圈(图1),这4 株菌被鉴定为蛋白酶产生菌即XJ2、XJ10、XJ11和XJ12。在蛋白酶活力检测中,与其他菌株相比,XJ11有最高的蛋白酶活力((10.07±0.11)U/mL,P<0.05,表1)。革兰氏染色分析表明,4 株菌均为革兰氏阳性球菌,与张晓燕等[18]分离的沙雷氏菌有所不同,产低温蛋白酶的沙雷氏菌为革兰氏阴性菌。
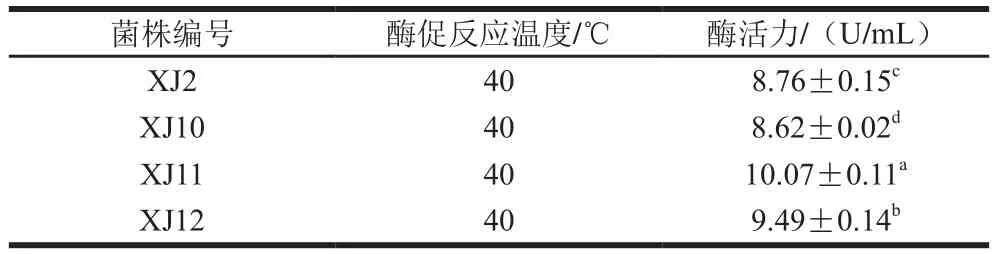
表1 4 株菌的酶活力分析Table 1 Enzymatic activity analysis of four selected strains
使用序列分析软件MEGA进行核酸序列比对,进一步构建系统发育树。在16S rRNA基因分析的基础上,利用BLAST搜索技术对4 株菌序列进行系统描述和亲缘关系鉴定。系统发育树分析表明,菌株XJ2、XJ10、XJ11和XJ12分别落在P. maritimusCP016538菌群、P. plakortidisCP016539菌群、P. dechangensisJQ762282菌群以及P. rifietoensisCP013659菌群中(图2)。因此,将这4 株菌分别命名为P. maritimusXJ2、P. plakortidisXJ10、P. dechangensisXJ11和P. rifietoensisXJ12。
2.2 菌株的生长特性
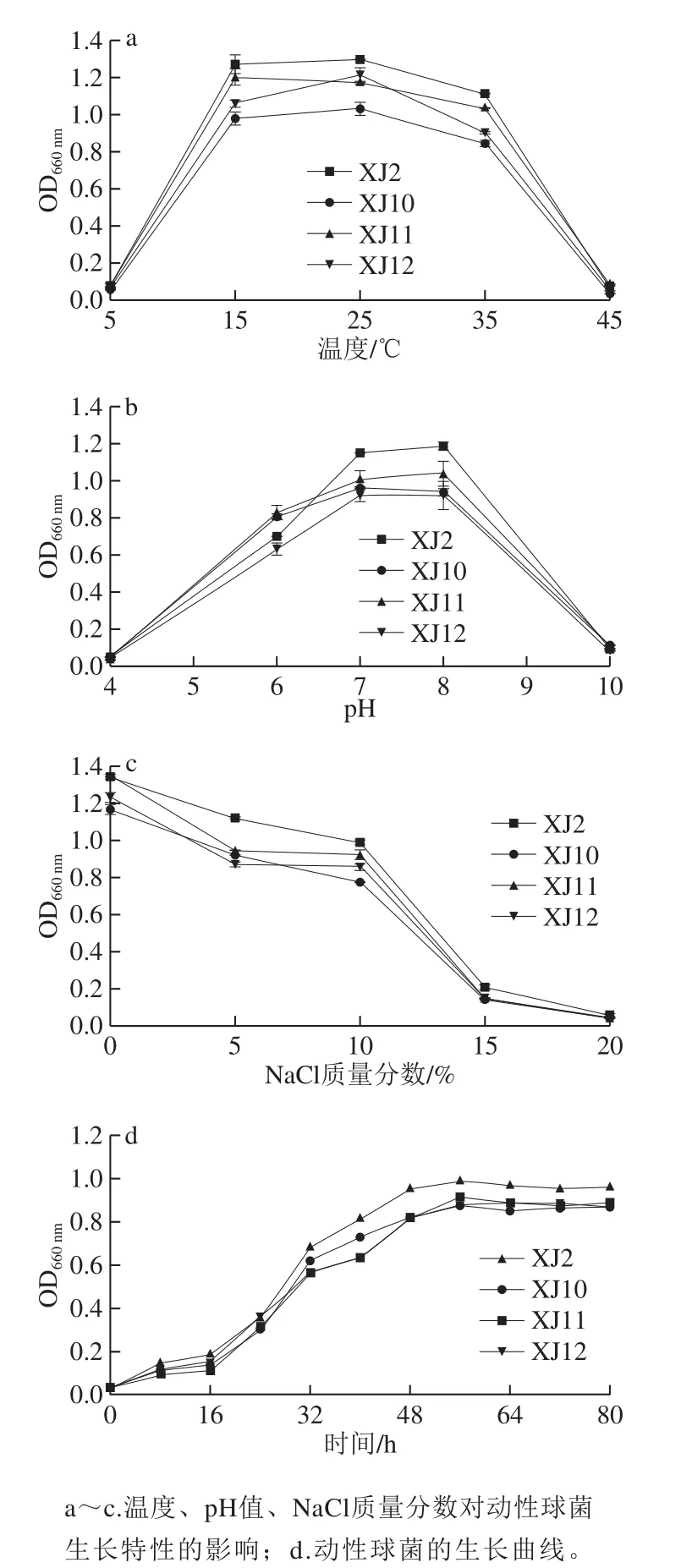
图3 动性球菌的生长特性Fig. 3 Growth characteristics of Planococcus
在不同的培养温度下探究液体培养基中动性球菌的生长特性。4 株动性球菌均能在5~45 ℃的温度下生长,且在25 ℃时有最大生长值(图3a),这与沙雷氏菌A29-2有相同的温度生长特性[18]。在极端温度下(5 ℃和45 ℃),菌株生长非常缓慢。由图3a可知,当温度为5~25 ℃时,细胞密度随温度的增加呈现升高的趋势;当温度高于25 ℃时,细胞密度有下降的趋势。当温度为15 ℃时,菌株有最快的生长速率,这也就表明动性球菌能在低温条件下较快生长。环境中的pH值变化会对细菌的生长产生重要的影响,主要是影响细菌对营养物质的解离与吸收。图3b显示,当初始pH值为7~8时,测得的细胞密度最高,因此动性球菌为中性偏碱性细菌。当NaCl质量分数大于15%时菌株几乎不生长;当NaCl质量分数为0%~15%时,细胞密度随NaCl质量分数的增加而降低(图3c)。基于此,本实验认为动性球菌不属于嗜盐菌,但具有一定的耐盐性。在最优的生长条件下,测得动性球菌的生长曲线(图3d)。16~48 h为动性球菌的指数生长期,即细胞密度快速增长的阶段,了解生长曲线有助于准确掌握接种时间,从而加快发酵速率。
2.3 粗蛋白酶酶学特性
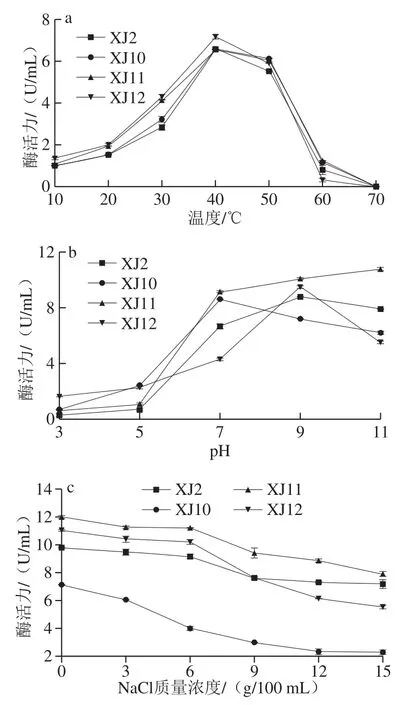
图4 温度(a)、pH值(b)和NaCl质量浓度(c)对蛋白酶酶活力的影响Fig. 4 Effect of temperature (a), pH (b) and NaCl concentration (c) on protease activity of the four strains
温度、pH值和NaCl质量浓度对产酶的影响较大。在优化温度的实验中,动性球菌所产的粗酶在10~60 ℃的温度范围内有活性,在40 ℃时检测到蛋白酶的最大活性(图4a)。与南极嗜冷杆菌Ta41的蛋白酶S41(-2~4 ℃)[19]和嗜盐古生菌Halogranum rubrum的耐盐蛋白酶(50 ℃)[20]相比,动性球菌的蛋白酶具有更好的冷适应能力。在不同缓冲体系pH 3.0~11.0范围内,测定了pH值对蛋白酶活性的影响。结果(图4b)表明,该蛋白酶在7.0~11.0的较宽pH值范围内具有活性。pH值为9.0时,动性球菌XJ2、XJ10和XJ12所产的蛋白酶活性最高,说明所产的酶是一种碱性蛋白酶,这与来自其他微生物的碱性蛋白酶也有相同的pH值范围[21]。如图4c所示,蛋白酶在NaCl质量浓度为0~15 g/100 mL时有活性,在15 g/100 mL时活性最低。尽管蛋白酶在高盐浓度下有所降低,但当NaCl质量浓度为1~9 g/100 mL时仍有较高的酶活力,因此该蛋白酶在一定程度上具有耐盐性。
2.4 AAN和TVB-N含量
AAN是发酵产品最重要的质量指标之一。在鱼露发酵过程中,AAN的存在可归因于蛋白酶的活性。本研究中发酵鱼露中AAN含量在发酵过程中呈现增加的趋势,这结果与之前的报道相同[21-22]。在发酵的最后阶段(15 d,图5),A组中的AAN质量浓度(1.33±0.08)g/100 mL明显高于B组((0.89±0.02)g/100mL,P<0.01)。有报道指出,发酵2 a的传统鱼露的AAN质量浓度可达到(1.10±0.03) g/100 mL[23]。在降低温度和NaCl质量分数的同时仍然能够保证鱼露的质量,这主要归功于采用动性球菌作为起始发酵剂。与发酵剂Staphylococcussp. CMC5-3-1相比[24],本实验的发酵时间从180 d降低至15 d,加盐量从25%降低至8%。根据以上的AAN结果,可以得知在发酵过程中添加动性球菌发酵剂能够有效增加鱼露中AAN含量。TVB-N是反映鱼露腐坏程度的主要指标,随发酵时间的延长,2 组样品的TVB-N值均呈现上升的趋势[25]。发酵15 d后,B组TVB-N质量浓度达到(209.00±1.49)mg/100 mL,然而A组TVB-N质量浓度(170.00±1.05)mg/100 mL明显低于B组(P<0.05)。结果表明,发酵剂(动性球菌)可以抑制腐败微生物的生长,从而降低TVB-N含量。因此,动性球菌可以作为一种新型的起始发酵剂,不仅能够在低温发酵条件下有较高的酶活力和发酵效率,还能够提高AAN含量并有效降低TVB-N含量。
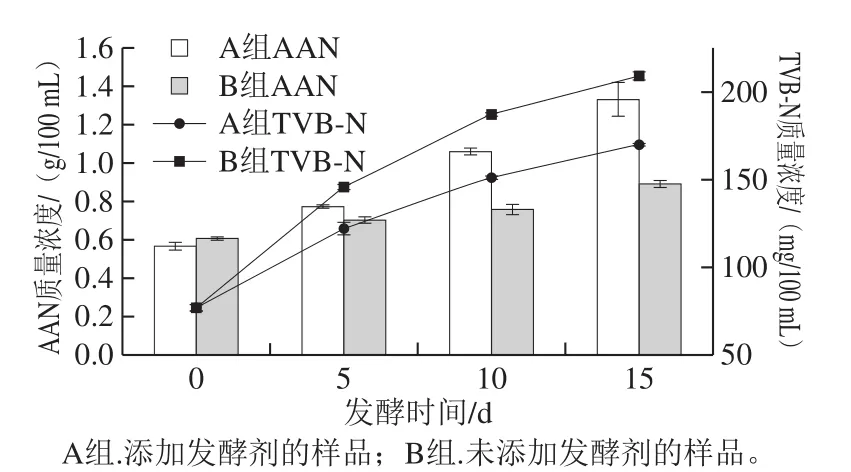
图52 组鱼露样品在发酵过程中AAN和TVB-N含量的变化Fig. 5 Changes in amino acid nitrogen and total volatile base nitrogen contents in fish sauce samples inoculated and not inoculated with the mixed starter culture during fermentation
2.5 挥发性风味物质分析
如表2所示,其中7 类挥发性化合物通过固相微萃取-气相色谱-质谱方法在低盐鱼露中被检测出来,包括6 种醇类、4 种酸类、11 种醛类、6 种酮类、4 种酯类、6 种烷烃类和2 种吡嗪类,与传统发酵法相比[23](18 种),此法获得的挥发性风味物质更加丰富。发酵鱼产品特殊的风味主要来自于这几类典型挥发性风味物质,与前人的研究基本保持一致[24,26-27]。醛类是鱼露中最丰富的挥发性风味物质[1],因醛类阈值较低,因此对鱼露整体风味的形成有较大的贡献。风味物质中醛类大多数来源于不饱和脂肪酸的氧化[28]。与B组相比,A组中己醛含量较高,其中己醛是亚油酸氧化的产物,具有青草香味[29]。A组中庚醛含量明显低于B组和C组,庚醛则是被证实的一种鱼腥味物质。异戊醛和苯甲醛都属于支链醛,来源于氨基酸的降解[30],能够赋予鱼露杏仁和水果香味。A组中2-甲基丁醛和3-甲基丁醛含量均高于B组,这2 种物质被认为是鱼露中最重要的挥发性醛并且对麦芽和坚果气味有贡献[31]。因此,接种了发酵剂(动性球菌)的鱼露样品产生了更加强烈的青草、麦芽和坚果气味以及降低了鱼腥味。
醇类由于阈值较高,可能对鱼露的风味不会产生显著的影响[32]。1-戊烯-3-醇对鱼腥味的形成起重要的作用,A组中含量明显低于B组和C组。酮类物质的生成通常与微生物的活动密切相关,主要释放奶酪味、脂肪味和焦燃味[33]。含氮的杂环吡嗪主要通过发酵过程中的Maillard反应生成,主要产生烘焙和坚果香气。结果表明,所筛选的4 株动性球菌对鱼露特有风味的形成有重要的影响并且有助于鱼露整体香气的产生。
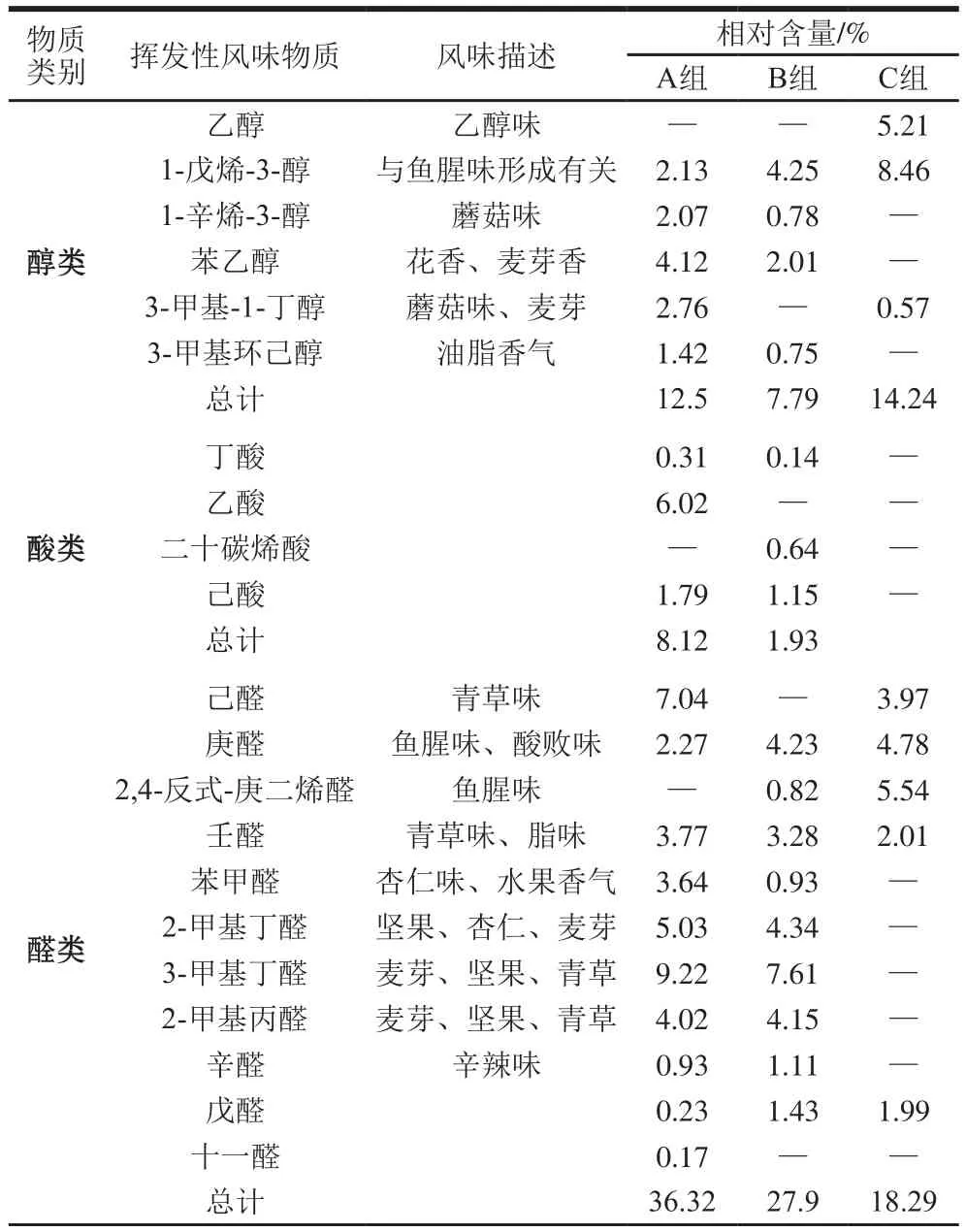
表2 不同处理鱼露发酵样品的挥发性风味物质Table 2 Flavor description and quantitative analysis of volatile compounds of fish sauce samples inoculated and not inoculated with the mixed starter culture
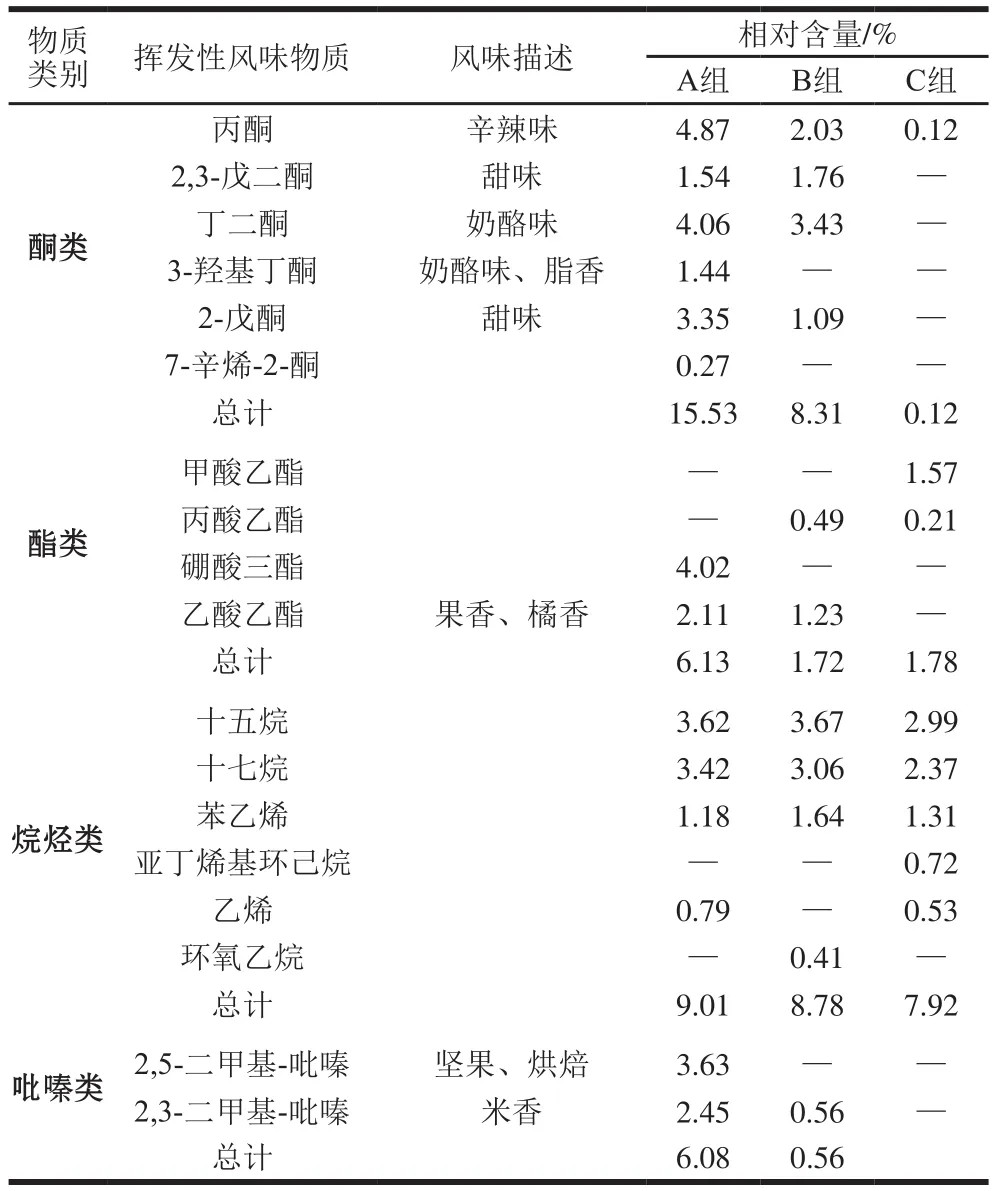
续表2
3 结 论
本研究从传统发酵的虾酱中分离得到4 株产低温蛋白酶的菌株,经菌种鉴定分别为P. maritimusXJ2、P. plakortidisXJ10、P. dechangensisXJ11和P. rifietoensisXJ12。4 株动性球菌可在15~25 ℃进行快速生长代谢并且具有分泌低温蛋白酶的能力。酶学性质分析结果显示:动性球菌所产蛋白酶的最适温度为40 ℃,最适pH值为9.0,并且当NaCl质量浓度小于9 g/100 mL时有较高的酶活力。研究结果表明,利用所筛选的动性球菌作为起始发酵剂在低盐鱼露的生产中具有一定的可行性和优越性。动性球菌在低温发酵条件下具有较高的酶活力和发酵效率,促进鱼露典型特征风味物质的生成且降低鱼腥味,能够有效产生传统鱼露的典型风味,降低传统发酵的盐浓度。本实验得到的4 株动性球菌可作为一种有效的低盐鱼露发酵剂。

