芦丁诱导猪肉肌原纤维蛋白结构变化对蛋白凝胶特性的改善作用
贾 娜,林世文,刘 丹,刘登勇
(渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁省食品安全重点实验室,辽宁 锦州 121013)
肌原纤维蛋白占肌肉蛋白的50%~55%,是肌肉中的主要蛋白质。在加工和贮藏过程中,蛋白质容易发生氧化,导致其结构发生改变,功能特性降低,从而降低肉的嫩度、风味、保水保油性和营养价值[1]。近年来,大量研究发现,向肉类制品中添加多酚类天然抗氧化剂是抑制蛋白质氧化的较为安全有效的方法[2]。如Jongberg等[3]研究发现,将白葡萄提取物添加到牛肉饼中可以有效抑制脂肪氧化和蛋白氧化,并在一定贮藏期间内保持较好的色泽。Turgut等[4]研究表明,向肉丸中添加0.5%和1%的石榴皮提取物可抑制蛋白质氧化并改善其感官性状。然而还有研究发现,多酚在肉类制品中抑制蛋白质氧化的同时,还能以共价和非共价的方式与蛋白质相互作用而改变蛋白质的空间结构、聚合形式,从而影响蛋白质的凝胶性、起泡性、乳化性等功能特性[5]。如低浓度绿茶提取物可以保持肉糜的结构和氧化稳定性,而高浓度的绿茶提取物与蛋白质的巯基反应生成了巯基-醌加成物,阻止蛋白质生成稳定的二硫键,导致肉糜体系的凝胶性能被破坏[6];儿茶素会使肌原纤维蛋白的构象发生改变,降低蛋白巯基含量,也降低了其凝胶强度[7];高浓度的绿原酸、迷迭香酸能够与肌原纤维蛋白发生相互作用,改变蛋白质的空间结构,导致其不能形成良好的凝胶网络结构,削弱其凝胶特性[8-9]。由此可见,高浓度多酚类物质在发挥抗氧化作用的同时,也会破坏蛋白的凝胶特性,因此,寻找一种抗氧化效果良好,且能提高蛋白凝胶特性的多酚类抗氧化剂对肉品的加工生产有着重要的作用。
芦丁也叫芸香苷、路丁、络通或槲皮素-3-O-芸香糖苷,为黄绿色或淡黄色针状晶体,常含有3 个结晶水,生物活性很强,具有抗自由基活性[10]。有研究表明,芦丁能够通过共价作用提高鳕鱼皮明胶凝胶的强度,并产生最大程度的交联[11],芦丁还能通过与蛋白的共价或非共价交联提高大豆分离蛋白膜的强度[12]。Fenton氧化体系可以形成大量的羟自由基,而羟自由基诱导蛋白质氧化是最常见的氧化反应[13]。因此,本研究选取肌原纤维蛋白Fenton反应体系,以芦丁为抗氧化剂,通过测定蛋白质巯基、表面疏水性、电泳、溶解度、凝胶强度和保水性、流变特性,研究芦丁对肌原纤维蛋白结构的影响及其对蛋白凝胶特性的改善作用,以期为拓展多酚类物质在肉制品中的应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
新鲜猪背最长肌 市购;芦丁 美国Sigma公司;氯化镁、磷酸二氢钠、磷酸氢二钠、氯化钠、乙二胺四乙酸二钠、乙醇、溴酚蓝、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、丙烯酰胺、过硫酸铵、冰乙酸、β-巯基乙醇、戊二醛等试剂均为国产分析纯。
1.2 仪器与设备
Allegra 64R冷冻离心机 美国Beckman公司;T25数显型均质机 德国IKA集团;UV-2550紫外-可见光分光光度计 日本Shimadzu公司;HHS电热恒温水浴锅山西省文水医疗器械厂;Discovery DHR-1流变仪美国TA公司;Mini电泳仪、电泳槽 美国Bio-Rad公司;E-1010(Giko)型离子溅射镀膜仪、S4800场发式扫描电镜 日本日立有限公司。
1.3 方法
1.3.1 肌原纤维蛋白提取
按照Park等[14]的方法并适当修改,提取的肌原纤维蛋白放置4 ℃条件下冷藏。用双缩脲法测定提取的蛋白质浓度,并用牛血清蛋白作为标准蛋白。
1.3.2 氧化体系的构建
参照Cao Yungang等[8]的方法并适当修改。提取的肌原纤维蛋白溶解于pH 6.0、浓度为10 mmol/L磷酸缓冲溶液,随后添加不同量的芦丁(10、50、100、150 μmol/g),并向其中添加羟自由基氧化体系(10 μmol/L FeCl3、100 μmol/L VC和1 mmol/L H2O2),使蛋白最终质量浓度为40 mg/mL。对照组为未氧化的肌原纤维蛋白以及氧化后未加芦丁的肌原纤维蛋白。混合体系在4 ℃反应12 h,反应结束后加入BHA终止氧化。
1.3.3 蛋白质巯基含量的测定
参照Di Simplicio等[15]的方法进行测定,制备质量浓度为10 mg/mL的肌原纤维蛋白溶液,取蛋白溶液1 mL与8 mL的Tris-甘氨酸混合,均质后4 ℃、10 000 r/min离心15 min,取上清液4.5 mL与0.5 mL浓度为10 mmol/L的Ellman试剂反应,反应30 min后(旋涡混合,静置30 min)用紫外分光光度计在波长412 nm处测量吸光度。用摩尔吸光系数13 600 L/(mol·cm)计算巯基含量。
1.3.4 表面疏水性的测定
参照Chelh等[16]的方法,制备质量浓度为5 mg/mL的肌原纤维蛋白溶液。取1 mL的蛋白溶液与200 μL质量浓度为1 mg/mL的溴酚蓝于室温下搅拌10 min,然后4 ℃、6 000 r/min离心15 min,取上清液稀释10 倍后用紫外分光光度计在595 nm波长处测定吸光度。表面疏水性以溴酚蓝结合量表示,按式(1)计算:
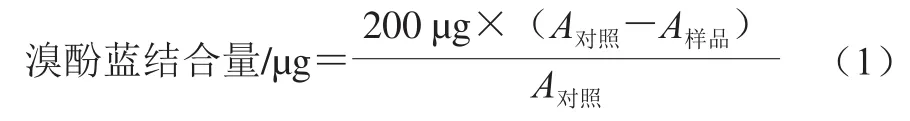
1.3.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)的测定
参考Xiong等[17]的方法并加以修改。将制备好的肌原纤维蛋白溶液调整质量浓度为2 mg/mL,采用12%的浓缩胶,4%的分离胶,以蛋白液1∶1体积添加上样缓冲液,进行SDS-PAGE分析,运用Quantity One软件进行扫描和分析。
1.3.6 溶解度的测定
参照Joo等[18]的方法并略加修改。用20 mmol/L pH 7.0的磷酸缓冲溶液配成10 mg/mL的蛋白质溶液,每管取3 mL于10 mL离心管中,4 ℃冰箱放置2 h后,4 ℃、10 000 r/min离心20 min。取上清液1 mL,对照取1 mL蒸馏水,采用双缩脲法测定蛋白质的浓度。溶解度按式(2)计算:

1.3.7 蛋白凝胶制备
称取蛋白质样品15 mL,装于密封的玻璃瓶中(内径25 mm×高度40 mm),在72 ℃水浴加热10 min,形成凝胶后取出,在冰浴中冷却1 h。在4 ℃的冰箱中贮存备用。
1.3.8 凝胶强度和保水性的测定
用TA-XT plus型质构分析仪测定肌原纤维蛋白凝胶的凝胶强度。采用Salvador等[19]的方法测定凝胶保水性,称取离心管的质量,记为m0,取一定质量凝胶(5~8 g)放入离心管底部,此时离心管的质量,记为m1。4 ℃、3 000 r/min离心10 min后,用中性滤纸吸干离心管中凝胶析出的水分,称取此时离心管质量,记为m2。保水性计算如式(3)所示:
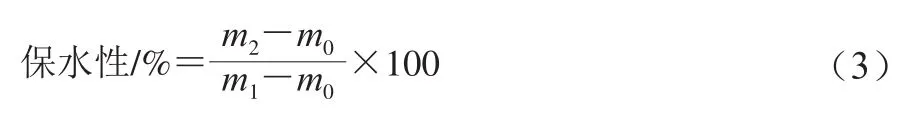
1.3.9 微观结构的测定
参照Jia Na等[7]的方法并适当修改。将凝胶样品紧密粘贴在扫描电镜样品台上,用E-1010(Giko)型离子溅射镀膜仪将样品表面喷金,放入扫描电镜的样品盒中待检,加速电压5 kV,放大10 000 倍,进行扫描结果观察。
1.3.10 流变特性的测定
配制40 mg/mL的肌原纤维蛋白溶液,将蛋白溶液均匀涂抹在测试平台上。测试参数设置为:频率0.1 Hz,应变力为2%,上下板的夹缝为1 mm,升温程序为20~80 ℃,升温速率为1 ℃/min。测试平板外蛋白与空气接触处,用盖板密封。
1.4 统计分析
2 结果与分析
2.1 芦丁对肌原纤维蛋白巯基含量的影响
肌原纤维蛋白中巯基基团数量较多,易受到活性氧的攻击转化为二硫键[20],因此,常作为判断蛋白质氧化的指标。如图1所示,与未氧化的蛋白相比,氧化组(0 μmol/g)肌原纤维蛋白的巯基含量略有降低,但差异不显著(P>0.05)。加入芦丁以后,随着芦丁添加量的增大,巯基含量显著降低(P<0.05),可能是因为芦丁与蛋白质的巯基发生共价相互作用,使巯基含量减少。有研究表明,酚类物质易被氧化形成醌,与肌原纤维蛋白中的巯基发生迈克尔加成生成巯基-醌加成产物[21]。如绿原酸、迷迭香酸促使肌原纤维蛋白巯基含量降低均是由于生成了巯基-醌加成产物[8-9]。此外,蛋白质的巯基之间易发生交联而形成二硫键,也会使得巯基含量降低[22]。因此,巯基含量降低可能是由于芦丁与巯基发生了共价交联及巯基之间形成了二硫键。

图1 芦丁对肌原纤维蛋白巯基含量的影响Fig. 1 Effect of rutin on the sulfhydryl content of myofibrillar protein
2.2 芦丁对肌原纤维蛋白表面疏水性的影响
表面疏水性的变化表明了蛋白质的构象变化,与蛋白质的功能特性密切相关。如图2所示,与未氧化的蛋白相比,氧化后蛋白表面疏水性略有增加,但差异不显著(P>0.05)。与氧化组(0 μmol/g)相比,低添加量的芦丁(10 μmol/g)降低了肌原纤维蛋白的表面疏水性,可能是由于芦丁与蛋白质在疏水区域发生非共价结合,从而使表面疏水性降低[2]。随着芦丁添加量的增加,蛋白质的表面疏水性有增加的趋势,这是因为芦丁与肌原纤维蛋白相互作用,使蛋白构象改变、结构展开,包埋在内部的疏水性氨基酸暴露在表面[23]。Cao Yungang等[8]研究表明,绿原酸在添加量为6 μmol/g和30 μmol/g时对肌原纤维蛋白表面疏水性的影响不大,而在150 μmol/g时,表面疏水性有所增加,可见高浓度的绿原酸促进了蛋白结构展开,与本研究结果类似。表面疏水性适当增加使得更多的疏水基团参与到热诱导凝胶形成的过程中,并且蛋白结构适度展开、活性基团暴露能够促进蛋白之间以及蛋白与芦丁之间的交联,因而有利于改善凝胶特性。
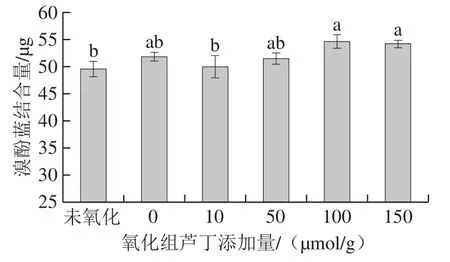
图2 芦丁对肌原纤维蛋白表面疏水性的影响Fig. 2 Effect of rutin on the surface hydrophobicity of myofibrillar protein
2.3 芦丁对肌原纤维蛋白SDS-PAGE的影响
如图3A所示,与未氧化的肌原纤维蛋白相比,氧化组(0 μmol/g)肌原纤维蛋白的肌球蛋白重链(myosin heavy chain,MHC)强度较弱,在凝胶顶部出现更多的聚合物,这是由于氧化导致蛋白质交联,MHC单体含量减少。而加入芦丁后,MHC强度有所减少,且芦丁添加量越大减弱越多;肌动蛋白在芦丁添加量较低时(0、10 μmol/g和50 μmol/g)几乎没有损失,当添加量偏高(100、150 μmol/g)时,有所降低。以上结果说明MHC和肌动蛋白参与了芦丁与蛋白质的加成反应,或者芦丁促进了蛋白质之间形成了二硫键共价交联,这与本实验巯基损失的结果一致。与本研究结果相似,Cao Yungang等[8]研究发现,添加较高量(150 μmol/g)绿原酸后,肌动蛋白条带的强度减弱,是由于绿原酸促进了蛋白质巯基转换成二硫键;Jongberg等[24]将绿茶提取物加入博洛尼亚式香肠中,发现肌动蛋白损失可能是由于巯基-醌发生相互作用导致的。此外,加入芦丁后,MHC和肌动蛋白条带强度减弱,但凝胶顶部并未出现聚集物,条带强度反而减少,可能是由于芦丁与蛋白或蛋白与蛋白之间相互交联,形成了大分子聚集体,未能进入凝胶中,因为有研究表明,酚类物质可通过与肌原纤维蛋白生成巯基-醌共价加成产物而起到连接蛋白的作用,此外,适度增加的疏水性也表明蛋白结构展开,活性基团暴露也可能导致大分子聚集体的形成[25]。
如图3B所示,添加β-巯基乙醇后,氧化组(0 μmol/g)肌原纤维蛋白的MHC和肌动蛋白条带增强,这表明氧化导致蛋白质通过二硫键形成聚合物[26]。加入芦丁后,与未添加β-巯基乙醇组的肌原纤维蛋白相比,添加β-巯基乙醇组的肌原纤维蛋白中MHC和肌动蛋白条带强度增强,表明蛋白质聚合物含量减少,MHC和肌动蛋白单体的含量增加。在添加β-巯基乙醇组中,氧化组及芦丁组的MHC和肌动蛋白条带大部分被还原,说明芦丁与蛋白交联形成的聚合物主要是可被还原的,并且这些聚合物主要是通过二硫键连接形成。
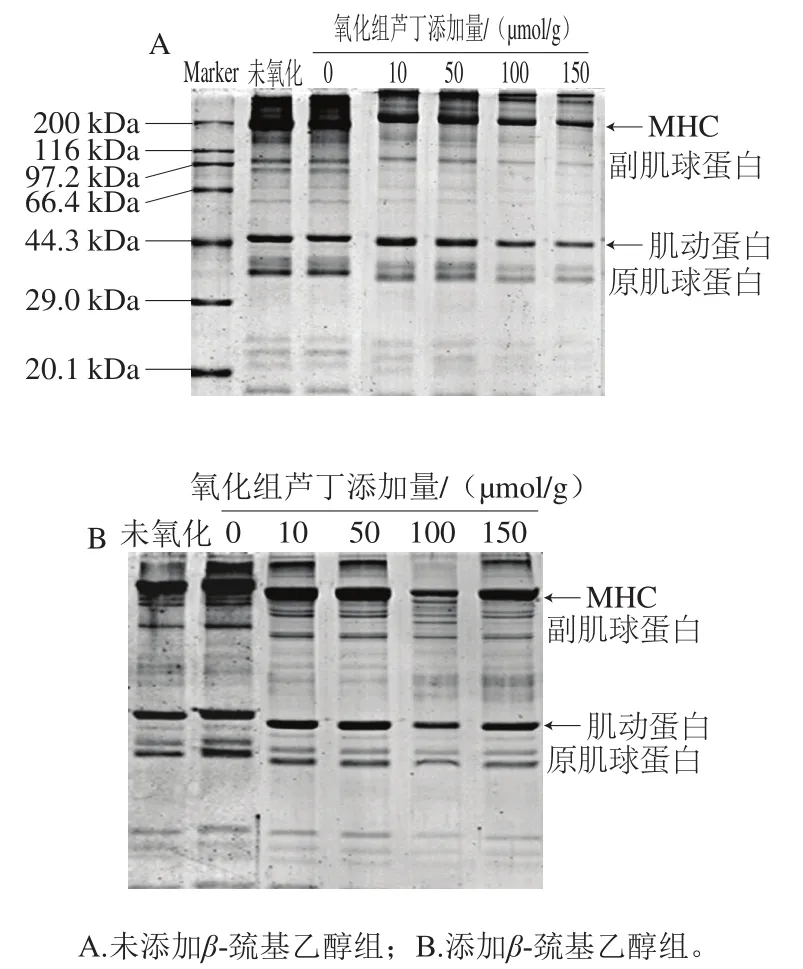
图3 芦丁对肌原纤维蛋白SDS-PAGE的影响Fig. 3 Effect of rutin on SDS-PAGE pattern of myofibrillar protein
2.4 芦丁对肌原纤维蛋白溶解度的影响
蛋白质的溶解性与蛋白质的乳化性、凝胶性、保水性等有密切关联,是判断蛋白质是否氧化变质的重要指标之一。从图4可以看出,与未氧化的蛋白质相比,氧化组(0 μmol/g)的肌原纤维蛋白溶解度有所降低,这是由于活性氧自由基诱导蛋白质发生交联聚合导致的。添加芦丁的肌原纤维蛋白溶解度随着芦丁添加量的增加而下降。另外,与氧化组(0 μmol/g)相比,低添加量芦丁可以提高蛋白的溶解度,高添加量芦丁对蛋白质的溶解度没有起到改善作用。与本研究相似,Wang Shuangxi等[27]研究发现300 μmol/g的迷迭香酸使蛋白溶解度明显降低,原因为蛋白质和酚类化合物发生相互作用使蛋白质聚集。另外,由2.2节可以看出,表面疏水性整体增加,说明蛋白质的水合能力下降,这与溶解度的变化一致。
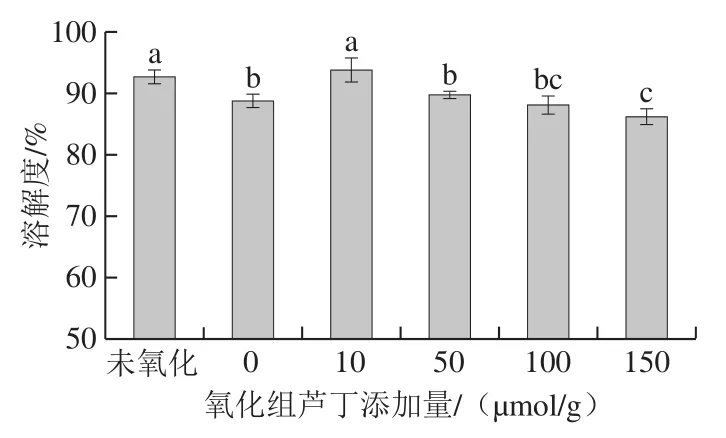
图4 芦丁对肌原纤维蛋白溶解度的影响Fig. 4 Effect of rutin on the solubility of myofibrillar protein
2.5 芦丁对肌原纤维蛋白凝胶特性的影响

图5 芦丁对肌原纤维蛋白凝胶强度(A)、保水性(B)和微观结构(C)的影响Fig. 5 Effects of rutin on the gel strength (A), water-holding capacity (B)and microstructure (C) of myofibrillar protein gel
如图5所示,未氧化的蛋白凝胶强度高于氧化组(0 μmol/g),说明加入羟自由基导致蛋白质结构发生改变,形成凝胶的能力降低。随着芦丁添加量的增大,凝胶强度逐渐增强,说明芦丁有利于蛋白凝胶的形成。Cao Yungang等[8,26]研究发现向肌原纤维蛋白中添加150 μmol/g的绿原酸或没食子酸后,蛋白的凝胶强度降低。Tang Changbo等[9]研究表明低浓度的迷迭香酸(0.05、0.25 mmol/L)对肌原纤维蛋白凝胶强度影响不大,而高浓度(1.25 mmol/L)的迷迭香酸则会形成迷迭香酸-半胱氨酸加合物,阻断肌原纤维蛋白的二硫键交联,降低蛋白凝胶的强度及持水能力。因此,相较于其他多酚,芦丁对蛋白凝胶强度有积极作用,这可能是由于芦丁使蛋白表面疏水性略有增加(图2),蛋白结构适度展开,有利于凝胶结构的形成。此外,在热诱导凝胶形成过程中,肌原纤维蛋白中的巯基转化成二硫键也是维持凝胶的主要作用力之一。一般认为,巯基与醌类物质的加成反应会阻碍凝胶形成过程中二硫键的生成,但二者适度交联会使蛋白质通过酚类物质连接,形成聚合物,有利于凝胶的形成[6,28]。因此,从本研究结果看,巯基-醌加成产物的形成和表面疏水性的适度增加均是导致凝胶形成的有利因素。与未氧化组相比,氧化组(0 μmol/g)的蛋白保水性略有降低,随着芦丁添加量的增加,蛋白质的保水性呈上升趋势,表明芦丁可提高凝胶保水能力,与凝胶强度结果一致。一般来说,溶解度降低,蛋白质的功能特性会变差(图4),加入芦丁后,肌原纤维蛋白的凝胶强度和保水性反而增加(图5A、B),芦丁没有导致肌原纤维蛋白发生过度的变性、聚集,而是导致蛋白与蛋白或蛋白与芦丁之间交联生成了大分子聚集体,这些大分子聚集体导致可溶解的蛋白变少,从而使溶解度降低,且大分子聚集体的生成有利于后续加热过程中凝胶网络结构的形成。结合蛋白凝胶的微观结构来看,添加芦丁后,蛋白的凝胶网络结构有了明显的改善,随着芦丁添加量的增加,蛋白凝胶表面变得均匀、孔隙变小,凝胶网络结构更加有序、致密,因此,微观结构的结果进一步证实了芦丁对凝胶特性的改善作用。
2.6 芦丁对肌原纤维蛋白凝胶流变特性的影响
流变性质是反映蛋白质凝胶特性的常用指标之一。储能模量(G′)又称弹性模量,反映凝胶形成过程中的弹性。如图6所示,G′在45 ℃和50 ℃时有2 个明显的转变峰,峰值在45 ℃时,为凝胶形成阶段,是由于肌球蛋白头部S1亚基的变性导致蛋白质聚合,弹性凝胶网络形成。在50 ℃时出现较低的峰值,是由于肌球蛋白尾部变性聚集、流动性增强而导致凝胶弹性减弱,G′降低。随后随着温度的升高,蛋白质充分展开,暴露了更多的官能团,最终形成了不可逆的凝胶网络结构。50 ℃之前,各组G′的差异不显著,50 ℃之后,即凝胶最终形成阶段,加入芦丁后G′均高于未氧化组,可能的原因为芦丁作为交联剂与蛋白质相互作用形成了大分子聚集物,从而有利于凝胶网络结构的形成[29]。另外,由于芦丁使蛋白质的表面疏水性适度增加,促进了热诱导凝胶形成过程中蛋白质之间的疏水作用,也会使G′增大。由此可见,芦丁对形成蛋白质凝胶弹性网络结构有促进作用,与凝胶强度的结果一致。有研究发现,高添加量的绿原酸(150 μmol/g)、迷迭香酸(1.25 mmol/L)导致肌原纤维蛋白凝胶形成过程中流变曲线趋于平缓,最终不能形成凝胶网络结构[8-9]。损耗模量(G”)又称黏性模量,反映凝胶形成过程中的黏度。G”的峰值变化趋势与G′相似,呈经典的“几”字形。整个加热过程中,G′始终高于G”,尤其是当温度大于50 ℃时,这表明形成了一个更具弹性的蛋白凝胶。
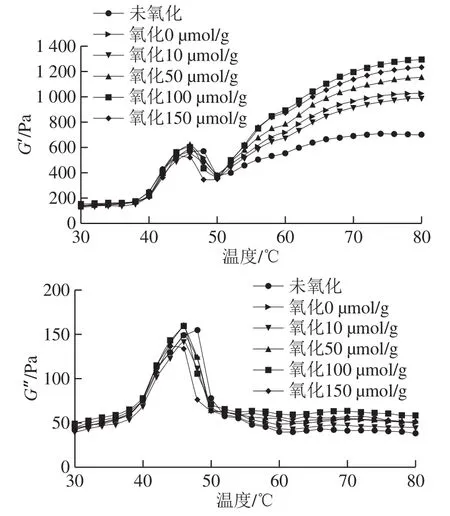
图6 芦丁对肌原纤维蛋白凝胶流变特性的影响Fig. 6 Effect of rutin on the rheological properties of myofibrillar protein gel
3 结 论
氧化环境中,将芦丁添加到肌原纤维蛋白中,巯基含量降低,表面疏水性先下降后上升,溶解度下降;添加芦丁后使MHC条带强度减弱,肌动蛋白条带强度在较高添加量下(100 μmol/g和150 μmol/g)减弱,加入β-巯基乙醇后,MHC和肌动蛋白条带大部分被还原;芦丁提高了肌原纤维蛋白的凝胶强度与保水性,改善了蛋白的流变学特性。因此,较高添加量的芦丁可增强肌原纤维蛋白的凝胶强度和保水性,主要归因于芦丁与蛋白的共价交联及其对蛋白表面疏水性的适度提升作用。

