心外膜脂肪组织厚度对2型糖尿病合并冠心病患者血管事件发生的预测价值
姜 育,张 洁,陈 群,李 亚
(1.西安医学院第一附属医院内分泌科,陕西 西安 710077;2.西安市第五医院心内科,陕西 西安 710082;3.西安交通大学地方病研究所,陕西 西安 710061)
2型糖尿病(Type 2 diabetes mellitus,T2DM)患者占糖尿病患者的80%以上,T2DM与冠心病(Coronary heart disease,CHD)是相互关联的两种疾病,T2DM是CHD发病的危险因素之一[1-2]。T2DM合并CHD患者由于糖脂代谢异常、冠状动脉损伤等原因,易发生心脑血管不良事件[3-4]。目前临床较缺乏有效预测T2DM合并CHD患者心血管事件的指标,因此积极寻找有效预测指标十分重要。相关研究[5]发现,脂肪组织异常增多与心血管疾病的发生相关,过量的心外膜脂肪组织可促进冠脉粥样斑块的形成和发展。是否可用心外膜脂肪组织厚度预测T2DM合并CHD患者心脑血管事件的发生,尚不清楚。本研究通过对84例T2DM合并CHD患者的临床资料进行分析,探讨心外膜脂肪组织厚度预测T2DM合并CHD患者心脑血管事件发生的价值。
1 资料与方法
1.1 一般资料 回顾性分析2017年10月至2019年10月西安医学院第一附属医院、西安市第五医院收治的84例T2DM合并CHD患者的临床资料,其中随访结果发生心脑血管不良事件患者(记为心脑血管组)33例,未发生心脑血管不良事件患者(记为非心脑血管组)51例,两组一般资料对比差异均无统计学意义(均P>0.05),见表1。本研究经过医院伦理委员会审批通过。病例纳入标准:①均符合《中国2型糖尿病防治指南(2017)》[6]与《中国稳定性冠心病诊断与治疗指南》[7]诊断标准者;②年龄>18岁者;③均进行心外膜脂肪组织厚度检测者;④临床资料完整者。排除标准:①重要脏器功能障碍者;②伴有急性感染、严重内外科疾病者;③伴有恶性肿瘤、糖尿病、CHD等严重并发症者;④免疫功能异常者;⑤存在认知或沟通障碍者;⑥伴有外周神经疾病者;⑦伴有心瓣膜病、心肌病或心肌炎等其他严重的心脏疾病者;⑧自然失访者。

表1 两组患者一般资料比较
1.2 研究方法 ①常规治疗:参照《中国2型糖尿病防治指南》与《中国稳定性CHD诊断与治疗指南》给予所有患者二甲双胍、地特胰岛素、β受体阻滞剂、肠溶阿司匹林、他汀类、氯吡格雷以及冠脉介入术等常规治疗。②心外膜脂肪组织厚度检测:所有患者检查前12 h内禁止进食含咖啡因的饮料或食物,患者取左卧位,采用飞利浦 IU22 彩色多普勒超声诊断仪行彩色多普勒超声检查,使用M5S探头,频率2.5 MHz,连续测量患者3个连续心动周期,取平均值,以长轴切面心外膜脂肪组织厚度、短轴切面心外膜脂肪组织厚度的均值为心外膜脂肪组织厚度。③CHD患者冠状动脉病变程度判断:由从业5年资质以上CHD介入治疗医师采用Gensini积分系统[8]判断CHD患者病情,根据冠状动脉狭窄程度确定基本分数:将冠状动脉狭窄≤25%、>25%且≤50%、>50%且≤75%、>75%且≤90%、>90%且≤99%、100%分别记为1、2、4、8、16、32分,根据冠状动脉病变部位确定权重系数:狭窄部位左主干病变×5,左前降支、回旋支近端×2.5,前降支中段×1.5,右冠状动脉、前降支远段、回旋支远段、左心室后侧支、钝缘支动脉、第1对角支、心尖支×1.0,第2对角支×0.5,Gensini积分=冠状动脉狭窄程度基本分数×权重系数。④心脑血管事件发生情况:所有患者治疗后均给予12个月随访,每月通过电话随访或门诊复查形式进行1次随访,将随访期间出现的全因死亡、心肌梗死、靶血管病变重建、非致死心肌梗死、不稳定型心绞痛、急性冠脉综合征、脑卒中、脑缺血等心脑血管不良事件患者记为心脑血管组,未发生心脑血管不良事件者记为非心脑血管组。

续 表
1.3 观察指标 ①对比两组糖脂代谢指标状况:两组所有受试者均需禁食 8~12 h,住院第2天清晨抽取空腹肘静脉血混匀送往西安医学院第一附属医院检验科检测,采用葡萄糖氧化酶法测定空腹血糖(FPG)、餐后2h血糖(2hPPG),采用高效液相层析法检测糖化血红蛋白(HbA1c),采用电学发光免疫法测定空腹胰岛(FINS)水平,并计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=FINS×FPG/22.5;采用酶法测定空腹血甘油三酯(TG)、高密度脂蛋白胆固醇(HDLC)、低密度脂蛋白胆固醇(LDLC)、总胆固醇(TC)。②对比两组治疗前心外膜脂肪组织厚度及冠状动脉病变积分。③分析T2DM合并CHD患者发生心脑血管事件的影响因素。④分析心外膜脂肪组织厚度预测T2DM合并CHD患者心脑血管事件发生的价值。

2 结 果
2.1 两组糖脂代谢指标比较 心脑血管组FPG、2hPPG、HbA1c、HOMA-IR、TG、TC水平均高于非心脑血管组(均P<0.05),心脑血管组FINS水平低于非心脑血管组(P<0.05),见表2。
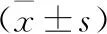
表2 两组糖脂代谢指标比较
2.2 两组心外膜脂肪组织厚度及冠状动脉病变积分比较 心脑血管组心外膜脂肪组织厚度、冠状动脉病变积分均高于非心脑血管组(均P<0.05),见表3。84例患者经Pearson方法分析显示心外膜脂肪组织厚度与冠状动脉病变积分呈正相关(r=0.804,P<0.05)。
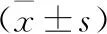
表3 两组心外膜脂肪组织厚度及冠状动脉病变积分比较
2.3 T2DM合并CHD患者发生心脑血管事件的多因素分析 以FPG、2hPPG、HbA1c、HOMA-IR、TG、TC、FINS、心外膜脂肪组织厚度、冠状动脉病变积分为自变量进行Logistic回归分析,上述指标自变量赋值均为连续变量,多因素分析显示FPG、FINS、心外膜脂肪组织厚度、冠状动脉病变积分是T2DM合并CHD患者发生心脑血管事件的影响因素(均P<0.05),见表4。

表4 影响T2DM合并CHD患者发生心脑血管事件的多因素分析
2.4 心外膜脂肪组织厚度预测T2DM合并CHD患者心脑血管事件价值 ROC曲线分析结果显示,其曲线下面积为0.796(95%CI:0.600~0.823),灵敏度为78.79%,特异度为88.24%,约登指数为67.03%。
3 讨 论
T2DM合并CHD患者由于糖脂代谢异常、冠状动脉损伤等状况可加快动脉粥样硬化的进展速度,导致心脑血管事件发生[9]。针对该类患者仅靠有效治疗手段远远不够,早期简便、准确的预测其心脑血管发生风险,尽早开展诊疗措施至关重要。

图1 心外膜脂肪组织厚度预测T2DM合并CHD患者心脑血管事件ROC曲线
本研究发现,心脑血管组FPG、2hPPG、HbA1c、HOMA-IR、TG、TC水平均高于非心脑血管组,心脑血管组FINS水平低于非心脑血管组,提示糖脂代谢指标与T2DM合并CHD患者心脑血管事件的发生有关,与既往研究报道一致[10]。心脑血管组心外膜脂肪组织厚度、冠状动脉病变积分均高于非心脑血管组,心外膜脂肪组织厚度与冠状动脉病变积分呈正相关,说明心外膜脂肪组织厚度与T2DM合并CHD患者心脑血管事件的发生相关,且可反映冠状动脉病变程度。多因素分析显示FPG、FINS、心外膜脂肪组织厚度、冠状动脉病变积分是T2DM合并CHD患者发生心脑血管事件的影响因素,提示FPG、FINS、心外膜脂肪组织厚度、冠状动脉病变参与了T2DM合并CHD患者心脑血管事件的发生。ROC曲线分析显示心外膜脂肪组织厚度预测T2DM合并CHD患者心脑血管事件发生的曲线下面积为0.796(95%CI:0.600~0.823),灵敏度为78.79%,特异度为88.24%,约登指数为67.03%,说明检测心外膜脂肪组织厚度对T2DM合并CHD患者心脑血管事件的发生具有较高预测价值。
心外膜脂肪组织是沉积在人体心脏位置的内脏脂肪组织,包裹在机体右心室游离壁、冠状动脉表面,几乎覆盖了约80%的心脏表面[11]。此外,心外膜脂肪组织还具有内分泌功能,可释放出部分脂肪因子、促炎细胞因子等,心外膜脂肪组织分泌的脂肪因子可直接作用于机体心肌间质,对冠状动脉的平滑肌细胞、内皮细胞起到促炎症作用[12],甚至可对人体粥样硬化斑块中的多种细胞物质起到局部炎症反应,进而损伤血管内膜功能,加快了冠状动脉粥样斑块的形成和发展,增加了不良血管事件的发生风险[13-14]。心外膜脂肪组织分泌的促炎细胞因子可作用于靶组织,参与血管内膜的局部炎症反应,脂质沉积造成血管内皮功能障碍,导致血管动脉稳态发生变化,巨噬细胞浸润、平滑肌增殖,易导致或加剧易损斑块破裂,最终导致不良血管事件发生。国外研究[15]证实,人体心外膜脂肪组织厚度与多支血管病变相关,与本研究结果一致。临床测量心外膜脂肪组织除了超声检测这一方法外,还可应用CT、磁共振成像等措施[16-18],但CT、磁共振成像具有辐射性强、费用贵等劣势。相关研究[19]发现,经超声测量的CHD患者右心室游离壁外心外膜脂肪组织厚度与磁共振成像检测所获得的心外膜脂肪组织容积具有良好的相关性,故超声检测心外膜脂肪组织厚度是一种便捷、高效、经济的检测方式。屈文涛等[20]发现高尿酸血症与心外膜脂肪厚度相关,同时,刘玉珊[21]研究发现患者心外膜脂肪体积越大、血浆可溶性血栓调节蛋白含量越高、冠脉病变程度越严重,以上提示心外膜脂肪组织与冠心病发生具有密切相关性,与本研究结果相符。
综上,T2DM合并CHD患者糖脂代谢明显异常,心外膜脂肪组织厚度与冠状动脉病变程度相关,心外膜脂肪组织厚度对T2DM合并CHD患者心脑血管事件的发生具有较高预测价值。超声检测心外膜脂肪组织厚度具有操作简单、无创等优势,可作为一种常规检查应用于T2DM合并CHD患者中。本研究的不足之处在于样本量小,后期可开展大样本量的多中心试验,进一步验证本研究结论。

