高血压脑出血GSN、CCCK-18、NSE水平变化对神经功能的影响
张培松 刘怀新★ 任松涛 李鑫 张培凯 时传迎
高血压脑出血(Hypertensive cerebral hemorrhage,HCH)是高血压病最严重的并发症之一,可引起偏瘫、失语,甚至引起休克、脑疝,严重威胁患者生命健康[1-2]。在临床上对HCH 患者病情进行准确评估具有重要意义,可指导疾病的诊疗[3]。相关研究指出,脑出血患者血清Caspase 切割的细胞角蛋白18(caspase-cleaved cytokeratin-18,CCCK-18)水平明显升高,与患者30 d 死亡率明显相关[4]。神经元特异性烯醇化酶(Neuronal-specific enolase,NSE)是反映神经纤维损伤的标志物,在神经元纤维破裂和膜完整性破坏的过程中,其水平可明显升高[5]。凝溶胶蛋白(Gelsolin,GSN)被证实具有清除机体损伤后释放的肌动蛋白的作用,可保护神经组织[6]。基于此,本研究尝试探讨HCH 患者GSN、CCCK-18、NSE 水平变化情况,并分析其对患者神经功能的影响。报告如下。
1 资料与方法
1.1 一般资料
选取本院2018年1月至2019年12月HCH 患者108 例,其中男63 例,女45 例;年龄平均(57.08±5.69)岁。根据出院时神经功能恢复情况分为两组,神经功能恢复情况采用格拉斯哥预后量表(Glasgow outcome scale,GOS)[7]评分判定,GOS 评分<4 分为预后不良,4~5 分为预后良好。其中85例患者恢复良好,纳入恢复良好组,23 例恢复不良,纳入恢复不良组。
纳入标准:①符合HCH 诊断标准[8];②首次发病;③发病至入院<24 h;④对本研究药物无禁忌;⑤无脑部创伤及手术史;⑥发病前认知功能良好;⑦患者或其家属知晓本研究,已签署同意书。排除标准:①脑梗死患者;②恶性肿瘤患者;③严重心肺肝肾功能障碍者;④伴有严重感染性疾病者;⑤血液系统疾病患者;⑥需行外科手术治疗者。
1.2 方法
治疗方法:所有患者入院后均给予甘露醇注射液、依达拉奉注射液、奥美拉唑注射液等治疗,常规予以心电监护、吸氧、保持呼吸道通畅。
指标检测方法:所有患者均于入院时(治疗前)、治疗7 d 后采集静脉血5 mL,离心处理后取血清,采用酶联免疫吸附法检测血清GSN、CCCK-18、NSE,试剂盒购自广州易科生物科技有限公司。
1.3 观察指标
①比较两组一般资料,采用美国国立卫生研究院卒中量表[9](National Institute of Health stroke scale,NIHSS)评定神经功能缺损程度,分为轻度患者(<7 分,32 例)、中度患者(7~15 分,43 例)、重度患者(>15 分,33 例)。②不同出血量、神经功能缺损程度患者入院时血清GSN、CCCK-18、NSE 水平。③两组入院时、治疗7 d 后血清GSN、CCCK-18、NSE 水平。
1.4 统计学方法
数据处理采用SPSS 22.0 软件,计数资料以n(%)描述,采用χ2检验;计量资料以(±s)描述,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析;相关性分析采用Spearman 相关系数模型,通过Logistic 进行多因素回归分析,P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料
两组年龄、发病至入院时间、出血量、神经功能缺损程度、合并糖尿病、房颤史比较,差异有统计学意义(P<0.05)。见表1。
2.2 不同病情患者入院时血清GSN、CCCK-18、NSE 水平
血清CCCK-18、NSE 水平随出血量增加、神经功能缺损程度增加呈逐渐升高趋势,GSN 水平随出血量增加、神经功能缺损程度增加呈逐渐降低趋势(P<0.05)。见表2。
2.3 入院时血清GSN、CCCK-18、NSE 水平与出血量、神经功能缺损程度相关性
入院时血清CCCK-18、NSE 水平与出血量(r=0.766、0.711)、神经功能缺损程度(r=0.767、0.704)呈正相关,血清GSN 与出血量、神经功能缺损程度(r=-0.846、-0.872)呈负相关(P<0.05)。见图1。
2.4 两组入院时、治疗7 d 后血清GSN、CCCK-18、NSE 水平
恢复不良组入院时、治疗7 d 后血清CCCK-18、NSE 水平高于恢复良好组,GSN 水平低于恢复良好组,差异有统计学意义(P<0.05);恢复良好组治疗7 d 后血清CCCK-18、NSE 水平低于入院时,GSN 水平高于入院时(P<0.05)。见表3。
2.5 HCH 患者神经功能恢复的影响因素
Logistic 回归分析,年龄、发病至入院时间、合并糖尿病、房颤史、入院时、治疗7 d 后血清GSN、CCCK-18、NSE 是HCH 患者神经功能恢复的影响因素(P<0.05)。见表4。
表1 两组一般资料比较[n(%),(±s)]Table 1 Comparison of general data between the 2 groups[n(%),(±s)]

表1 两组一般资料比较[n(%),(±s)]Table 1 Comparison of general data between the 2 groups[n(%),(±s)]
资料年龄(岁)性别恢复不良组(n=23)61.74±6.17恢复良好组(n=85)52.43±5.02 t/χ2值7.503 0.040 P 值<0.001 0.843男女BMI(kg/m2)发病至入院时间(h)出血部位基底核区小脑额顶或颞叶脑干出血量(mL)<15 15~30>30神经功能缺损程度轻度中度重度合并糖尿病13(56.52)10(43.48)24.86±1.93 3.18±0.24 50(58.82)35(41.18)24.29±2.06 2.31±0.20 1.193 17.716 0.493 0.236<0.001 0.920 11(47.83)3(13.04)6(26.09)3(13.04)34(40.00)13(15.29)24(28.24)14(16.47)3.468 0.001 3(13.04)7(30.43)13(56.52)37(43.53)33(38.82)15(17.65)3.072 0.002 2(8.70)8(34.78)13(56.52)30(35.29)35(41.18)20(23.53)5.348 0.021是否8(34.78)15(65.22)10(11.76)75(88.24)房颤史6.269 0.012有无8(34.78)15(65.22)9(10.59)76(89.41)
3 讨论
本研究发现,HCH 患者入院时的出血量越多、神经功能缺损程度越严重,其血清CCCK-18 水平越高,进一步经相关性分析发现血清CCCK-18 水平与出血量、神经功能缺损程度呈正相关关系,提示血清CCCK-18 可能作为评估HCH 患者病情的标志物。CCCK-18 是CK-18 通过半胱天冬酶的作用在不同位点被切割释放出的凋亡标志蛋白,HCH 患者出血量越大,对神经细胞的损害越严重,神经细胞凋亡越多,血清CCCK-18 水平越高。
表2 不同病情患者入院时血清GSN、CCCK-18、NSE 水平比较(±s)Table 2 Comparison of serum levels of GSN,CCCK-18 and NSE in patients with different conditions at admission(±s)

表2 不同病情患者入院时血清GSN、CCCK-18、NSE 水平比较(±s)Table 2 Comparison of serum levels of GSN,CCCK-18 and NSE in patients with different conditions at admission(±s)
指标GSN(mg/L)CCCK-18(μ/L)NSE(ng/mL)出血量<15 mL 72.25±7.03 196.34±28.77 13.08±3.11 15~30 mL 58.97±6.27 241.06±32.56 19.42±3.47>30 mL 45.18±5.08 296.15±37.10 22.86±4.05 F 值153.861 77.909 69.615 P 值<0.001<0.001<0.001神经功能缺损程度轻度患者74.10±8.26 61.38±5.71 45.54±5.19中度患者192.08±25.14 236.23±30.29 287.39±36.37重度患者12.43±3.06 19.15±3.22 21.77±3.79 F 值151.627 82.030 74.613 P 值<0.001<0.001<0.001
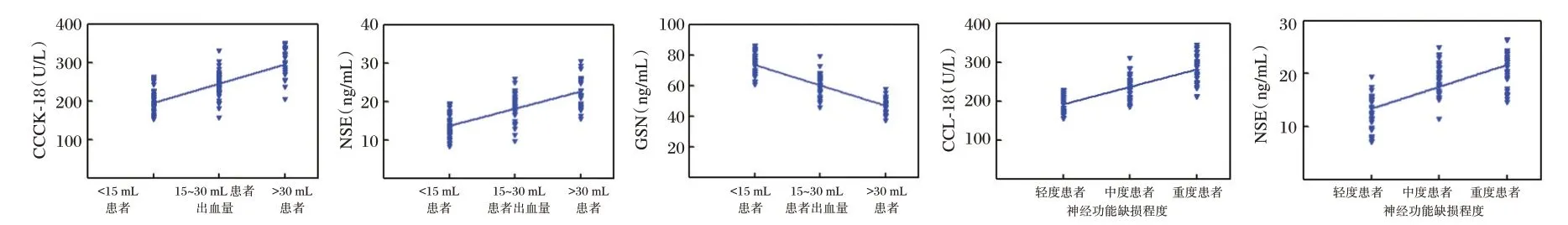
图1 入院时血清GSN、CCCK-18、NSE 水平与出血量、神经功能缺损程度相关性Figure 1 Correlation between serum GSN,CCCK-18 and NSE levels and the amount of blood loss and the degree of neurological impairment at admission
表3 两组入院时、治疗7 d 后血清GSN、CCCK-18、NSE水平比较(±s)Table 3 Comparison of serum GSN,CCCK-18 and NSE levels between 2 groups on admission and 7 days after treatment(±s)
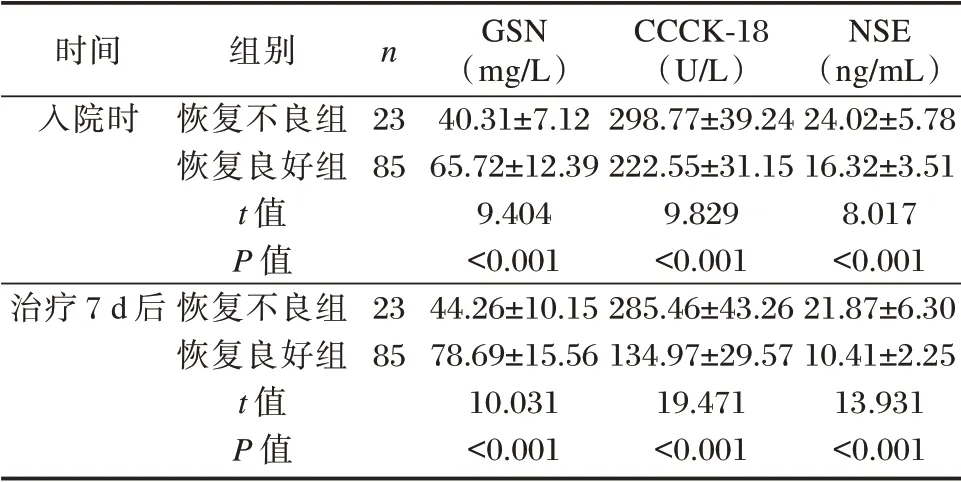
表3 两组入院时、治疗7 d 后血清GSN、CCCK-18、NSE水平比较(±s)Table 3 Comparison of serum GSN,CCCK-18 and NSE levels between 2 groups on admission and 7 days after treatment(±s)
时间入院时n 组别恢复不良组恢复良好组t 值P 值恢复不良组恢复良好组t 值P 值23 85治疗7 d 后23 85 GSN(mg/L)40.31±7.12 65.72±12.39 9.404<0.001 44.26±10.15 78.69±15.56 10.031<0.001 CCCK-18(U/L)298.77±39.24 222.55±31.15 9.829<0.001 285.46±43.26 134.97±29.57 19.471<0.001 NSE(ng/mL)24.02±5.78 16.32±3.51 8.017<0.001 21.87±6.30 10.41±2.25 13.931<0.001
本研究还发现,血清NSE 水平同样与HCH 患者入院时出血量、神经功能缺损程度呈正相关。NSE 是一种二聚体酶,主要表达与神经纤维线粒体或神经元细胞膜内,正常状态下人体血清NSE水平极低,在异常病理状态的损伤下,神经纤维膜破坏,NSE 无法与细胞内肌动蛋白结合而释放至细胞间隙,进而透过血脑屏障进入血液循环,引起血清NSE 水平明显升高[10]。相关研究[11]证实血清NSE 是反映脑组织实质性损伤的敏感性指标,与HCH 患者病情密切相关。支持本研究结果。

表4 HCH 患者神经功能恢复的影响因素Table 4 Factors influencing neurological function recovery in patients with HCH
此外,新近研究[12]指出急性脑出血患者血清GSN 明显降低,与患者神经功能缺损、出血量及预后密切相关,早期监测可作为判断病情和评估预后的重要指标。但GSN 与HCH 患者病情的关系尚未明确,本研究发现HCH 患者血清GSN 水平随出血量增加、神经功能缺损程度增加呈逐渐降低,其表达水平与HCH 病情呈负相关关系。GSN 是细胞骨架蛋白的重要成分,在人体内主要起清除肌动蛋白的作用,当机体发生组织损伤时大量肌动蛋白被释放,可阻塞微循环、促进血栓形成,加重组织损伤,GSN 则能迅速清除肌动蛋白从而降低其损伤作用,GSN 还可与促炎因子和大量生物活性结合,以清除这些因子造成的毒性作用,降低对机体的损害[13]。笔者认为,HCH 出血量越大、神经功能缺损程度越严重,机体消耗的GSN 量越多,从而导致血清GSN水平明显降低。本研究通过多因素分析发现入院时、治疗7 d 后血清GSN、CCCK-18、NSE 均是HCH患者神经功能恢复的影响因素,进一步证实GSN、CCCK-18、NSE 参与HCH 的病情进展。
综上可知,血清GSN、CCCK-18、NSE 水平变化与HCH 患者病情密切相关,且是影响患者神经功能恢复的影响因素。本研究为单中心研究,样本量较少,研究结果仍需通过多中心、大样本研究进一步验证。

