珠江水系光倒刺鲃Cyt b 基因的遗传变异分析
李文俊,李 强,钟良明
(1. 广州大学生命科学学院,广东 广州 510006;2. 韶关金粤水产科技有限公司, 广东 韶关 512335)
光倒刺鲃(Spinibarbus hollandi)隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)鲃亚科(Barbinae)倒刺鲃属(Spinibarbus),主要分布于我国华东和华南各水系中[1-3]。光倒刺鲃肉质细嫩、味道鲜美,具有较高的营养和药用价值,是一种重要的名优经济鱼类[4]。其随着人工驯养成功及多年的繁育推广,该品种已成为华南及华东等地重要的养殖鱼类之一。近年来,由于过度捕捞、环境污染及水利工程建设等原因,光倒刺鲃自然种群资源量不断减少,在我国许多江河已难觅其踪迹。面对这个现状,相关部门已经在一些主要分布水域建立光倒刺鲃自然保护区,对其加以保护,其中珠江水系中主要分布在流溪河、增江和漓江水 系[5-6]。目前对光倒刺鲃的研究主要集中在营养与繁殖[7]、生长特征[8]、功能基因[9-10]、线粒体基因组[11]等方面,而有关群体遗传结构、遗传多样性及亲缘地理关系等方面的研究报道较少[12-13]。
线粒体DNA 具有母系遗传、进化速度快和复制相对独立等特点,通常能够有效反映种群的遗传变异,是研究动物群体遗传学的合适分子标记[14]。部分线粒体基因已成为群体遗传学研究常用的分子标记,如:12SrRNA、16SrRNA、COI、Cyt b 基因和CR 区等[15-18]。而细胞色素b 基因(Cytochrome b gene,Cyt b)进化速率适中,是线粒体13 个蛋白编码基因中结构和功能被研究得最为清楚的基因之一,特别适用于不同区域种群水平差异的检测[19]。笔者采集珠江流域7 个光倒刺鲃群体共计241 个样本,通过测定和分析其线粒体Cyt b 基因序列,旨在更全面了解珠江流域光倒刺鲃遗传多样性和遗传结构现状,为合理进行光倒刺鲃渔业资源保护和利用提供理论基础和科学依据。
1 材料与方法
1.1 样品的采集
光倒刺鲃样品为2017—2018 年分别采自广东省广州市增城区(ZC)、广州市从化区(CH)、广东省韶关市(SG)、广东省阳山县(YS)、广西桂林市(GL)、广西河池市(HC)和广西崇左市(CZ),共计7 个群体241 尾,每个群体确保有30 尾以上以减少试验误差,并以地名拼音简写作为群体编号。样品鉴定根据《中国动物志 硬骨鱼纲 鲤形目》(下卷)[3]和《广东淡水鱼类志》[2]进行。详细样品信息见表1,采样点如图1 所示。
1.2 DNA 的提取及测序
光倒刺鲃基因组DNA 使用DNA 抽提试剂盒(生工生物工程股份有限公司,上海)提取。PCR 扩增采用自行设计的引物,其正反向引物序列分别为:F:5'-AG GAGAGGGATTAGACGCAA-3';R:5'-GGGAGTTAGGG GCGGAAG-3'。25 μL PCR 反应体系包括:12.5 μL 2× Taq PCR Master Mix [0.1 U Taq DNA Polymerase/mL、500 mmol/L dNTP each、50 mmol/L Tris-HCl(pH 8.7)、20 mmol/L KCl、4 mmol/L MgCl2]、3 μL 模板DNA、1 μL 引物(10 mmol/L)和7.5 μL ddH2O。PCR 程序设置为:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1.5 min,共35 个循环;72℃延伸10 min。PCR 结果用1%琼脂糖电泳检验后,由上海生工生物公司进行纯化、测序。
1.3 数据分析
通过DNASTAR Lasergene SeqMan Pro 程序[20]对序列进行拼接。使用Muscle 软件对已拼接序列进行比对分析,并辅以人工校对。利用MEGA 6.0[21]软件计算碱基组成特点和遗传距离。基于Kimura's-2-parameter 模型构建单倍型邻接法(neighbor-joining,NJ)进化树[22]。通过DnaSP 6.0 软件[23]和Arlequin 3.5软件包[24]统计各群体的核苷酸多样性(π)、单倍型多样性(Hd)、遗传分化系数(Fst)、分子变异分析(Analysis of Molecular Variance,AMOVA)和中性检验。使用Network 10.0 软件[25]构建单倍型网络图。
2 结果与分析
2.1 序列特征
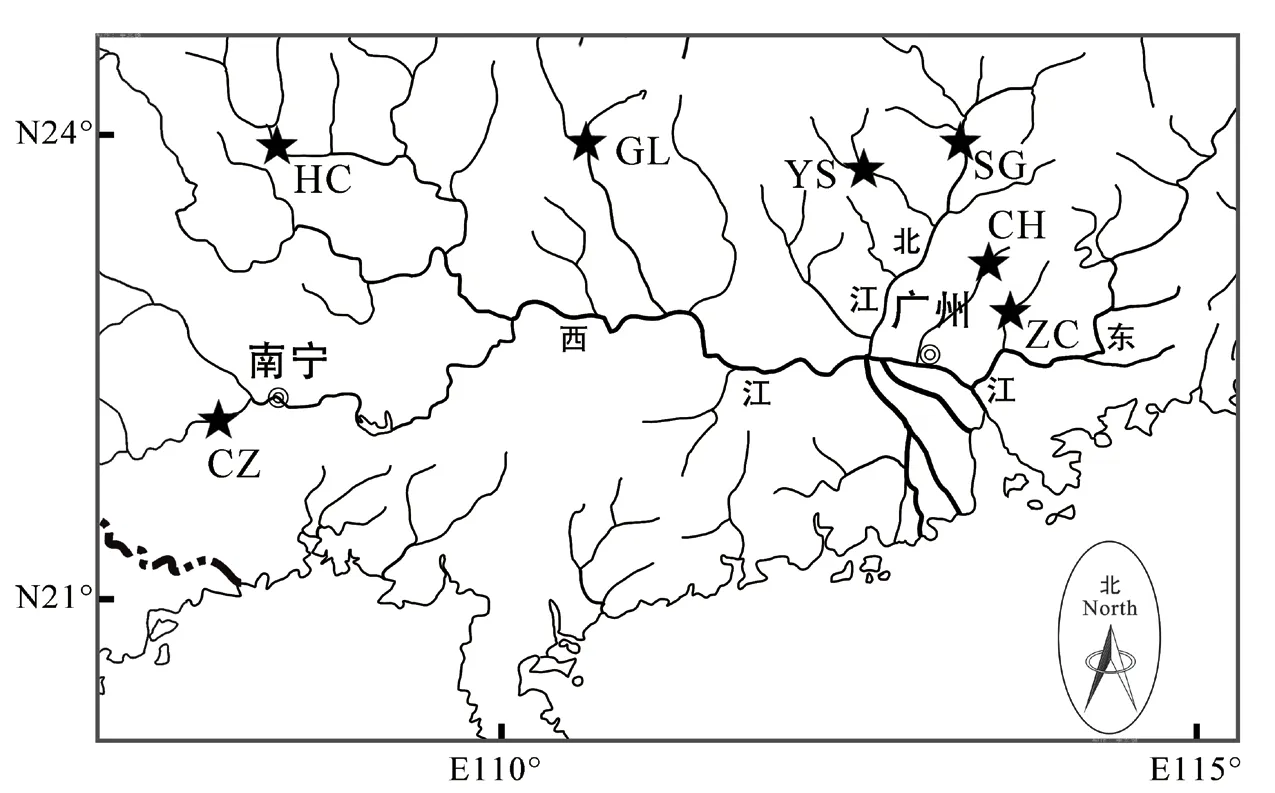
图1 光倒刺鲃采样点

表1 不同群体光倒刺鲃样品的采样点分布和遗传多样性
研究共得到241 条光倒刺鲃完整线粒体细胞色素b(Cyt b)基因序列,其长度为1 141 bp,其中T、C、A、G 占比分别为28.6%、27.7%、29.5%和14.2%,而G的含量明显低于其他3 种碱基。241 条序列中共有37个变异位点,包含35 个简约信息位点和2 个单核苷酸多态位点,无碱基插入或缺失情况。
2.2 遗传多样性分析
在241 条Cyt b 序列中,共定义了9 个单倍型(表1),其中4 个单倍型(H1、H2、H3、H4)为多群体共享的单倍型,尤其是单倍型H2由5个群体共享(CH、SG、YS、HC、CZ),另 有4 个 单 倍 型(H5、H6、H7、H8)为单个群体内多个个体共享,其余1 个单倍型(H9)仅存在于单个个体中。总体单倍型多样性为0.768±0.012。其中,阳山(YS)群体的单倍型多样性(0.597±0.059)最高,从化(CH)群体(0.541±0.071)、韶关(SG)群体(0.546±0.034)次之,而增城(ZC)群体(0)和桂林(GL)群体(0)最低;总体核苷酸多样性为0.010 5±0.005 2,其中韶关(SG)群体 (0.013 5±0.006 9)最高,从化(CH)群体(0.010 5± 0.005 4)次之,而增城(ZC)群体(0)和桂林(GL)群体(0)最低。
2.3 遗传距离及遗传分化
对241 条Cyt b 序列进行群体遗传距离和遗传分化指数分析,结果(表2)显示,7 个光倒刺鲃群体间的遗传距离为0.000 4~0.027 9,增城(ZC)群体与桂林(GL)群体间遗传距离最大,桂林(GL)群体与崇左(CZ)群体间遗传距离最小,其中增城(ZC)群体与其他群体间的遗传距离普遍比其他群体间距离大,为0.013 9~0.027 9;群体内的遗传距离为0(ZC、GL)~ 0.013 9(SG),群体内遗传距离明显比群体间小。7个光倒刺鲃群体间的遗传分化指数为0.066 2~1.000 0,增城(ZC)与桂林(GL)群体间遗传分化指数最大,增城(ZC)与河池(HC)群体间次之,崇左(CZ)与桂林(GL)群体间最小,除了崇左(CZ)与桂林(GL)、韶关(SG)与从化(CH)群体间存在较低的遗传分化外(0.05 <Fst <0.15),其他群体间均存在高度遗传分化(Fst >0.25)[26],而增城(ZC)群体与其他群体间遗传分化指数(0.503 1~1.000 0)普遍比较大。

表2 基于Cyt b序列光倒刺鲃的群体间遗传距离(对角线下)、群体内遗传距离(对角线)和遗传分化指数(对角线上)
2.4 单倍型网络分析
为了更好地了解光倒刺鲃的种群遗传结构,对9个单倍型进行亲缘关系网络分析,结果(图2)显示,亲缘关系网络图呈典型的星状分布,且各群体单倍型的聚集呈一定递进排列关系。上部分的单倍型主要来自西江水系(GL、HC、CZ)的群体或由西江与北江群体共享的单倍型,接着依次分布着北江水系(CH、SG、YS)群体特有单倍型,和北江与东江水系共享的单倍型。大多数单倍型之间只有1~2 步的变异,这些单倍型间亲缘关系较近。而东江水系(ZC)群体与部分北江水系(CH、SG)群体共享的单倍型H1 与其他单倍型间变异步数较大,达到27 步以上,说明单倍型H1 与其他单倍型间遗传分化较大。
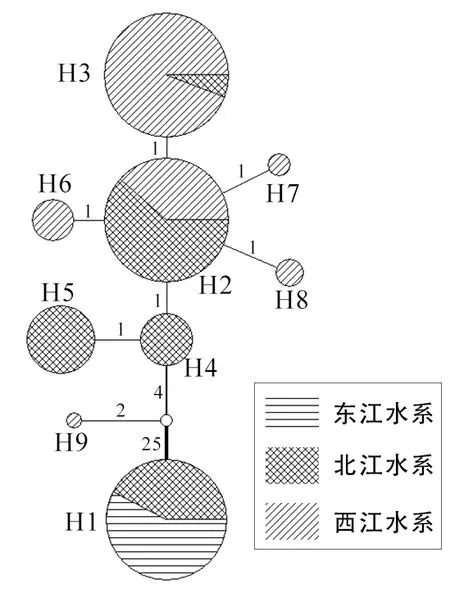
图2 基于Cyt b 基因的光倒刺鲃群体单倍型网络图
2.5 单倍型系统发育分析
为更好地探讨光倒刺鲃群体间的亲缘关系,构建9 个单倍型的系统发育树,结果(图3)显示,9 个单倍型聚集成A、B 2 个支系。其中支系A 包含a、b 2 个小分支,分支a 包含西江水系群体特有的单倍型(H6、H7、H8)和西江与北江水系群体共享的单倍型(H2、H3),分支b 包含北江水系群体特有的单倍型(H4、H5);支系B 包含CZ 个体特有的单倍型H9 和东江与部分北江水系群体共享的单倍型H1。

图3 光倒刺鲃群体基于Cyt b 基因序列的邻接法(NJ)进化树
2.6 分子变异分析(AMOVA)
通过AMOVA 可分析光倒刺鲃群体的变异分布模式[27]。将分布于东江水系(ZC 群体)、北江水系(CH、SG、YS 群体)和西江水系(GL、HC、CZ 群体) 的群体划分为3 个地理组群进行AMOVA 分析,结果如表3 所示,各区域分组之间的变异占61.32%,各区域分组内仅占12.66%,各采样群体内变异占26.02%, 表明7 个群体光倒刺鲃Cyt b 序列的遗传分化主要来 自于各地理分组之间和各群体内;各分组间(FCT=0.634 6, P <0.01)和各群体内(FST=0.696 0,P <0.01)的种群分化指数较高,各分组内(FSC=0.158 1,P <0.01)种群分化指数较低。

表3 光倒刺鲃分子变异(AMOVA)分析
2.7 种群动态分析
通过中性检验分析可推断种群是否经历过扩张事件。如果Tajima's D 与Fu's Fs 都为负值,且具有统计显著性,说明序列偏离了中性进化模型,该研究种群可能经历过扩张事件[28-29]。该研究对241 条Cyt b 序列进行中性检验分析,结果(表4)显示,崇左(CZ)的Tajima's D 为显著性负值,但其Fu's Fs 检验为正值,其余群体的Tajima's D 和Fu's Fs 检验均为正值或为负值但统计不显著(P >0.05)。这表明这珠江水系光倒刺鲃种群数量相对稳定,近期没有发生过种群扩张。
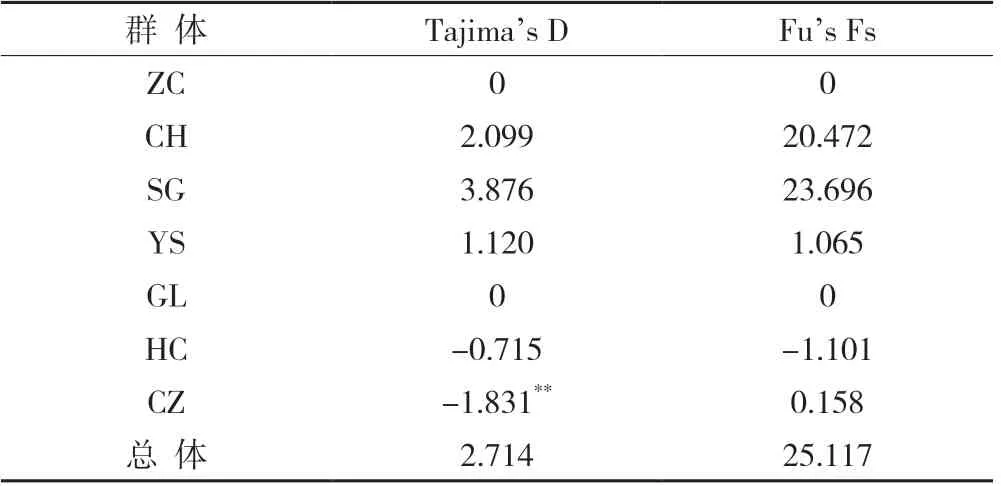
表4 基于Cyt b 序列光倒刺鲃群体的Tajima’s D 和Fu’s Fs 检验
3 结论与讨论
3.1 遗传多样性分析
遗传多样性指生物种内的遗传差异程度,是生命进化和适应的基础。丰富的遗传多样性能提高种群适应多样环境的能力,维持其稳定性,而缺乏遗传多样性会导致种群的生存面临威胁[30]。该研究241 尾光倒刺鲃样品的Cyt b 序列中,共有37 个核苷酸变异位点,定义了9个单倍型;总体单倍型多样性为0.768±0.012,总体核苷酸多样性为0.010 5±0.005 2。依据Grant等[31]对鱼类线粒体DNA 序列的单倍型多样性和核苷酸多样性的大小划分,北江支流的3 个群体(CH、SG、YS)具有中等的单倍型多样性,韶关(SG)群体和从化(CH)群体具有中等核苷酸多样性,其余群体具有较低的单倍型多样性和核苷酸多样性,尤其是增城(ZC)群体和桂林(GL)群体表现为非常低的单倍型多样性和核苷酸多样性。这表明珠江水系光倒刺鲃的遗传多样性整体处于较低水平,各群体中除了从化(CH)和韶关(SG)处于中等水平的遗传多样性外,其他5 个群体均表现为较低的遗传多样性。而中性检验结果表明,光倒刺鲃种群数量相对稳定,近期未发生种群扩增。因此,造成珠江水系光倒刺鲃群体多样性降低的原因,可能是珠江水系的光倒刺鲃种质资源受到了较严重的破坏。一方面,环境污染和不合理的捕捞方式可能直接导致其野生种质资源逐渐减少。另外,随着珠江流域大规模的水利建设,光倒刺鲃栖息环境不断萎缩和碎片化,其群体间基因交流受阻,这是珠江水系光倒刺鲃群体多样性降低的另一主要原因。为防止珠江流域光倒刺鲃种质资源的衰退,亟需采取有效的保护措施,保护其遗传多样性,以实现种质资源的可持续利用[32-33]。北江水系群体具有较高的群体遗传多样性,应将其作为重点保护区域。
3.2 光倒刺鲃群体遗传分化
遗传距离可反映不同种群或物种间的遗传变异程度。该研究中,光倒刺鲃各群体之间的遗传距离为0.000 4~0.027 9。其中增城(ZC)与其他群体间遗传距离为0.013 9~0.027 9,普遍比其他群体间距离大,表明增城(ZC)与其他群体间亲缘关系较远。遗传分化指数(Fst)常用于划分群体间的分化程度[26],此研究7个光倒刺鲃群体间的Fst为0.066 2~1.000 0 (P< 0.05),除了韶关(SG)与从化(CH)、崇左(CZ)与桂 林(GL)群体间存在较低的分化程度(0.05 <Fst < 0.15)外,其他群体之间均存在高度的遗传分化(Fst > 0.25)[26],尤其是增城(ZC)群体与其他群体间均具有较高的遗传分化指数(0.503 1~1.000 0),进一步说明增城(ZC)与其他群体间亲缘关系较远。把7 个群体划分成东江水系、北江水系和西江水系3 个区域分组进行统计时,AMOVA 分析显示,大部分(61.32%)的分子遗传变异来自于各地理分组之间,且各水系之间的群体遗传分化指数较大,表明这些水系之间的光倒刺鲃具有较明显的遗传分化。
单倍型网络图显示,绝大多数单倍型间只有1~2步的变异,说明这些单倍型间遗传分化较小。其中H2 属于北江(CH、SG、YS)和西江(HC、CZ)水系5 个群体共享的单倍型,其共享群体数最多,单倍型出现频率也最高(70 次),推测其为中心单倍型,其他单倍型可能由H2 突变演化而成。而H2 单倍型分化成H1 时,单倍型网络图上出现30 步的变异,H1 与H2 单倍型间产生较大的遗传分化。单倍型H1由增城(ZC)群体和北江水系(CH 和SG 群体)部分个体组成。这表明光倒刺鲃北江水系群体分别与东江和西江水系的群体具有较近的亲缘关系,而东江水系群体与西江水系群体亲缘关系较远。
单倍型NJ 树分析表明,9 个光倒刺鲃单倍型聚为A、B 2 个支系。其中A 分支中,由西江水系群体特有的单倍型和部分西江与北江水系群体共享的单倍型共同聚为一个小支系,再进一步与北江特有的单倍型聚为A 支系,节点支持率为98%,也说明北江水系群体与西江群体亲缘关系较近;支系B 主要是北江与东江群体共享的单倍型。这表明北江光倒刺鲃群体分别与东江、西江群体亲缘关系较近,而东江与西江群体亲缘关系较远。
从地理位置上看,西江与北江干流通过思贤滘联通,北江的光倒刺鲃群体可与西江群体发生基因交流,使得它们亲缘关系比较近。而狮子洋将东江与北江连接、并与西江隔离开来,间冰期海平面上升时,使东江与西江和北江群体发生隔离[34-35],而后面时期东江水系的光倒刺鲃又可以在潮汐交替时,通过狮子洋与北江群体接触,使得东江水系与北江水系的群体发生一定基因交流。因而,珠江流域复杂的地形地貌导致光倒刺鲃形成了较明显的地理隔离。

