一步水热合成Cu-SSZ-13分子筛选择性催化C3H6还原NO
王聪颖 周 皞 杨 迪 张 恒 赵辉爽 叶必朝 苏亚欣*,
(1东华大学环境科学与工程学院,上海 201620)
(2常州工程职业技术学院,常州 213164)
0 引 言
化石燃料燃烧过程中排放的氮氧化物(NOx)引起的光化学烟雾、对流层臭氧增加、大气酸沉降、硝酸盐气溶胶等,严重影响着大气环境质量和人类身体健康。人类活动产生的氮氧化物主要来自固定源(燃煤电厂等)和移动源(柴油机动车等)。在我国,柴油车尾气排放的NOx约占移动源总量的70%[1]。柴油车氮氧化物机外净化控制技术主要包括NOx催化分解技术、三效催化(TWC)、NOx储存还原(NSR)技术、选择性催化还原(SCR)技术,其中,SCR技术是最为成熟的柴油机尾气机外净化技术[2-4]。SCR技术分为氨选择性催化还原(NH3-SCR)技术和烃类选择性催化还原(HC-SCR)技术(HC为碳氢化合物)[5]。目前,NH3-SCR技术在柴油车净化系统中已广泛使用,但同时也存在一些问题,如氨具有一定的危险性、不易储存、价格昂贵等[6]。1990年,Iwamoto等[7]首次将Cu-ZSM-5催化剂应用于HC-SCR中。随后,分子筛类催化剂用于HC-SCR的研究得到了广泛关注[8-10]。此外,在贫燃条件下,柴油发动机的尾气中通常含有 0.05%NO、0.05%~0.1%HC、5%~10% O2和5%左右的H2O[11],如果将HC直接作为SCR过程的还原剂,可省去车载还原剂发生装置,且烃的来源广泛、环境友好。因此,HC-SCR是一种非常具有应用前景的柴油机车脱硝技术。
目前,用于柴油车尾气处理研究的铜基分子筛通常有Cu-β、Cu-ZSM-5、Cu-SAPO-34、Cu-SSZ-13等。Kwak等[12-14]研究发现,在NH3-SCR技术中,小孔径分子筛Cu-SSZ-13比大孔分子筛Cu-β和中孔分子筛Cu-ZSM-5具有更高的催化活性、选择性以及水热稳定性,在同样的反应条件下,在160~550℃内Cu-SSZ-13脱硝性能更为优异。Leistner等[15]研究表明,在低温(<100 ℃)条件下,Cu-SAPO-34的水热稳定性比Cu-SSZ-13分子筛要差,其Si—O—Al键容易断裂,从而导致分子筛骨架坍塌和催化剂失活。而在发动机冷启动时,SCR单元的实际温度往往要低于100℃,在含有大量水蒸气的情况下很容易造成Cu-SAPO-34失效,导致其在实际应用中受到限制。因此,Cu-SSZ-13分子筛催化剂凭借其优异的催化活性、较好的水热稳定性、较宽的温度窗口成为脱除柴油车尾气NOx的研究热点。
Cu-SSZ-13分子筛的合成方法通常分为两步合成法和一步合成法,不同的制备方法会影响催化剂中铜物种的存在形式,从而影响催化剂的脱硝性能。Zones等[16]以N,N,N-三甲基-1-金刚烷碘化铵为模板剂首次合成了SSZ-13分子筛,但晶化时间较长且模板剂价格昂贵、有毒,还需要通过离子交换或浸渍法将铜负载到SSZ-13分子筛载体上,步骤较为复杂,难以在工业中推广应用。为寻求更为经济可行的制备方法,Zhang等[17]使用环境友好的氯化胆碱代替N,N,N-三甲基-1-金刚烷氢氧化铵(TMAdaOH)作为模板剂,大大减少了SSZ-13分子筛的制备成本,但同样存在需要后续负载活性金属的问题。由于SSZ-13分子筛孔道尺寸较小(0.38 nm)且可交换位点有限,铜物种负载量不高,导致催化活性不高。Ren等[18-19]采用价格低廉、无毒的Cu-TEPA(TEPA为四乙烯五铵)作为模板剂一步水热合成Cu-SSZ-13分子筛催化剂。Cu-TEPA既作为模板剂又提供大量活性铜物种,制备出的催化剂铜含量高且分散良好,可显著提高催化活性。
考虑到一些烃类分子的尺寸(如CH40.38 nm、C2H40.39 nm、C3H60.4 nm)接近SSZ-13分子筛的孔径(0.38 nm),且沸石骨架一直处于振动状态,反应物分子(分子尺寸大于沸石孔径的20%)可以在反应温度高于100℃时进入沸石的孔道[20],因此在小孔SSZ-13沸石上进行HC-SCR反应是可行的[21-23]。在本工作中,我们以Cu-TEPA为结构导向剂合成Cu-SSZ-13分子筛催化剂,并用于催化丙烯选择性还原NO(C3H6-SCR)反应,考察不同nCu/nAl和nSi/nAl对其物理化学性质和C3H6-SCR脱硝性能的影响。
1 实验部分
1.1 Cu-SSZ-13催化剂的制备
采用一步水热合成法,以TEPA和CuSO4·5H2O形成的铜胺配合物为结构导向剂,制备Cu-SSZ-13系列催化剂。我们制备了2种系列的催化剂,一种是nSi/nAl=6、nCu/nAl=x的催化剂样品,标记为xCu-SSZ-13(6),其溶胶的投料 Na2O、Al2O3、SiO2、H2O、Cu-TEPA、聚乙二醇(PEG)的物质的量之比为5∶1∶12∶200∶x∶0.075(x=1.0、1.5、2.0、2.5、3.0);另一种是nCu/nAl=2、nSi/nAl=y的催化剂样品,标记为2.0Cu-SSZ-13(y),其溶胶的投料 Na2O、Al2O3、SiO2、H2O、Cu-TEPA、PEG物质的量之比为5∶1∶z∶200∶2∶0.075(y=z/2=4、5、6、7.5)。在制备过程中,首先将NaAlO2、CuSO4·5H2O、TEPA、NaOH、硅溶胶、PEG按顺序加入,连续搅拌形成溶胶,然后将所得溶胶移入聚四氟乙烯内衬的反应釜中,在140℃下晶化5 d,晶化完成后经过滤、洗涤、干燥得到粗产物。将粗产物与一定浓度的氯化铵溶液在80℃的水浴条件下交换6 h,经过过滤、洗涤、干燥后得催化剂原粉。经铵离子交换过程重复2次后,将其放入马弗炉中550℃下焙烧8 h,制得Cu-SSZ-13催化剂样品。
1.2 催化剂的活性测试
在固定床石英管微型反应器上进行Cu-SSZ-13催化剂的C3H6-SCR活性测试。测试时,先将催化剂样品(0.4 g,40~60目)置于石英管中部,将样品在300℃下N2气氛中预处理1 h,然后在150~600℃进行活性测试,每个目标温度下稳定30 min。活性测试的反应气体组成(V/V)为 0.05% NO、0.05% C3H6、10% O2、5% H2O(使用时)、0.02% SO2(使用时),N2为载气,总流量为 100 mL·min-1,反应空速(gas hourly space velocity,GHSV)为 15 000 mL·g-1·h-1。 NO、NO2、N2O、C3H6等气体浓度由FT-IR光谱仪(Thermo Nicolet IS10,配备有250 mL气体池)在线测定。
在C3H6-SCR活性测试中,NO转化率、C3H6转化率和N2选择性的计算公式如下:

其中,cgas,inlet、cgas,outlet代表固定床石英管微型反应器进口处、出口处各气体浓度,gas分别指NO、NO2、N2O和C3H6。
1.3 催化剂的表征
催化剂的物相和晶型结构通过X射线衍射(XRD,Rigaku,D/Max-2550PC型)进行测定,辐射源为 CuKα(λ=0.154 nm),管电压和管电流分别为 40 kV和200 mA,扫描范围为5°~80°。
采用MERLIN(ZEISS,德国)型扫描电子显微镜(SEM)测试催化剂的表面形貌,表征前对样品进行了干燥及喷金处理,加速电压为5 kV。
催化剂的织物特性通过N2吸附-脱附进行测定。采用Micromeritics公司生产的TriStar Ⅱ 3020型吸附仪,得到N2吸附-脱附等温曲线,吸附温度为-196℃。催化剂的比表面积、孔容、孔径由BET(Brunauer-Emmett-Teller)方程、BJH(Barrette-Joyner-Halenda)模型计算得出。
采用Agilent ICPOES730电感耦合等离子体(ICP)质谱仪测试催化剂中的金属含量,波长范围为167~785 nm,发射功率为1.0 kW,载气为Ar,等离子体气流量为15 L·min-1,检测模式为纵向观测。
催化剂的酸性通过氨气程序升温脱附实验(NH3-TPD)进行测定,采用AutoChem Ⅱ 2920型化学吸附仪,用He(30 mL·min-1)作为保护气,样品的用量为100 mg。首先将样品在550℃下吹扫1 h,降温至120℃。随后,样品在体积分数10% NH3/He混合气下吸附30 min,用He吹扫直至基线平稳。最后脱附实验是从室温升温至750℃,升温速率为10℃·min-1,脱附的NH3浓度由TCD热导池检测器测定。
催化剂的还原性能通过程序升温还原(H2-TPR)测定。采用AutoChem Ⅱ 2920型化学吸附仪,将150 mg样品在550℃的He(30 mL·min-1)气氛中预处理30 min,然后温度降至30℃后,用He吹扫直至基线平稳,还原过程在体积分数10% H2/Ar气氛下进行,以10℃·min-1的升温速率升至700℃,通过TCD热导池检测器记录信号值。
采用紫外可见近红外光谱仪(UV3600)测试催化剂的紫外可见光谱(UV-Vis),检测波长范围为200~800 nm,扫描模式为吸光度。
采用Bruker A300-10/12型波谱仪测试其电子顺磁共振(EPR)谱,以探究催化剂中磁性金属离子的配位环境,测试在77 K条件下进行。
2 结果与讨论
2.1 XRD表征
图1为不同nCu/nAl和nSi/nAl的Cu-SSZ-13催化剂的XRD图。可以看出一步水热合成的所有催化剂样品(除2.0Cu-SSZ-13(7.5)外)均呈现出典型的CHA型沸石的晶型结构(PDF No.47-0762,2θ=9.5°、14.0°、16.1°、17.8°、20.7°、25.0°)[24]。
从图1a中看出,随着nCu/nAl比值的增加,样品的特征峰强度,尤其是主峰((211)晶面)的强度呈现出先增强后减弱的趋势,说明nCu/nAl对SSZ-13分子筛的结晶度有一定的影响。需要注意的是,2.5Cu-SSZ-13(6)和3.0Cu-SSZ-13(6)样品的XRD图在35.6°、38.7°处出现了 CuO 的特征峰(PDF No.48-1548),说明随着nCu/nAl的增加(即铜含量的增加),分子筛中的铜物种可能会发生迁移和聚集,在孔道表面形成CuO团簇。Zhang等[25]研究认为原位水热合成的Cu-SSZ-13分子筛在主孔道八元环附近存在比较多的Cu2+离子,这些Cu2+会引起主孔道八元环的变形,从而削弱CHA晶体的XRD峰强度,这与图1a中的表征结果相一致,2.5Cu-SSZ-13(6)和3.0Cu-SSZ-13(6)样品的CHA结构特征峰均有着不同程度的减弱。范驰等[26]研究表明TEPA并不能起到促进CHA结构生成或者降低样品最终Cu含量的作用,只有Cu-TEPA以整体形式存在时才能得到具有CHA晶型的产物。本文中也得到了类似的结论,从图1a(nCu/nAl不同即nCu-TEPA/nAl不同)中可以看出,当nCu-TEPA/nAl=2时,样品的特征峰强度达到最大,而当nCu-TEPA/nAl为1、3时,样品的特征峰有较为明显的削弱,证明了Cu-TEPA含量对Cu-SSZ-13分子筛的晶型结构有一定的影响。
从图1b中看出,nSi/nAl对Cu-SSZ-13分子筛的晶型结构和结晶度有着很大影响,只有nSi/nAl在一定范围内时才能合成出特定的CHA拓扑结构分子筛,如2.0Cu-SSZ-13(4)、2.0Cu-SSZ-13(5)、2.0Cu-SSZ-13(6)催化剂都有着典型的CHA型结构。而当nSi/nAl进一步增大,合成的2.0Cu-SSZ-13(7.5)样品呈现出一种无定型结构,并没有形成CHA拓扑结构。根据文献报道[27-28],以Cu-TEPA为结构导向剂一步水热合成制备Cu-SSZ-13分子筛时,只适合合成富铝SSZ-13分子筛(合适的nSi/nAl=4~7.5)。SSZ-13催化剂六元环中的双Al位是容纳孤立态Cu2+的有利位置[29],而对于高硅SSZ-13催化剂而言,能够提供的离子交换位点相当有限,而Cu含量的增加不可避免地会导致铜物种的聚集,因此需要富铝SSZ-13分子筛来提供大量离子交换位点。在2.0Cu-SSZ-13(4)、2.0Cu-SSZ-13(5)和2.0Cu-SSZ-13(6)样品XRD图中均未出现CuO的特征峰,说明样品中Cu物种的分布比较均匀或者CuO物种的颗粒尺寸小于2 nm。此外,随着nSi/nAl的增大,样品的XRD峰强度有所增强,这可能与高Si含量的Cu-SSZ-13分子筛骨架缺陷位较少有关[30]。
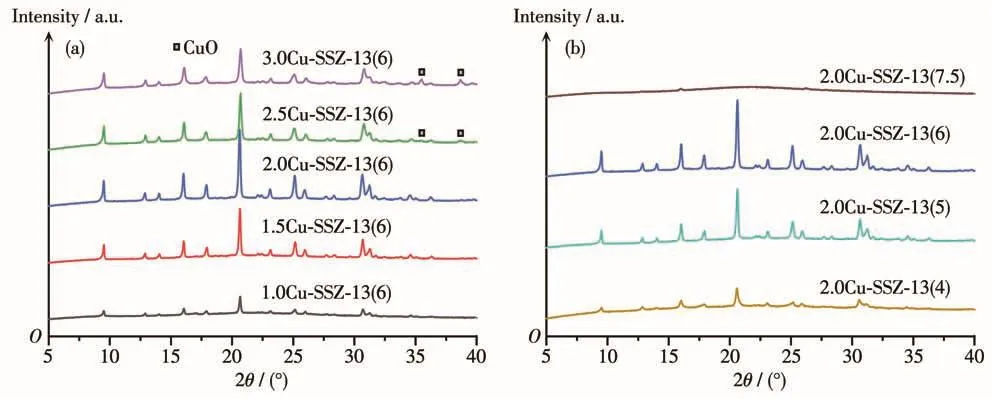
图1 不同n Cu/n Al(a)和n Si/n Al(b)的Cu-SSZ-13催化剂的XRD图Fig.1 XRD patterns of Cu-SSZ-13 catalysts with different n Cu/n Al(a)and n Si/n Al(b)
2.2 SEM表征
图2为各催化剂样品的SEM图(图2f为图2e的局部放大图),从图中可以直观地观察到Cu-SSZ-13催化剂的微观形貌。nCu/nAl和nSi/nAl对Cu-SSZ-13分子筛的晶型结构和微观形貌有一定的影响。由图2可见,随着nCu/nAl和nSi/nAl的变化,催化剂样品呈现出不同的集聚体形貌。对于不同nCu/nAl的催化剂而言,1.0Cu-SSZ-13(6)和1.5Cu-SSZ-13(6)呈现出花朵形状[19],同时发现1.0Cu-SSZ-13(6)样品的晶体结构不完整,表现出相对较低的结晶度,这与XRD图中其特征峰强度较弱相一致。随着nCu/nAl的增加,2.0Cu-SSZ-13(6)样品呈现出立方体形状,晶粒集聚较为紧密,其表面更加细化、致密,与反应气体的接触面积更大。而当nCu/nAl进一步增大,如2.5Cu-SSZ-13(6)和3.0Cu-SSZ-13(6)晶体表面上出现了不规则的纳米棒(图2e和2f),这可能是由于铜负载量过多,铜物种在分子筛表面发生团聚形成CuO纳米颗粒。以上2个样品的SEM表征结果与其XRD图中出现的CuO特征峰相一致。
对于不同nSi/nAl的催化剂而言,随着nSi/nAl的增加,Cu-SSZ-13分子筛的结晶度逐渐提高,相比于2.0Cu-SSZ-13(4)(从图2g可以看出其同样也呈现出花朵形状且XRD图中特征峰较弱)和2.0Cu-SSZ-13(5),2.0Cu-SSZ-13(6)呈现出更规则、更光滑的立方晶体形状,说明其结晶度有所提高,与XRD图结果相一致。

图2 不同n Cu/n Al(a~f)和n Si/n Al(c、g、h)的Cu-SSZ-13催化剂的SEM图Fig.2 SEM images of Cu-SSZ-13 catalysts with different n Cu/n Al(a~f)and n Si/n Al(c,g,h)
2.3 N2吸附-脱附表征
图3为Cu-SSZ-13分子筛催化剂的N2吸附-脱附等温线及孔径分布曲线。从图3a、3b中可以看出,Cu-SSZ-13样品的N2吸附量由0开始迅速升高达到饱和吸附平台,即N2吸附量达到稳定值,且催化剂的吸附和脱附过程几乎是可逆的。根据IUPAC分类,这类曲线属于第Ⅰ类等温线,说明合成的催化剂是典型的微孔结构。从图3c、3d中可以看出Cu-SSZ-13分子筛催化剂的孔径尺寸主要分布在1.7 nm左右。与其他样品不同的是,N2吸附-脱附等温线图中2.5Cu-SSZ-13(6)和3.0Cu-SSZ-13(6)样品在相对压力为0.4~0.99时伴随有滞后环,然而这2个样品的滞后环并没有明显的饱和吸附平台,表明滞后环是由沸石晶体颗粒堆积形成的狭缝状孔隙(图2d~2f)所产生[31]。表1列出了Cu-SSZ-13各催化剂的孔道结构参数以及经ICP测得的铜负载量。据表1可知,催化剂的比表面积和孔体积随nCu/nAl的增加,呈现出先增加后减小的趋势。2.0Cu-SSZ-13(6)样品具有最大的比表面积,这可能是因为其分子筛结晶度高和铜物种分散比较均匀,降低了对分子筛孔道的堵塞[32]。随着nCu/nAl的增加,2.5Cu-SSZ-13(6)和3.0Cu-SSZ-13(6)样品中铜负载量(质量分数)都超过了10%,同时他们的比表面积要小于2.0Cu-SSZ-13(6),可能是因为催化剂表面铜物种聚集生成的CuO物种部分堵塞了分子筛孔道。另外,在一定nSi/nAl范围内(nSi/nAl<6),样品比表面积和孔体积随着nSi/nAl的增大而增大。

图3 不同n Cu/n Al(a、c)和n Si/n Al(b、d)Cu-SSZ-13催化剂样品的N2吸附-脱附等温曲线及孔径分布曲线Fig.3 N2 adsorption-desorption isotherms and pore size distribution curves of Cu-SSZ-13 catalysts with different n Cu/n Al(a,c)and n Si/n Al(b,d)
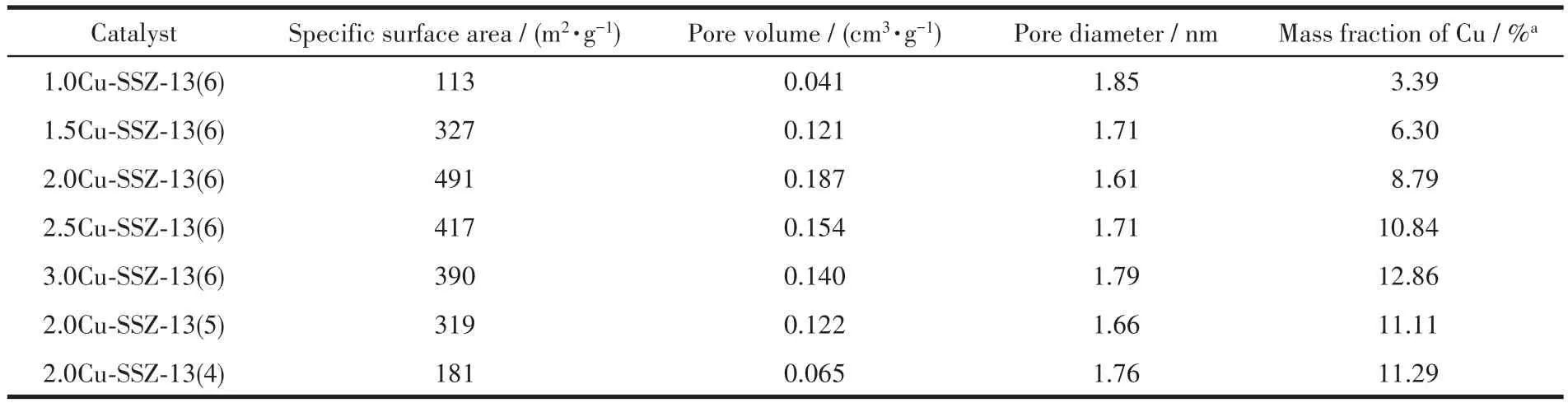
表1 Cu-SSZ-13催化剂的孔隙结构参数Table 1 Textural properties of Cu-SSZ-13 catalysts
2.4 NH3-TPD表征
图4为不同nCu/nAl及nSi/nAl的Cu-SSZ-13分子筛的NH3-TPD曲线。一般而言,Cu-SSZ-13催化剂主要在100~240℃、240~450℃和450℃以上3个温度区间内出现NH3脱附峰,分别可归属于表面物理吸附和吸附在弱Lewis酸位上的NH3脱附峰、吸附在孤立态Cu2+离子所产生的强Lewis酸位上的NH3脱附峰、吸附在强Brønsted酸位上的NH3脱附峰[33-36]。根据图4a可得,2.0Cu-SSZ-13(6)样品在335和585℃附近的NH3脱附峰峰面积及强度最大,说明其表面强Lewis酸、强 Brønsted酸在不同nCu/nAl的催化剂中是最强的。据图4b可得,200、335、585℃附近的NH3脱附峰峰面积及强度与nSi/nAl呈正相关,说明在一定范围内增加Cu-SSZ-13分子筛的nSi/nAl比值,对提高催化剂表面的弱Lewis酸、强Lewis酸和强Brønsted酸的强度有较为明显的增强作用。分子筛表面酸性会影响HC-SCR反应中NO和烃类气体的吸附和活化。Qian等[37]认为弱Lewis酸有利于提高SCR反应的低温活性,而强Lewis酸则易与NO结合形成配位体,从而提高催化活性。Yuan等[38]认为C3H6首先在Lewis酸位点活化,并产生乙酸盐等氧化物种,与催化剂表面的NO2-/NO3-/NO2反应生成有机含氮化合物,进一步生成反应中间体异氰酸酯(—NCO),最后在NO2氛围中生成N2。Li等[39]研究表明Lewis酸能够有效促进C3H6的活化和NO的吸附,部分C3H6在Lewis位点被氧化成甲酸盐、乙酸盐或其他氧化物,能更好地与吸附态的NO反应。Zhou等[40]和Yang等[41]认为吸附在Brønsted酸位上的C3H6可以被吸附的氧或者相邻铜位上的晶格氧所活化。因此,Cu-SSZ-13上丰富的酸性位可有效促进C3H6和NO的吸附和活化。此外,随着nCu/nAl的增加,2.5Cu-SSZ-13(6)和3.0Cu-SSZ-13(6)样品在400 ℃附近出现了一个较弱的脱附峰,属于吸附在CuO上的NH3脱附峰[42],NH3-TPD表征与XRD测试结果相符。
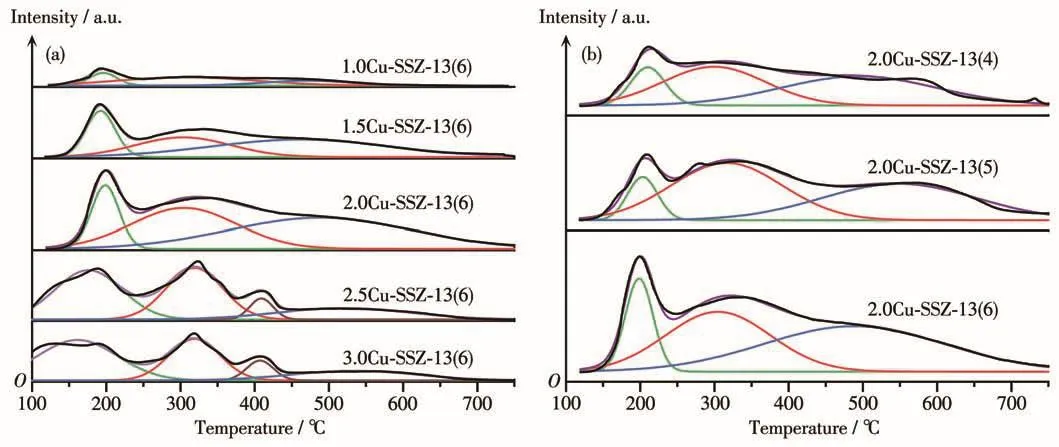
图4 不同n Cu/n Al(a)和n Si/n Al(b)的Cu-SSZ-13催化剂样品的NH3-TPD曲线Fig.4 NH3-TPD profiles of Cu-SSZ-13 catalysts with different n Cu/n Al(a)and n Si/n Al(b)
2.5 UV-Vis表征
图5为不同nCu/nAl催化剂的UV-Vis吸收谱图。从图5可以看出,催化剂样品在230 nm、320~370 nm、600~800 nm附近出现了紫外-可见光吸收带。在230 nm附近的吸收带归属于晶格O2-→孤立态Cu2+的电荷转移[43-44]。随着nCu/nAl的增加,2.0Cu-SSZ-13(6)、2.5Cu-SSZ-13(6)、3.0Cu-SSZ-13(6)在 230 nm 附近的吸收带的峰变宽且转向高波长,这可能是因为有更多的d轨道电子跃迁,导致紫外吸收峰发生红移[45]。在 320~370 nm 的吸收带归属于 O—Cu—O[46],而在600~800 nm左右的可见光吸收带则归属于分散CuO颗粒中的d-dCu2+跃迁[47]。随着nCu/nAl的增加,230 nm左右的吸收带逐渐增强,2.0Cu-SSZ-13(6)在此处的吸收带达到最强。当进一步增大nCu/nAl,2.5Cu-SSZ-13(6)、3.0Cu-SSZ-13(6)样品在 230 nm左右的吸收带逐渐减弱,而600~800 nm的吸收带逐渐增强,说明随着nCu/nAl的增加,孤立态的Cu2+离子逐渐转变为CuO物种。
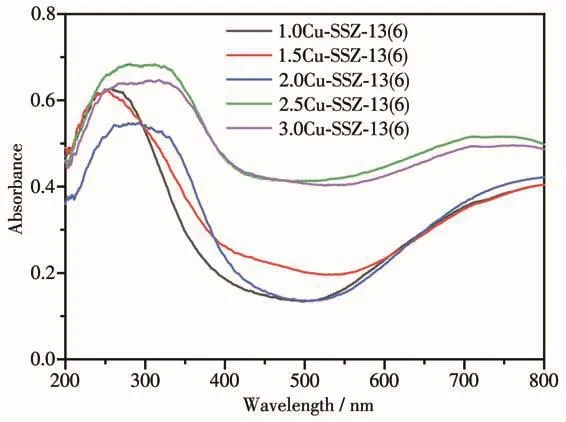
图5 不同n Cu/n Al的Cu-SSZ-13催化剂的UV-Vis吸收谱图Fig.5 UV-Vis absorption spectra of Cu-SSZ-13 catalysts with different n Cu/n Al
2.6 EPR表征
图6为不同nCu/nAl的催化剂在77 K时的EPR表征结果。在催化剂Cu-SSZ-13中,铜物种的可能存在形式有多种,比如孤立的Cu2+、Cu+和CuOx等,但只有Cu2+是具有一个未成对电子的顺磁离子,即只有Cu2+具有顺磁性,所以采用EPR(仅对孤立态Cu2+离子产生信号[48-50])对不同nCu/nAl的催化剂进行了表征。从图6可以看出Cu-SSZ-13催化剂均在g⊥≈2.06(各向异性g因子)出现孤立态Cu2+离子的信号峰(大约在3 400 G附近的高磁场区)。信号峰强度的大小可以反映出Cu2+离子含量的多少,随着nCu/nAl的增加,EPR信号峰强度在x=2时达到最强,这与UV-Vis的测试结果一致。Zhou等[40]认为Cu-SAPO-34催化剂骨架上的孤立态Cu2+有利于NO吸附和活化形成NO2-/NO3-中间物种,是C3H6-SCR反应的主要活性位。在3 394和3 431 G的高磁场场区出现了2个信号峰,且随着nCu/nAl比值的增加,3 394 G的信号峰占据主要地位,可能是Cu2+离子的迁移以及Cu2+离子之间的强偶极作用共同引起的[51]。EPR表征结果表明Cu-SSZ-13中Cu物种数量分布与铜含量有关,2.0Cu-SSZ-13(6)上孤立态的Cu2+离子含量相对较高。

图6 不同n Cu/n Al的Cu-SSZ-13催化剂的EPR谱图Fig.6 EPR spectra of Cu-SSZ-13 catalysts with different n Cu/n Al
2.7 H2-TPR表征
为进一步考察Cu-SSZ-13分子筛中铜物种的分布,采用H2-TPR表征来辨析不同Cu物种及其分布比例,图7为Cu-SSZ-13催化剂系列样品的H2-TPR表征结果。一般而言,在Cu-SSZ-13的H2-TPR谱图中出现的还原峰的温度越低,所对应的铜物种就越容易被还原,其催化还原能力就越强;而还原峰的面积越大,说明易被还原的铜物种就越多,能够提供的NO吸附和活化的位点就越多[52]。通过对图7进行Gaussian-Lorentzian分布解叠,得到了不同nCu/nAl和nSi/nAl的催化剂中各还原峰的面积及不同铜物种的相对比例,如表2所示。先前的研究表明,当Cu-SSZ-13催化剂中铜含量较低时,铜物种首先占据的是六元环中的位置[53-55],随着铜含量的增加,铜物种会逐渐占据靠近八元环的CHA笼中的位置[51,56]。不同Cu物种的TPR还原温度及还原过程有较大差异。孤立态Cu2+离子的还原需要经过2个步骤[25,51,57],首先在较低的温度下Cu2+离子还原成Cu+离子,达到一定温度后,Cu+离子进一步还原成Cu0,而CuOx氧化物在较低的温度下可一步还原成Cu0[51]。根据文献可知,190~210℃的H2还原峰归属于八元环中 Cu2+→Cu+的还原[58],2.0Cu-SSZ-13(6)在此温度下的H2还原峰面积最大且还原温度也相对较低(图7a)。295℃附近的还原峰则归属于CuO→Cu0的还原[17,48],在 2.0Cu-SSZ-13(6)上可观察到此还原峰,说明其分子筛表面存在少量的CuO,但XRD中并未检测到CuO的存在,说明该催化剂上CuO颗粒高度分散或尺寸小于2 nm。350~400℃的H2还原峰应归属于六元环中Cu2+→Cu+的还原[51,56],其相比于八元环中的Cu2+离子较难还原。对于不同nSi/nAl的催化剂而言,随着nSi/nAl比值的增大,在190~210℃的H2还原峰逐渐增强并且向低温移动(图7b),说明位于八元环中的Cu2+离子逐渐增多且还原能力增强。这与靠近八元环的CHA笼中的Cu2+离子更容易获得氢(因为它们更接近空隙开口)有关,从而有利于低温SCR活性的提高[51]。

图7 不同n Cu/n Al(a)和n Si/n Al(b)的Cu-SSZ-13催化剂的H2-TPR曲线Fig.7 H2-TPR profiles of Cu-SSZ-13 catalysts with different n Cu/n Al(a)and n Si/n Al(b)

表2 不同n Cu/n A l和n Si/n A l的Cu-SSZ-13催化剂中各种铜物种的百分比(P)及峰面积(S p)Table 2 Percentages(P)and peak areas(S p)of various copper species over Cu-SSZ-13 catalysts with different n Cu/n Al and n Si/n Al
2.8 C3H6-SCR活性测试
图8为不同nCu/nAl和nSi/nAl的Cu-SSZ-13催化剂的C3H6-SCR活性测试结果。由图8a可知,随着nCu/nAl的增大,在不同温度范围内催化剂的C3H6-SCR活性会受到不同程度的影响。如在低温(150~350℃)条件下,催化剂的活性顺序为2.0Cu-SSZ-13(6)>2.5Cu-SSZ-13(6)>3.0Cu-SSZ-13(6)>1.5Cu-SSZ-13(6)>1.0Cu-SSZ-13(6)。而在高温(350~600 ℃)条件下,催化剂的活性顺序为1.5Cu-SSZ-13(6)>2.0Cu-SSZ-13(6)>3.0Cu-SSZ-13(6)>2.5Cu-SSZ-13(6)>1.0Cu-SSZ-13(6)。在所有的催化剂中,2.0Cu-SSZ-13(6)催化剂表现出最佳的C3H6-SCR活性,在250~300℃时NO转化率可达到100%,同时活性温度窗口(NO转化率大于80%时)最宽。根据ICP分析的结果(表1)可知,2.0Cu-SSZ-13(6)催化剂中Cu负载量为8.79%,要低于nCu/nAl=2.5、3.0的2个催化剂样品的Cu负载量,但却表现出更好的脱硝活性,说明在Cu-SSZ-13催化剂上适宜的Cu负载量有利于C3H6-SCR脱硝反应。随着铜负载量的增大,铜物种会在催化剂表面形成CuO 物种(图1a、图2d~2f),在高温下会促进 C3H6和O2发生非选择性的燃烧反应,从而导致NOx转化率下降。Zhang等[17]使用氯化胆碱作为模板剂,采用两步法制备Cu-SSZ-13分子筛用于NH3-SCR,NO转化率最高可达到95%。Han等[59]使用TMAdaOH做为模板剂合成SSZ-13分子筛,并采用CuCl2溶液进行离子交换得到Cu-SSZ-13,NO转化率最高可超过90%。Zhou等[40]利用Cu-TEPA做为模板剂制备出Cu-SAPO-34分子筛用于C3H6-SCR,在300~400℃时NO转化率接近100%,但活性温度窗口较窄。本文中制备的Cu-SSZ-13分子筛在200℃时NO转化率即超过80%,在250~300℃可实现100%脱硝效率及~100%的N2选择性。可以看出,以Cu-TEPA为模板剂一步水热合成制备的Cu-SSZ-13分子筛具有更优异的低温脱硝活性。
由图8d可知,nSi/nAl对Cu-SSZ-13催化剂的C3H6-SCR活性有一定影响。所有样品(除2.0Cu-SSZ-13(7.5)外)均表现出优异的脱硝性能,尤其是2.0Cu-SSZ-13(5)和2.0Cu-SSZ-13(6),其在250~300℃温度内NO转化率达到了100%。当反应温度低于250℃时,适量的增加nSi/nAl可明显改善催化剂低温脱硝活性。如在200℃时,2.0Cu-SSZ-13(4)的NO转化率仅为39.4%,而2.0Cu-SSZ-13(5)和2.0Cu-SSZ-13(6)的NO转化率则分别达到73.8%和83.4%,这可能与其具有更多的八元环中孤立的Cu2+离子有关,催化剂上铜物种的种类及分布是影响HC-SCR活性的重要因素[39]。从表1、表 2和图4b可知,2.0Cu-SSZ-13(4)和2.0Cu-SSZ-13(5)样品的铜负载量及酸性较为接近,而八元环中的Cu2+离子的分布比例差异较大(分别为22.2%和34.2%)。造成两者低温活性有显著差异的主要原因可能是活性铜离子的数量。2.0Cu-SSZ-13(5)样品中有更多的八元环Cu2+离子,因此具有更好的低温活性。而当温度高于350℃时,2.0Cu-SSZ-13(5)样品的脱硝效率略高于2.0Cu-SSZ-13(6)样品,可能与其位于六元环的Cu2+离子数量更多有关(图7b)。而当nSi/nAl增大到7.5时,2.0Cu-SSZ-13(7.5)催化剂样品几乎没有活性,这与其没有形成Cu-SSZ-13分子筛的拓扑结构有关(图1b)。由此可见,2.0Cu-SSZ-13(6)催化剂上具有适宜的铜负载量及分布最多的八元环Cu2+离子(47.1%),这可能是其具有最佳脱硝活性的主要原因。
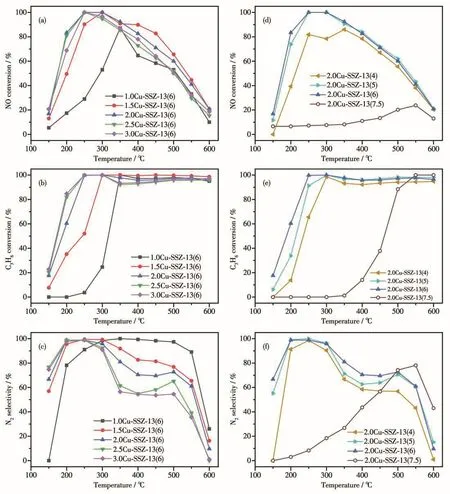
图8 不同n Cu/n Al和n Si/n Al的Cu-SSZ-13催化剂的NO转化率(a、d)、C3H6转化率(b、e)和N2选择性(c、f)Fig.8 NO conversion(a,d),C3H6 conversion(b,e)and N2 selectivity(c,f)of Cu-SSZ-13 catalysts with different n Cu/n Al and n Si/n Al
Cu-SSZ-13催化剂上C3H6转化率如图8b、8e所示。当反应温度低于300℃时,各催化剂的NO转化率和C3H6转化率具有相似的变化规律,说明此时的C3H6主要用于NO的还原反应。在此温度范围内,对于不同nSi/nAl的Cu-SSZ-13催化剂,2.0Cu-SSZ-13(6)上C3H6转化率是最高的(图8e),这可能与其具有最强的强Lewis和强Brønsted酸有关。从表2和图8b可知,当反应温度低于300℃时,2.0Cu-SSZ-13(6)的C3H6转化率要明显高于1.5Cu-SSZ-13(6),而两者的八元环中Cu2+离子分布比较接近(分别为46.8%和47.1%),说明可能是2.0Cu-SSZ-13(6)更强的表面酸性促进了C3H6的高效活化[39]。当温度高于300℃后,在各催化剂上NO转化率出现了明显下降,而对应的C3H6转化率基本稳定。说明当反应温度升高后,有部分的C3H6发生了燃烧反应,用于选择性还原NO反应的C3H6的量有所减少。Cu-SSZ-13分子筛上C3H6-SCR反应的N2选择性如图8c、8f所示,可以发现Cu-SSZ-13催化剂都具有较高的N2选择性。当反应温度超过500℃时,通过FT-IR光谱仪在线测量,发现在高温反应中生成了少量的NO2,因此造成N2选择性有所下降。
根据前文系列表征结果可知,在一步水热合成的Cu-SSZ-13上主要存在3种不同的铜物种,分别是分子筛八元环中Cu2+、六元环中Cu2+和CuO物种。结合C3H6-SCR反应测试数据分析,发现在Cu-SSZ-13八元环中的孤立态Cu2+离子对其低温脱硝活性影响最大。根据不同nCu/nAl和nSi/nAl的Cu-SSZ-13催化剂上铜负载量及八元环Cu2+离子的百分比(表1和表2)和催化剂的NO转化率(图8),可以得到在200℃时Cu-SSZ-13催化剂上八元环中Cu2+离子含量与NO转化速率之间的关系图,如图9所示。不同nCu/nAl和nSi/nAl的Cu-SSZ-13样品上NO的转化速率均与八元环中孤立Cu2+离子的数量呈现一种正相关的关系,随着八元环中Cu2+离子数量的增加,200℃时C3H6-SCR反应的NO转化速率有所增加。以上结果进一步表明,Cu-SSZ-13分子筛八元环中的孤立Cu2+离子可能是C3H6-SCR反应的主要活性位。

图9 200 ℃时不同n Cu/n Al(x=1.5、2.0、2.5、3.0)(a)和n Si/n Al(y=4、5、6)(b)的Cu-SSZ-13分子筛催化剂八元环中Cu2+含量与NO转化速率之间的关系Fig.9 Correlations of the NO conversion rate at 200℃with the content of isolated Cu2+located in 8-membered rings on Cu-SSZ-13 catalysts with different n Cu/n Al(x=1.5,2.0,2.5,3.0)(a)and n Si/n Al(y=4,5,6)(b)
2.9 催化反应机理研究
利用原位红外光谱技术,初步分析了Cu-SSZ-13催化剂上C3H6-SCR催化脱硝反应机理。图10是2.0Cu-SSZ-13(6)催化剂在250℃逐时吸附NO+O2、逐时吸附C3H6+O2和催化剂150~400℃吸附NO+O2+C3H6的红外谱图(图10a、10b、10c)。从图10a中可以看出,随着NO的吸附,出现了归属于桥式硝酸盐(1 044和1 132 cm-1)、单齿硝酸盐(1 282和1 594 cm-1)和吸附NO2物种(1 696 cm-1)的红外特征峰[60-61]。3 603 cm-1处的负吸收峰则归属于结构羟基群中的O—H振动。从图10a可知,通入NO+O2后很快出现各种含氮物种的红外吸收峰,说明催化剂中的酸性位为NO提供了大量的吸附中心[62]。从图10b可以看出,随着C3H6的吸附,在1 280、1 442和1 589 cm-1处出现红外特征峰,分别归属于碳酸盐物种和醋酸盐物种,在2 949、3 106 cm-1处出现了2个红外特征弱峰,分别归属于甲酸盐物种、—CH2振动[63-64]。从图10c中可以发现,随着温度的升高,别归属于桥式硝酸盐和单齿硝酸盐[65]的吸收峰1 266和1 595 cm-1逐渐出现,并在250℃时达到最强,350℃时吸收峰开始减弱,可能是因为在高温下逐渐脱附。当反应温度为100~200 ℃时,在1 139、1 463、1 668 cm-1处出现的红外特征峰开始出现,分别归属于桥式硝酸盐、醋酸盐和吸附态NO2[40]。需要注意的是,当温度超过250℃时,以上3处的特征峰都逐渐消失,而归属于异氰酸酯(R—NCO)的2 268 cm-1处的特征峰开始出现并逐渐增强,表明醋酸盐物种与吸附态NO2和活性硝酸盐物种反应并逐渐转化为R—NCO物种。Dorado等[66]研究表明,R—NCO可与NO+O2最终反应生成N2。此外,随着反应温度的升高,归属于CO2的红外特征峰(2 368 cm-1)逐渐增强,这是由于高温条件下C3H6发生了非选择性的燃烧反应。
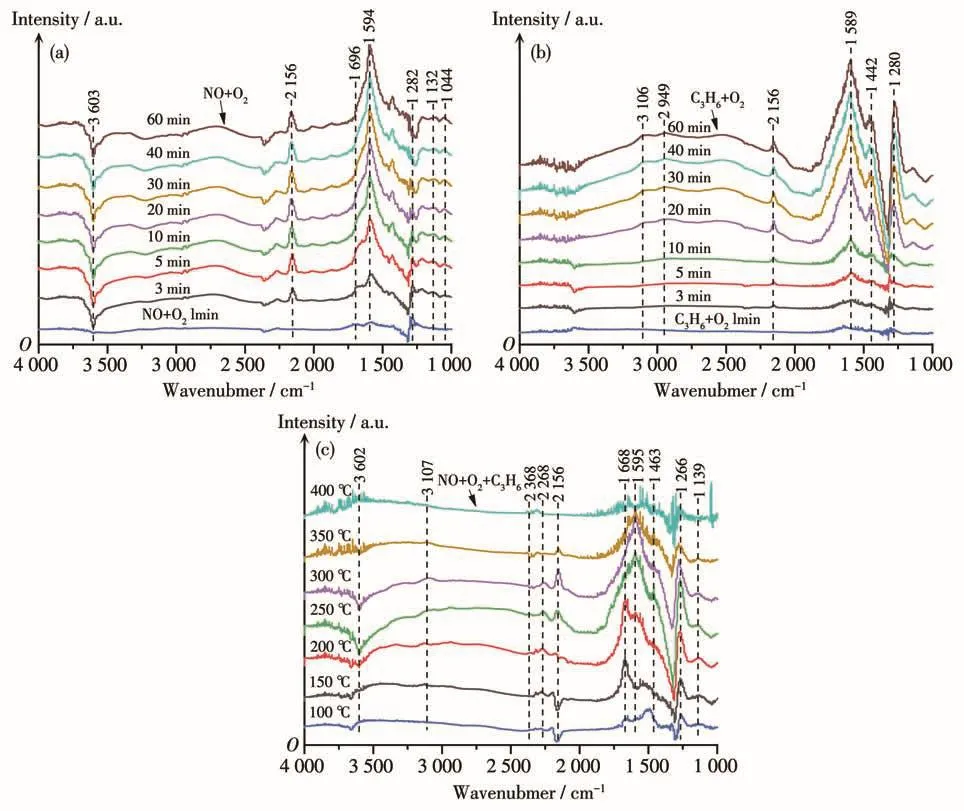
图10 2.0Cu-SSZ-13(6)催化剂上吸附NO+O2(a)、C3H6+O2(b)和NO+O2+C3H6(c)的原位红外谱图Fig.10 In situ infrared spectra of adsorbed species on 2.0Cu-SSZ-13(6)after exposure NO+O2(a),C3H6+O2(b)and NO+O2+C3H6(c)
2.10 H2O和SO2对脱硝活性的影响
在贫燃条件下,柴油车尾气中都会含有一定量的H2O和SO2,因此研究H2O和SO2对Cu-SSZ-13分子筛催化剂脱硝活性的影响十分重要。选取2.0Cu-SSZ-13(6)进行了抗水和抗硫脱硝性能实验。从图11中可以看出,Cu-SSZ-13分子筛催化剂具有较好的抗H2O、抗SO2性能。当反应中加入了体积分数5%的H2O后,脱硝效率曲线与无水蒸气时相似,甚至在150~250℃低温时的脱硝活性得到了一定程度的提高,这可能是因为水与Cu2+离子之间的相互作用削弱了Cu2+离子与晶格氧之间的相互作用,使得部分Cu2+离子移向靠近八元环的CHA笼中,变得更加容易还原[51,67-68]。也有文献报道认为,水蒸气的存在会促使SCR反应中间体异氰酸酯水解成NH3,从而有利于HC-SCR反应[69]。然而,当温度高于300℃以后,脱硝效率略有下降,这可能是因为H2O和C3H6在活性位上产生了竞争吸附,有更多的C3H6与O2发生了非选择性的燃烧反应[70]。当反应中引入了0.02% SO2后,在150~250℃的脱硝活性受到了轻微抑制,活性窗口整体向高温段移动了近50℃,当温度高于400℃时脱硝活性明显下降。Zhou等[70]采用原位红外手段研究烟气中SO2对Fe/Al2O3/CM(CM为堇青石)催化剂的HC-SCR性能影响,研究发现吸附的SO2会在催化剂表面形成硫酸盐物种,覆盖部分活性位,从而导致催化剂的活性受到抑制。因此,通入SO2后2.0Cu-SSZ-13(6)的脱硝性能下降,可能与SO2竞争吸附在催化剂表面形成硫酸盐物种有关。
3 结 论
采用铜胺配合物(Cu-TEPA)作为结构导向剂,一步水热合成Cu-SSZ-13用于丙烯选择性催化还原NO。实验研究了不同nCu/nAl和nSi/nAl对Cu-SSZ-13催化剂的物理化学特性和脱硝性能的影响,并利用原位红外光谱技术分析了Cu-SSZ-13催化剂上C3H6-SCR反应机理。研究表明,当nCu/nAl=2、nSi/nAl=6时Cu-SSZ-13具有优异的低温脱硝活性,在贫燃条件下,200℃时NO转化率超过80%,在250~300℃可实现100%脱硝效率及~100% N2选择性,同时还具有较强的抗水、抗硫性能。SSZ-13分子筛八元环中孤立的Cu2+离子具有良好的氧化还原性能,是C3H6-SCR反应的主要活性位。同时,Cu-SSZ-13催化剂表面上丰富的强Lewis酸和强Brønsted酸有效促进了C3H6和NO的吸附和活化,从而提高了脱硝反应活性。随着分子筛nCu/nAl的增加,孤立的Cu2+离子会在分子筛表面迁移集聚形成CuO物种,从而导致C3H6-SCR性能下降。

