右美托咪定介导Wnt通路对七氟醚诱导的新生大鼠认知功能障碍的影响
杨 悦,杨 磊 ,吴 昱 ,袁 军
1武汉市中西医结合医院 武汉市第一医院麻醉科,武汉 430022 2华中科技大学同济医学院协和医院麻醉科,武汉 430022
七氟醚无刺激性且对血液动力学影响较小,是目前临床上广泛使用的婴幼儿吸入性麻醉药[1- 2]。但目前有动物实验表明,七氟醚的吸入会导致新生动物神经元凋亡、认知障碍等情况出现[3- 4]。因此,接受七氟醚麻醉后可能会对新生儿神经系统的结构以及功能造成损伤。探究降低七氟醚麻醉后对大脑认知功能的影响的具体机制,对降低七氟醚不良反应具有非常重要的作用。右美托咪定(dexmedetomidine,Dex)是一种有效的α2受体激动剂,具有镇痛、镇静和抗焦虑等作用[5]。目前Dex常用于重症监护室中作为全身麻醉的辅助药物,从而减少麻醉剂量,并发挥镇痛与镇静的效果[6- 7]。但目前Dex对大脑认知功能障碍的改善机制尚未完全明确。Wnt信号通路是经典的信号通路之一,其分为经典Wnt信号通路和非经典Wnt信号通路[8]。Wnt信号通路对机体的正常发育具有非常关键的作用。目前多项研究表明,Wnt信号通路对海马可塑性以及记忆功能具有重要的调控作用[8- 11]。有研究表明七氟醚可通过有效抑制Wnt信号通路成员的表达,进而促进海马细胞凋亡[12]。前期研究中,笔者发现Dex处理大鼠后,Wnt信号通路成员β-链蛋白表达发生了明显的变化,因此推测Dex可能会通过影响Wnt信号通路的表达,进而影响大脑认知功能。本研究对新生SD雄性幼鼠进行七氟醚处理,构建新生大鼠认知功能障碍模型,并通过一系列处理,探究Dex对七氟醚诱导的新生大鼠认知功能障碍的影响机制。
材料和方法
实验动物饲养及模型制备60只出生7 d SD雄性幼鼠,约15g,购于斯莱克景达动物公司。置于恒温恒湿环境中,分笼饲养,标准饲料无菌水饲养1周适应环境。动物应用随机数字法分为5组,每组12只:正常对照组、七氟醚处理组、Dex处理组、七氟醚+Dex处理组、七氟醚+Dex处理+Wnt抑制剂组。
模型制备:Dex处理组、七氟醚+Dex处理组腹腔注射25 μg/kg的Dex,七氟醚+Dex处理+Wnt抑制剂组腹腔注射25 μg/kg的Dex及2 kg/ml的Wnt抑制剂XAV393 100 μl,其余组注射等体积的生理盐水。30 min后将大鼠放入封闭的塑料箱内,七氟醚处理组、七氟醚+Dex处理组、七氟醚+Dex处理+Wnt抑制剂组吸入3%的七氟醚加21%的O2(2 L/min)持续4 h。Dex处理组和正常对照组暴露在新鲜的空气下同样时间,实验结束后所有大鼠放回笼子常规饲养。
行为学实验结束后,腹腔注射2%戊巴比妥钠(80 mg/kg),每组取6只,4%多聚甲醛进行心脏灌注,取大脑组织,甲醛固定,用于组织切片。其余6只断头处死大鼠,取海马组织,冻于液氮中,用于后续实验[13]。
荧光定量PCR 检测相关基因表达冻存的海马组织从液氮取出,磨成粉末状,再加入1 ml Trizol(货号:15596026;Invitrogen;USA),按照说明书指示提取总RNA,随后测定仪测浓度。以2 μg RNA为模板进行反转录(TaKaRa,Japan),按说明逆转录得到cDNA。采用SYBR®Premix Ex TaqTM(TliRNaseH Plus)试剂盒(TaKaRa,Japan)于ABI7500定量PCR仪(Thermo,USA)上进行荧光定量PCR实验,反应条件:95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸40 s,40个PCR循环。测定扩增条带的吸光度值,并用其与GAPDH吸光度的比值表示产物mRNA的相对含量。反应中所用的引物如表1所示,引物均由上海吉玛制药技术有限公司提供。
蛋白质免疫印迹检测相关蛋白表达冻存的海马组织从液氮取出,称重后加入含有蛋白酶抑制剂的蛋白裂解液的环氧树脂管内,用电动研磨棒磨成匀浆,离心取上清,重辛酸测蛋白浓度。进行聚丙烯酰胺凝胶电泳(80 V 30 mim,120 V 60 min),电泳完成后转移到聚偏二氟乙烯膜(Merck Millipore,USA)上,5%封闭液室温封闭2 h,磷酸盐吐温缓冲液(phosphate Tween buffer solution,PBST)洗涤后,加入一抗:Wnt3a 兔单抗(1∶1000;ab219412,Abcam;UK)、β-链蛋白兔多抗(1∶2000;ab6302Abcam;UK)、P(ser9)-GSK- 3β兔多抗(1∶500;ab131097;Abcam;UK)、GSK- 3β鼠单抗(1∶500;ab93926;Abcam;UK)、Cleaved 半胱氨酸蛋白酶- 3兔多抗(1∶1000;9664;CST;USA),Bax兔单抗(1∶1000;14796;CST;USA),Bcl- 2鼠单抗(1∶2000;964495;Abcam;UK),GAPDH兔单克隆抗体(1∶10 000;ab181602;Abcam;UK),4 ℃孵育过夜后,PBST[含0.1% Tween- 20的磷酸盐缓冲溶液(phosphate buffer saline,PBS)]缓冲液洗膜3次,每次15 min。随后加入辣根过氧化物酶标记的羊抗兔、羊抗鼠(1∶10 000,Jackson,USA)室温孵育1 h,PBST缓冲液洗膜3次,每次10 min。将膜浸入电化学发光反应液(美国Pierce公司)中,室温1 min。机器显影。利用ImageJ软件进行蛋白条带灰度扫描,各实验组与内参相比后进行统计分析。
神经核免疫组织化学染色4%甲醛中固定,酒精脱水后石蜡包埋(5 μm),确定海马组织位置后采取冠状位连续切片,进行神经核(neuronal nuclei,NeuN)染色:脱蜡、水化及抗原修复后,3%过氧化氢室温孵育30 min,血清封闭30 min,加入小鼠抗NeuN(1∶100,Millipore,USA),37 ℃孵育10 min,PBS洗涤3次,生物素化羊抗鼠IgG孵育1 h,PBS洗涤3次辣根过氧化物酶标记的亲和卵白素孵育1 h(Jackson,USA),PBS洗涤3次,二氨基联苯胺显色,光镜观察,在500 μm×300 μm区域统计各组海马组织NeuN阳性细胞数。
TdT介导的dUTP缺口末端标记实验染色按照TdT介导的dUTP缺口末端标记实验(TdT mediated dUTP nick end labeling,TUNEL)检测试剂盒(C1088,碧云天)说明,取大脑组织切片,60 ℃烘烤2 h,经二甲苯、无水乙醇梯度浸泡脱蜡和水化。3%过氧化氢室温孵育10 min。加入免疫染色液稀释后的蛋白酶K,37 ℃消化30 min,PBS洗3次。在样品上加50 μl TUNEL检测液(TdT酶5 μl 、荧光标记液45 μl、TUNEL染色液50 μl),37 ℃避光孵育1 h,PBS清洗3次。抗荧光淬灭封片液封片后荧光显微镜下观察。每只鼠取3个切片,每个切片随机取6个视野,平均法统计凋亡细胞,计算公式如下:细胞死亡率=死亡神经元细胞总数/细胞总数×100%。
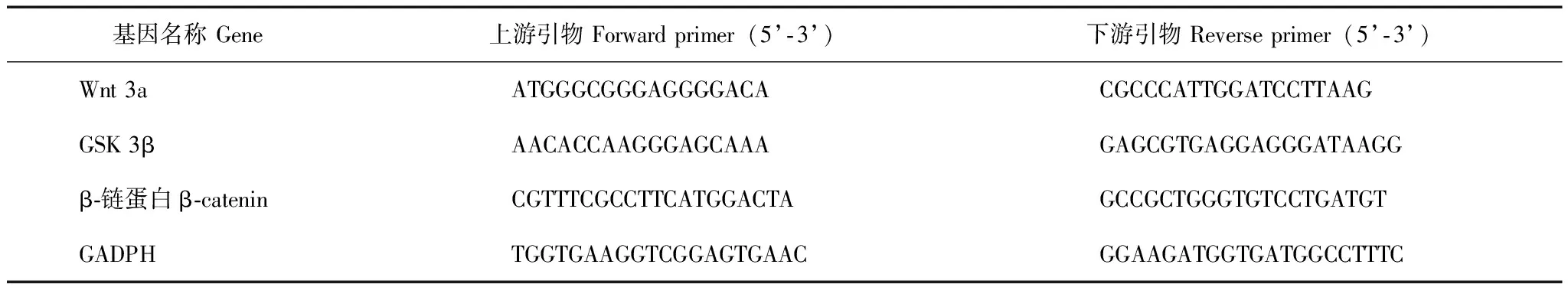
表1 荧光定量PCR引物序列
认知功能检测(Morris水迷宫实验)模型建立3周后进行Morris水迷宫训练。水温恒定实验前将大鼠放入无平台水池自由游泳3 mim适应环境。水池划分为4个象限,在第4象限放置一直径为12 cm的逃生平台。定位航行实验:每天上午、下午各1次,连续6 d。随机选取一象限为起始点,将大鼠面向池壁放入水池中,记录大鼠到达平台的时间(逃避潜伏期)。第7天撤去平台,进入空间探索实验,记录大鼠在90 s内穿越原始平台的次数。
统计学处理采用SPSS 21.0统计软件进行分析,计量资料以均数±标准差表示。组间比较采用t检验,多组比较采用单因素方差分析(one way ANOVE),联合两两比较采用Bonferroni检验。P<0.05为差异有统计学意义。
结 果
Dex对七氟醚诱导的新生大鼠认知障碍的影响各组大鼠水迷宫定位航行实验逃避潜伏期显示,随着训练时间的延长,各组大鼠逃避潜伏期的时间逐渐缩短。第6天实验结果显示,与正常对照组相比,Dex处理组差异无统计学意义(t=0.304,P=0.768);七氟醚处理组(t=5.823,P=0.002)、七氟醚+Dex处理组(t=3.188,P=0.010)及七氟醚+Dex处理+Wnt抑制剂组(t=5.784,P=0.002)逃避潜伏期时间延长,差异有统计学意义。与七氟醚处理组相比,七氟醚+Dex处理组逃避潜伏期时间减少,差异有统计学意义(t=3.646,P=0.005)。与七氟醚+Dex处理组相比,七氟醚+Dex处理+Wnt抑制剂组逃避潜伏期时间增长,差异有统计学意义(t=3.296,P=0.008)。各组穿越平台次数结果显示,与正常对照组比较,七氟醚处理组(t=5.179,P=0.004)、七氟醚+Dex处理组(t=2.309,P=0.043)及七氟醚+Dex处理+Wnt抑制剂组(t=3.871,P=0.003)穿越平台次数减少,差异有统计学意义;与七氟醚处理组比较,七氟醚+Dex处理组穿越平台次数增加(t=3.296,P=0.008);与七氟醚+Dex处理组比较,七氟醚+Dex处理+Wnt抑制剂组穿越平台次数较少(t=2.361,P=0.041)(表2)。
Dex对七氟醚诱导的新生大鼠海马CA1区TUNEL染色阳性细胞表达的影响TUNEL染色结果显示,与正常对照组相比,Dex处理组凋亡细胞数差异无统计学意义(t=1.920,P=0.127),七氟醚处理组、七氟醚+Dex处理组及七氟醚+Dex处理+Wnt抑制剂组凋亡细胞数均有不同程度增加,其中七氟醚处理组增加16%(t=13.436,P=0.002),七氟醚+Dex处理组增加5%(t=7.752,P=0.001),七氟醚+Dex处理+Wnt抑制剂组增加11.5%(t=12.612,P=0.002)。与七氟醚处理组相比,七氟醚+Dex处理组细胞凋亡数降低11%(t=8.521,P=0.002),七氟醚+Dex处理+Wnt抑制剂组降低5.5%(t=3.123,P=0.036)。与七氟醚+Dex处理组相比,七氟醚+Dex处理+Wnt抑制剂组细胞凋亡增加6.5%(t=6.250,P=0.003)(图1)。
TUNEL:dUTP缺口末端标记;与正常对照组比较,a P<0.05;与七氟醚处理组比较,b P<0.05;与七氟醚+Dex处理组比较,c P<0.05
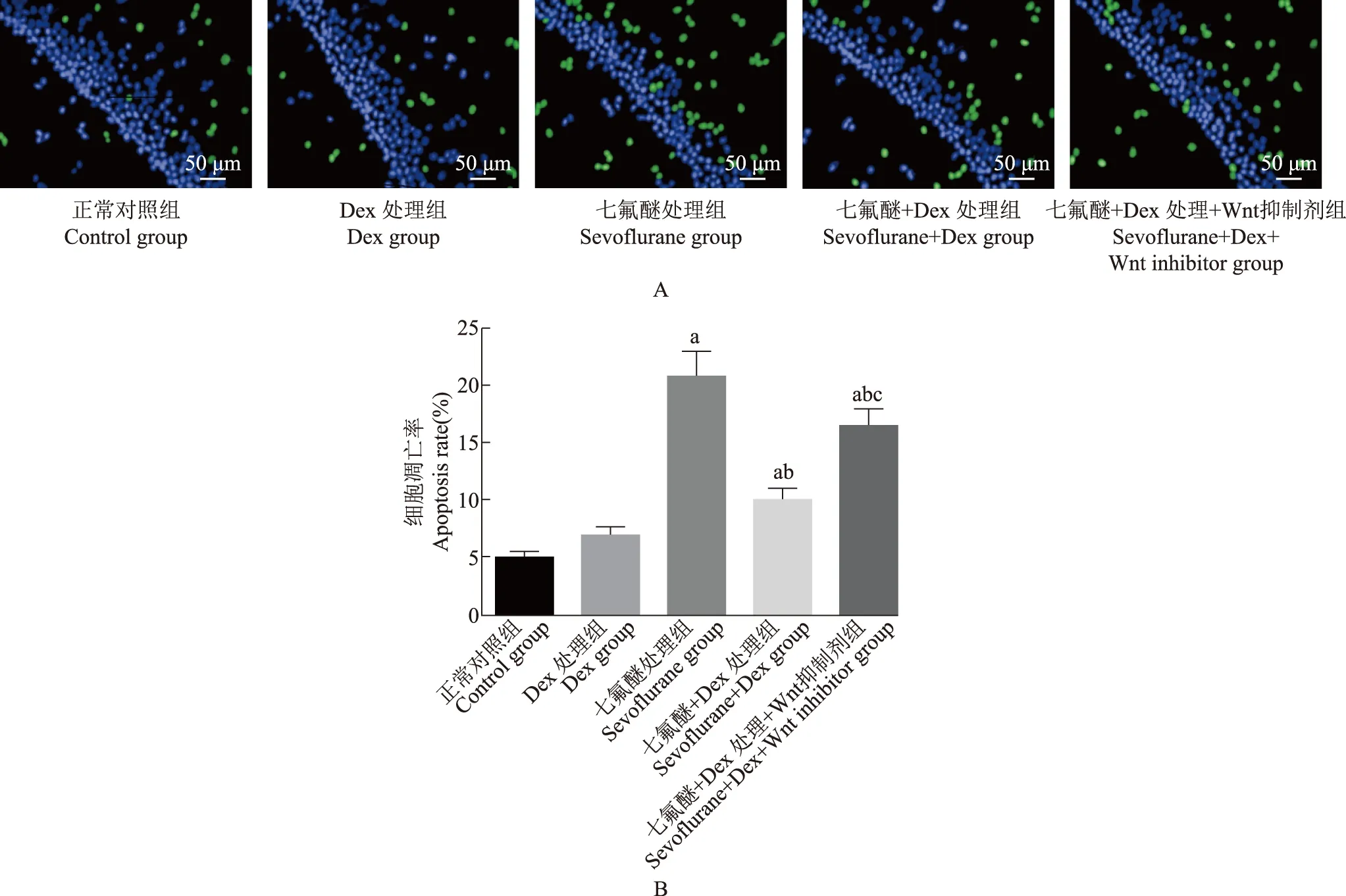
Dex对七氟醚诱导的新生大鼠海马CA1区NeuN染色阳性细胞表达的影响NeuN染色结果显示,在0.15 mm2区域内,与正常对照组相比,Dex处理组(t=0.898,P=0.136)及七氟醚+Dex处理组(t=0.203,P=1.519)阳性细胞数差异无统计学意义,七氟醚处理组及七氟醚+Dex处理+Wnt抑制剂组阳性细胞数均有不同程度减少,其中七氟醚处理组、七氟醚+Dex处理+Wnt抑制剂组阳性细胞数分别减少31(t=4.702,P=0.009)及26个(t=3.948,P=0.014)。与七氟醚处理组相比,七氟醚+Dex处理组阳性细胞数增加17个(t=3.415,P=0.018),七氟醚+Dex处理+Wnt抑制剂组增加5个(P=0.001)。与七氟醚+Dex处理组比较,七氟醚+Dex处理+Wnt抑制剂组阳性细胞减少12个(t=3.010,P=0.039)(图2)。
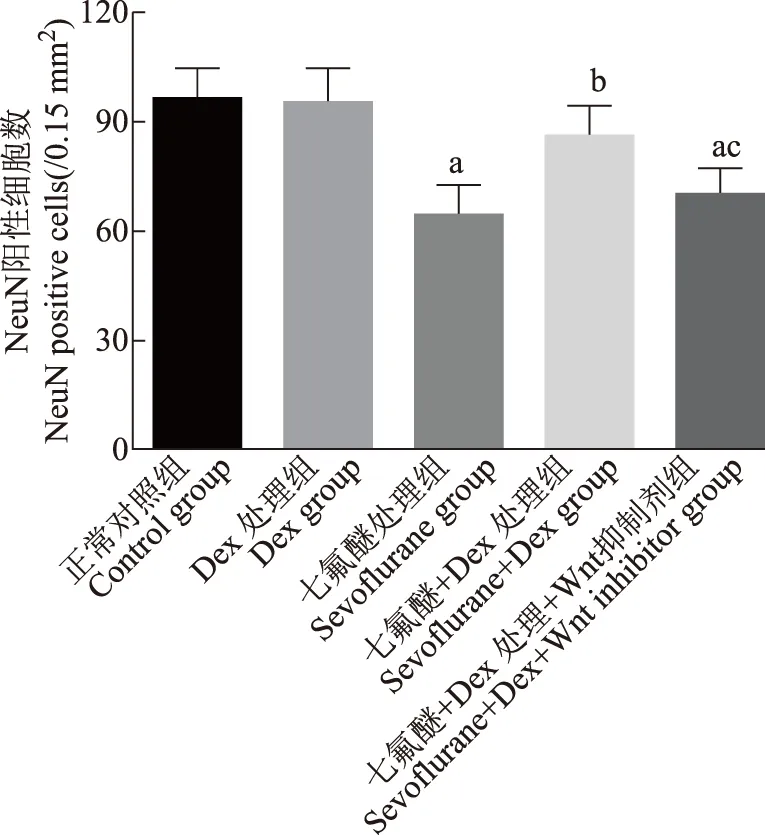
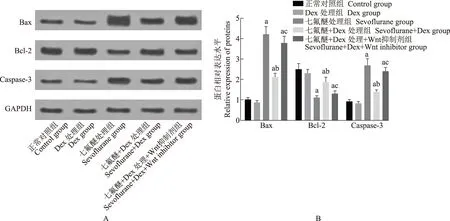
海马神经元细胞凋亡相关蛋白半胱氨酸蛋白酶3、Bax、Bcl- 2的表达蛋白质免疫印迹检测海马组织中凋亡相关蛋白半胱氨酸蛋白酶3、Bax、Bcl- 2的灰度值,结果显示与正常对照组比较,Dex处理组差异无统计学意义(t=0.612,P=0.573;t=1.225,P=0.288;t=0.961,P=0.391),七氟醚处理组、七氟醚+Dex处理组及七氟醚+Dex处理+Wnt抑制剂组Bax(t=13.440,P=0.002;t=8.520,P=0.001;t=13.320,P=0.002)及半胱氨酸蛋白酶3(t=9.860,P=0.001;t=6.120,P=0.004;t=11.620,P=0.003)均表达上调,Bcl- 2(t=7.671,P=0.002;t=2.880,P=0.045;t=6.280,P=0.003)表达下调。与七氟醚处理组相比,七氟醚+Dex处理组Bax(t=8.130,P=0.001)及半胱氨酸蛋白酶3(t=7.120,P=0.002)均表达下调,Bcl- 2(t=6.201,P=0.003)表达上调。与七氟醚+Dex处理组相比,七氟醚+Dex处理+Wnt抑制剂组Bax(t=7.310,P=0.002)及半胱氨酸蛋白酶3(t=7.750,P=0.002)均表达上调,Bcl- 2(t=4.206,P=0.013)表达下调(图3)。
NeuN:神经元核抗原;与正常对照组比较,a P<0.05;与七氟醚处理组比较,b P<0.05;与七氟醚+Dex处理组比较,c P<0.05
Wnt/β-链蛋白通路相关因子Wnt3a、GSK- 3β、β-链蛋白的mRNA表达荧光定量PCR检测海马组织Wnt/β-链蛋白信号通路相关分子Wnt3a、GSK- 3β、β-链蛋白mRNA的表达情况,结果显示与正常对照组相比,Dex处理组Wnt3a、GSK- 3β及β-链蛋白(t=1.230,P=0.290;t=0.901,P=0.418;t=1.837,P=0.140)及七氟醚+Dex处理组Wnt3a、β-链蛋白(t=1.102,P=0.332;t=1.030,P=0.361)表达差异均无统计学意义,七氟醚处理组(t=5.790,P=0.004;t=7.130,P=0.002)、七氟醚+Dex处理+Wnt抑制剂组(t=7.130,P=0.002;t=5.500,P=0.005)中Wnt3a、β-链蛋白均表达下调,七氟醚处理组(t=4.800,P=0.009)、七氟醚+Dex处理组(t=2.940,P=0.045)及七氟醚+Dex处理+Wnt抑制剂组(t=3.100,P=0.042)GSK- 3β表达上调。与七氟醚处理组相比,七氟醚+Dex处理组Wnt3a(t=4.460,P=0.011)及β-链蛋白(t=6.390,P=0.003)均表达上调,GSK- 3β(t=4.160,P=0.004)表达下调。与七氟醚+Dex处理组相比,七氟醚+Dex处理+Wnt抑制剂组Wnt3a(t=5.730,P=0.005)及β-链蛋白(t=4.640,P=0.010)均表达下调,GSK- 3β有表达上调趋势,但差异无统计学意义(t=3.240,P=0.117)(图4)。
与正常对照组比较,a P<0.05;与七氟醚处理组比较,b P<0.05;与七氟醚+Dex处理组比较,c P<0.05

与正常对照组比较,a P<0.05;与七氟醚处理组比较,b P<0.05;与七氟醚+Dex处理组比较,c P<0.05
Wnt/β-链蛋白通路相关因子Wnt3a、GSK- 3β、β-链蛋白的蛋白表达蛋白质免疫印迹检测海马组织中Wnt/β-链蛋白信号通路相关分子Wnt3a、P(ser9)-GSK- 3β/GSK- 3β及β-链蛋白蛋白灰度值情况,结果显示与正常对照组相比,Dex处理组(t=0.735,P=0.503;t=0.245,P=0.819)及七氟醚+Dex处理组(t=1.623,P=0.180;t=1.159,P=0.311)Wnt3a、β-链蛋白表达差异无统计学意义,七氟醚处理组(t=7.280,P=0.002;t=5.640,P=0.005)与七氟醚+Dex处理+Wnt抑制剂组(t=7.240,P=0.002;t=4.970,P=0.008)表达下调。与七氟醚处理组相比,七氟醚+Dex处理组Wnt3a(t=6.410,P=0.003)、β-链蛋白表达上调(t=4.640,P=0.015)。与七氟醚+Dex处理组相比,七氟醚+Dex处理+Wnt抑制剂组Wnt3a(t=6.360,P=0.003)、β-链蛋白表达下调(t=4.640,P=0.016)。蛋白质免疫印迹检测P(ser9)-GSK- 3β/GSK- 3β蛋白灰度值,结果显示与正常对照组相比,七氟醚处理组(t=11.280,P=0.002)、七氟醚+Dex处理组(t=7.080,P=0.002)及七氟醚+Dex处理+Wnt抑制剂组(t=9.970,P=0.001)P(ser9)-GSK- 3β/GSK- 3β均表达下调。与七氟醚处理组相比,七氟醚+Dex处理组P(ser9)-GSK- 3β/GSK- 3β表达上调(t=8.310,P<0.001)。与七氟醚+Dex处理组相比,七氟醚+Dex处理+Wnt抑制剂组P(ser9)-GSK- 3β/GSK- 3β表达下调(t=5.510,P=0.005)(图5)。

与正常对照组比较,a P<0.05;与七氟醚处理组比较,b P<0.05;与七氟醚+Dex处理组比较,c P<0.05
讨 论
越来越多的研究表明七氟醚麻醉会造成新生大鼠神经细胞凋亡以及认知功能障碍[14- 15]。这意味着使用七氟醚麻醉对新生儿具有神经毒性,会对新生儿大脑认知功能造成影响。
Dex常用于全身麻醉的辅助剂,由于其具有镇静和镇痛的效果,目前Dex在儿科医学上的应用越来越多[16]。有研究表明Dex可通过诱导自然睡眠,从而产生镇静效果[17]。研究表明,Dex的辅助用药可改善新生大鼠认知功能障碍[18]。更有研究表明Dex可减轻七氟醚诱导的新生大鼠神经退行性病变和长期记忆障碍[19]。本研究证实七氟醚处理后会导致大鼠神经元凋亡和认知功能障碍。而Dex可抑制七氟醚处理后大鼠神经元凋亡,促进神经元存活,并改善大鼠认知功能障碍。
前期研究显示经Dex处理后的大鼠,Wnt信号通路成员β-链蛋白表达发生明显改变,因此笔者推测Dex对大鼠认知功能的改善作用可能通过作用于Wnt信号通路实现。Wnt信号通路对机体发育必不可少,Wnt信号通路对心脏发育、骨骼疾病、癌症和神经系统发育均具有关键的调控作用[19- 21]。在神经发育的调控中,Wnt信号通路是大脑中海马神经元的形成和可塑性所必需的。且Wnt信号通路可促进海马学习和记忆[22]。七氟醚麻醉后,会导致Wnt信号通路被抑制,进而产生认知功能障碍[23]。Wnt信号通路成员主要包括Wnt3a、GSK- 3β、β-链蛋白等[24- 25]。Wnt3a可特异性调控海马神经元的增殖。GSK- 3β磷酸化被激活后或β-链蛋白表达升高后,可促进记忆巩固,增强海马学习能力[26- 28]。七氟醚可通过抑制Wnt/β-链蛋白活性,抑制其转录水平,进而抑制细胞的增殖[29]。七氟醚对Wnt3a、GSK 3β和β-链蛋白的表达有影响,七氟醚可抑制Wnt/β-链蛋白的活性[30]。本研究证实Wnt信号通路被抑制后,神经元凋亡升高,存活率降低,认知功能障碍加重。七氟醚处理后大鼠Wnt信号通路表达被抑制,且进一步研究证实Dex处理后,促进Wnt信号的传导,进而改善新生大鼠认知功能。因此,笔者推测Dex通过促进Wnt信号通路活性,促进信号通路下游基因的转录调控,进而改善七氟醚诱导的新生大鼠认知功能障碍。
综上,笔者探究Dex对七氟醚处理后新生大鼠认知障碍的影响,完善Dex对新生大鼠认知功能障碍的信号传导机制。而β-链蛋白的过度表达则会导致神经前体细胞的增殖,进而导致神经细胞过度增殖。因此,Dex可能会存在未知的不良反应,导致机体毒性的积累,但目前对这一问题尚未进行深入探究。笔者发现Wnt信号通路抑制剂处理后,未能完全阻断Dex对新生大鼠认知功能障碍的改善作用,因此推断Dex可通过多种途径改善新生大鼠认知功能障碍,仍需进一步探究并完善Dex对新生大鼠认知功能障碍的作用机制。

