BMAL1、CLOCK及其靶基因PER1血浆蛋白水平与高血压的相关性
方正美,朱丽君,常微微,金岳龙,陈 燕,姚应水,2
(1.皖南医学院 公共卫生学院 慢性病防制研究所,安徽 芜湖 241002;2安徽中医药高等专科学校 医疗系,安徽 芜湖 241003)
高血压作为一种全球性的公共卫生问题,是脑卒中和冠状动脉粥样硬化性心脏病(冠心病)等心脑血管病发病的主要危险因素,其发病是由遗传与环境因素相互作用的结果。生物体中许多慢性病的病理过程如胰岛素依赖型糖尿病[1]、肥胖[2]和心血管病[1]都伴随着昼夜节律基因转录活性的紊乱。
血压的昼夜节律,受到位于下丘脑的视交叉上核的中枢生物钟调节,然而,有研究还发现这些生物钟基因在外周组织中同样表达并起作用。生物钟基因主要包括脑和肌肉芳香烃受体核转运样蛋白1基因(brain and muscle aryl hydrocarbon receptor nuclear translocator like protein 1,ARNTL/BMAL1)、时钟基因(clock circadian regulator,CLOCK)、隐色素基因、周期基因1-3(period circadian regulator 1-3,PER1-3)等,其中CLOCK与BMAL1形成异源二聚体复合物,与靶基因启动子结合推动转录进行。前期研究报道,BMAL1、CLOCK和PER1基因敲除的小鼠,其血压水平下降或升高[1]。亦有研究发现,在人群中,BMAL1位点rs6486121和CLOCK位点3111CC突变会增加高血压患病风险[3-4]。
上述研究提示了昼夜节律基因可能参与了高血压发生发展,但是这些研究主要来源于动物模型和基因的转录水平的研究,关于其在高血压患者的蛋白水平却研究甚少。因此,本研究主要分析BMAL1和CLOCK及其靶基因PER1的蛋白水平与高血压的关系。
1 资料和方法
1.1 研究对象 选取2019年7~8月弋矶山医院体检中心体检人群151例为研究对象。根据血压水平以及是否服用药物将研究对象分为对照组、高血压用药组及高血压未用药组。高血压组的纳入标准:符合《中国高血压防治指南(2018年修订版)》[5],即收缩压≥140和(或)舒张压≥90 mmHg,或既往有高血压史,年龄>50岁;生活规律;经医院伦理委员会通过,研究对象签署知情同意书。高血压组的排除标准:继发性高血压;患其他严重心脑血管病,如冠心病、脑卒中、心肌梗死等;近2周有飞行时差或者夜班轮班。对照组的纳入标准:3次血压测量均值收缩压<140 mmHg且舒张压<90 mmHg,同时无高血压病史;未患心脑血管病;与高血压组同居住地;年龄>50岁;生活规律。对照组的排除标准:患心脑血管病;近2周有飞行时差或者夜班轮班。
1.2 检测指标 收集研究对象的血压数据、身高、体质量,计算体质量指数(body mass index,BMI),BMI=体质量/身高2(kg/m2)。血压测量的方法:受试者需在清晨空腹采血之后10 min内测量血压,静坐5 min,采取坐位,用欧姆龙电子血压计统一测量右臂肱动脉血压,重复测量3次,取平均值。临床生化指标包括:空腹血糖、三酰甘油、总胆固醇、高密度脂蛋白胆固醇(high densitylipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、肝肾功能等生化指标,由体检机构用酶法测定。
1.3 BMAL1、PER1、CLOCK蛋白水平的测定 于上午9时抽取研究对象空腹外周静脉血3 mL,用EDTA抗凝管保存并于4 h内分装处理,血浆分离保存在-80℃冰箱。血浆中BMAL1蛋白(武汉优尔生商贸有限公司,SED468H)、PER1蛋白(武汉优尔生商贸有限公司,SEM012H)、CLOCK蛋白(武汉优尔生商贸有限公司,SEQ116Hu)水平检测用酶联免疫吸附法根据具体的试剂盒说明来操作,重复2次,计算两个平行样的平均值。

2 结果
2.1 基本资料 54名对照和97例高血压患者纳入本研究,其中高血压未用药组34例,高血压用药组63例。受试者年龄50~80(62.14±8.33)岁。3组对象性别、年龄、三酰甘油、总胆固醇、HDL-C、血糖、BMAL1和PER1蛋白水平比较差异均无统计学意义(P>0.05)。与对照组相比,高血压未用药组与高血压用药组的收缩压、舒张压均增加,LDL-C水平降低;高血压未用药组CLOCK蛋白水平低于对照组,差异均有统计学意义(P<0.05)。见表 1。
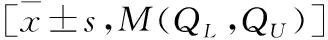
表1 研究对象的基本资料
2.2 BMAL1、PER1、CLOCK蛋白与临床资料各变量相关性分析 选取对照组与高血压未用药组进行相关性分析,结果显示PER1蛋白水平与BMI呈正相关(r=0.225,P=0.036);CLOCK蛋白水平与收缩压呈负相关(r=-0.243,P=0.022)。见表 2。
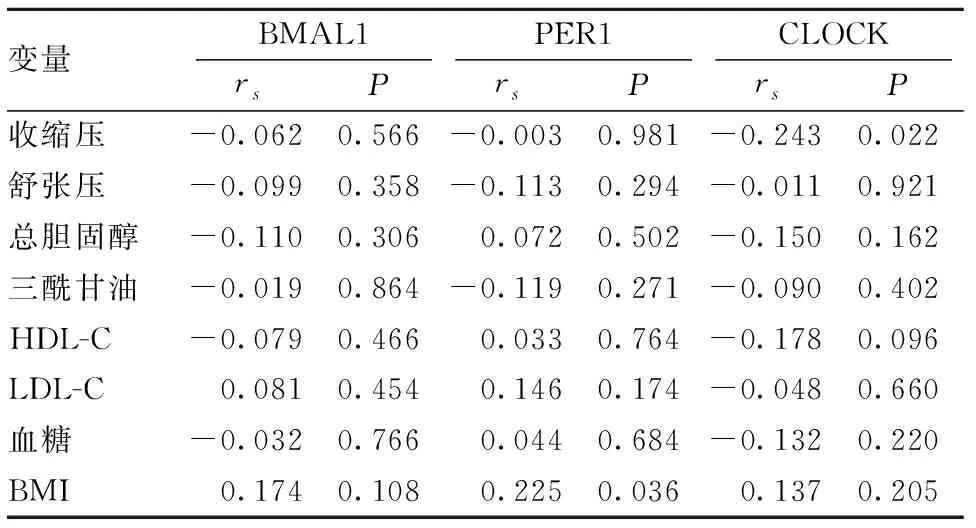
表2 BMAL1、PER1、CLOCK与临床资料各变量相关性分析
2.3 Logistic回归分析CLOCK蛋白水平与高血压之间的关系 以是否患高血压及是否服药3组为因变量(0=对照组,1=高血压未用药组,2=高血压用药组),将单因素分析中P<0.10的变量纳入多因素Logistic回归分析中,以CLOCK蛋白水平、TC、LDL-C、BMI为自变量,行Logistic回归分析。结果显示,CLOCK水平降低是高血压未用药组的危险因素(P<0.05),BMI和LDL-C水平增高是高血压用药组的危险因素(P<0.05)。见表3。
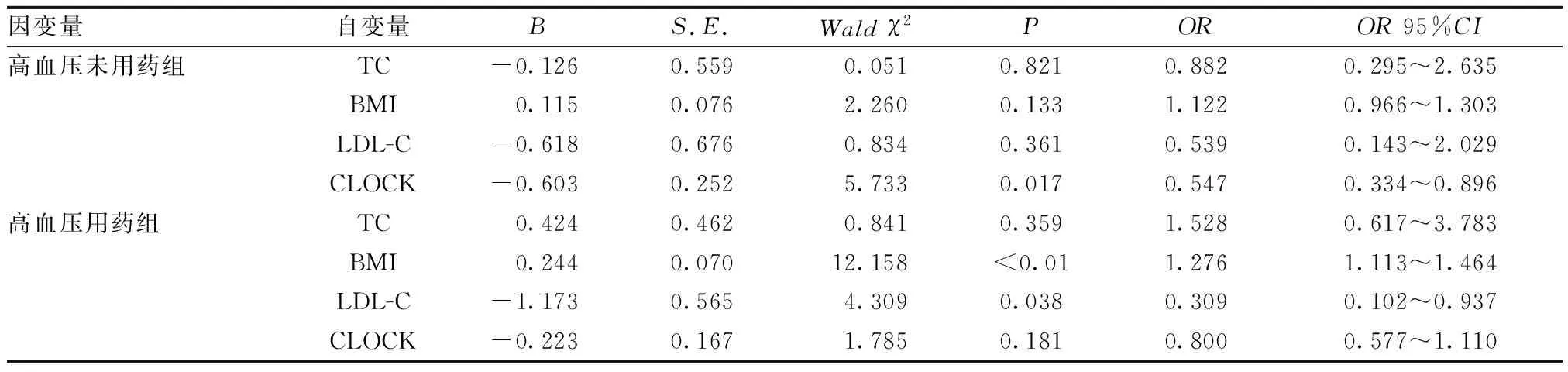
表3 高血压影响因素的多元Logistic回归分析
3 讨论
人体血压波动存在昼夜节律性,健康人夜间血压可下降10%~20%,早晨上升,血压昼夜节律在维持人体健康上发挥重要作用。研究表明,与其他时间相比,在早晨血压波动期间,急性心肌梗死的风险增加40%,心脏猝死风险增加29%,脑卒中风险增加49%[10-12]。近年来越来越多的研究表明,生物钟基因功能缺失与血压升高密切相关。
本研究探讨血压正常人群和高血压患者外周血中BMAL1、PER1、CLOCK蛋白水平的差异。结果发现未使用药物治疗的高血压患者的CLOCK蛋白水平低于正常血压人群,并进一步发现CLOCK蛋白水平与收缩压呈负相关。以往研究显示,CLOCK基因敲除的小鼠与雄性野生型小鼠相比,24 h血压节律没有改变,但是出现了血压水平的下降[13]。与野生小鼠相比,CLOCK突变雄性小鼠血压和心率下降,同时还出现较低的血浆醛固酮水平,但是在肾上腺切除术后,两组间的血压和心率差异均消失[14]。CLOCK突变小鼠显示一种编码Na+/ K+-ATP酶的β1亚基的基因ATP1B1的表达降低,引起血压升高[6]。而机体的昼夜功能协同障碍会诱导小鼠血管紧张素Ⅱ依赖性高血压[15]。因此,CLOCK基因在人体肾脏系统对高血压的调节中发挥了重要的作用。另有研究报道,CLOCK基因可上调细胞间黏附分子-1的表达并促进单核细胞黏附到内皮细胞,引起血管炎症反应[16]。而敲除CLOCK或BMAL1,会引起内皮依赖性血管舒张功能降低[5]。人群研究显示,位于CLOCK基因的 3′UTR 区的位点T3111C,其CC基因型携带者的高血压患病风险是TT基因型的1.42倍[7]。Kurbatova等[17]报道,T3111C位点会影响CLOCK基因的转录水平。但是既往研究主要集中于动物模型或人群中的基因转录水平,关于人群的CLOCK蛋白水平很少报道。本研究结果进一步提示低CLOCK蛋白水平可能与高血压的发生发展有关。但是用药治疗的高血压患者没有出现差异。大量研究报道,多数降压药物在降低血压同时可以调节血压的昼夜节律,但是否对恢复正常的生物钟节律也进行了调节,其具体机制尚不清楚。
PER1作为CLOCK与BMAL1形成异源二聚体的靶基因,Douma等[4]发现,PER1在雄性小鼠的血压调节中起重要作用。本研究中,PER1在高血压患者与对照中差异无统计学意义,但相关性分析显示,PER1与BMI呈正相关。BMI是衡量人体肥胖程度的重要指标。肥胖会导致血压升高,占原发性高血压的65%~75%,是心血管和肾脏疾病的主要驱动因素[18]。回归分析显示BMI升高是高血压的危险因素。PER1是否可以通过影响高血压的危险因素参与血压的调节和高血压的形成,还有待研究。
本研究存在一定的局限性。Kurbatova等[17]对34例高血压患者的口腔上皮细胞的RNA进行分析,发现9∶00~17∶00存在BMAL1转录水平下调和PER1基因表达上调的一般趋势。本研究未能收集不同时间点的参加者外周血样本,无法比较BMAL1、PER1、CLOCK蛋白水平的节律变化与高血压的关系。本研究虽然进一步在人群基础上证实CLOCK蛋白水平改变与高血压的关系,但生物钟参与调解高血压的机制复杂,影响因素多,且本研究样本量偏小,结论有待进一步验证。后续研究将继续扩大样本量,关注BMAL1、PER1、CLOCK蛋白水平与高血压的关系以及不同降压药物在生物钟对血压调节中的影响。
综上所述,本研究发现血浆CLOCK与高血压具有相关性,同时降压药物对CLOCK表达水平有一定的影响。后期应深入研究不同时间点CLOCK及BMAL1、PER1水平的变化与高血压的关系,为高血压的有效控制提供新的策略。

