新型蛋白酶体抑制剂对骨关节炎的治疗作用及其分子机制研究
姜厚森 李忠 韩宁 赵阳 郭佳 吴培刚
骨关节炎(OA)是一种常见的退化性骨关节疾病,表现为关节软骨慢性变性、关节疼痛和功能障碍[1]。骨关节炎与炎症反应和基质降解密切相关,特别是软骨炎症反应与骨关节炎的发展密切相关[2]。因此,靶向软骨炎症反应和基质降解是骨关节炎治疗的有效方法。目前,非甾体类抗炎药是临床主要用于缓解骨关节炎患者疼痛和治疗的有效药物[3]。但非甾体类抗炎药具有胃肠道等不良反应,而且对软骨基质降解的影响较小。因此,开发同时具有抗炎和抗软骨基质降解活性的药物是非常必要的。白细胞介素-1β(IL-1β)是存在于滑膜液和软骨细胞中的重要促炎细胞因子,可以诱导分解代谢介质和炎症因子的产生。因此,IL-1β诱导软骨细胞模型常被用于骨关节炎体外药物和病理研究[4-5]。YSY-01A是化学合成的一种新型蛋白酶体抑制剂,可通过阻断细胞周期杀伤肿瘤细胞,具有抗乳腺癌活性[6-7]。本研究观察和探讨了YSY-01A对骨关节炎的治疗作用和相关分子机制。
1 材料与方法
1.1 实验动物
SPF级SD大鼠,72只,雄性,体质量230~270 g,由潍坊医学院实验动物中心提供,饲养于清洁级动物房内。本研究符合潍坊医学院实验动物伦理委员会所制定的伦理学标准。
1.2 药物
YSY-01A,由潍坊医学院药理学实验室合成并提供,纯度99%以上,溶解于DMSO溶液,配制成浓度0.01 mol/L,-20 ℃保存。
1.3 试剂
CCK-8试剂盒(Dojindo,日本),诱导型一氧化氮合酶(iNOS)和β-actin一抗(Santa Cruz,美国),COX-2一抗(Abcam,美国),一氧化氮测量试剂盒(碧云天,中国),前列腺素E2(PGE2)、肿瘤坏死因子-α(TNF-α)、IL-6、金属基质蛋白酶(MMP)-3、MMP-13人ELISA试剂盒(R&D,美国)。
1.4 软骨细胞培养
人软骨细胞(HC-A)购自Sigma公司(美国),用含有10% FBS、100 U/mL青霉素及100 μg/mL链霉素的DMEM/F12培养基,于5% CO2和37 ℃的细胞培养箱中培养。体外将细胞分为NC组、IL-1β组、YSY-01A 6.2 μmol/L、12.5 μmol/L、25 μmol/L组,用不同浓度的YSY-01A预处理细胞2 h,除对照组外,IL-1β(10 ng/mL)处理细胞24 h,进行后续实验。
1.5 细胞活力
根据CCK-8试剂盒制造商说明书测量,将软骨细胞接种到96孔板(5 000个细胞/孔)中,并用不同浓度YSY-01A(0 μmol/L、6.25 μmol/L、12.5 μmol/L、25 μmol/L、50 μmol/L和100 μmol/L)处理细胞24 h。然后,将10 μL CCK-8溶液加入软骨细胞中并孵育2 h。最后,于波长450 nm处测量吸光度。
1.6 一氧化氮测量
收集细胞培养上清液,使用NO测定试剂盒以硝酸还原酶法测定NO含量。最后,于波长550 nm处测量吸光度。
1.7 酶联免疫吸附(ELISA)法
根据PGE2、TNF-α、IL-6、MMP-3、MMP-13人ELISA试剂盒制造商说明书测量软骨细胞上清的含量。
1.8 蛋白免疫印迹(Western Blot)法
收集软骨细胞,用含1 mmol/L PMSF和蛋白酶抑制剂混合物的蛋白裂解缓冲液提取细胞总蛋白,然后用BCA蛋白试剂盒测量蛋白浓度。将40 μg蛋白质上样SDS-PAGE凝胶电泳分离,随后将蛋白质转移至PVDF膜。用5%脱脂奶粉封闭1 h,然后与一抗(iNOS按1∶1 000稀释;COX-2按1∶500稀释;β-Actin按1∶1 000稀释)于4 ℃孵育过夜,洗涤,并在室温下二抗孵育2 h。使用增强型化学发光试剂盒曝光条带。
1.9 骨关节炎大鼠模型
将大鼠随机分为假手术组、模型组、YSY-01A低剂量组(2.5 mmol/L)、YSY-01A中剂量组(5 mmol/L)、YSY-01A高剂量组(10 mmol/L)和阳性药组(塞来昔布,2.86 mg/kg)。根据文献报道[8-9],采用前交叉韧带横断术建立实验模型:麻醉大鼠(约3.5%的异氟烷),并于手术显微镜下进行关节囊切口和前交叉韧带横断手术。手术后1周开始给药治疗,连续给药4周,1周2次,共8次。实验结束后收集实验大鼠的血液和组织样本。
1.10 体内ELISA法
大鼠眼球取血,收集于1.5 mL EP管,室温静置30 min,3 000g下4 ℃离心10 min,收集上清,存储于-80 ℃下,根据制造商说明测量大鼠血清中COX-2和PGE2含量。分离和定量称取大鼠软骨组织,收集于1.5 mL EP管,加入生理盐水,组织研磨仪匀浆,10 000g下4 ℃离心15 min,收集上清,存储于-80 ℃下,根据试剂盒说明书测量组织中iNOS活性和NO含量。
1.11 病理学观察
收集实验大鼠右膝的胫骨样本,置于中性福尔马林中固定48 h,然后置于EDTA脱钙液中脱钙15 d,每3 d换1次液。石蜡包埋,用切片机切成5 μm薄片。用苏木精-曙红和番红O-固绿染色,然后显微镜观察软骨和蛋白聚糖变性的变化并拍照。
1.12 统计学分析

2 结果
2.1 YSY-01A对软骨细胞活力和炎症介质NO及PGE2的影响
用不同浓度YSY-01A(0 μmol/L、3.1 μmol/L、6.2 μmol/L、12.5 μmol/L、25 μmol/L、50 μmol/L和100 μmol/L)处理软骨细胞24 h,细胞活力检测结果表明与NC组比较,50 μmol/L和100 μmol/L组细胞活力下降,差异有统计学意义(P<0.05,见图1a),故后续均采用6.2 μmol/L、12.5 μmol/L及25 μmol/L进行试验。与NC组比较,IL-1β组细胞上清中NO和PGE2含量显著升高,YSY-01A(6.2 μmol/L、12.5 μmol/L、25 μmol/L)组细胞上清中NO和PGE2含量较IL-1β组减少,差异有统计学意义(P<0.05,见图1b和c)。

注:F细胞活力=38.85,P细胞活力<0.001;FNO=162.0,PNO<0.001;FPGE2=249.9,PPGE2<0.001。a)与NC组比较,P<0.001;b)与IL-1β组比较,P<0.001。
2.2 YSY-01A对软骨细胞iNOS和COX-2表达的影响
与NC组比较,IL-1β组细胞iNOS和COX-2蛋白表达显著上调,YSY-01A(6.2 μmol/L、12.5 μmol/L、25 μmol/L)组细胞较IL-1β组iNOS和COX-2蛋白表达下调,差异有统计学意义(P<0.05,见图2a,b和c)。
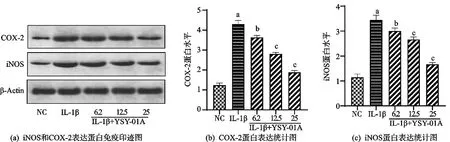
注:FCOX-2=322.8,PCOX-2<0.001;FiNOS=169.5,PiNOS<0.001。a)与NC组比较,P<0.001;b)与IL-1β组比较,P<0.05;c)与IL-1β组比较,P<0.001。
2.3 YSY-01A对软骨细胞炎症因子和金属基质蛋白酶的影响
与NC组比较,IL-1β组细胞上清TNF-α、IL-6、MMP-3和MMP-13含量显著增加,YSY-01A(6.2 μmol/L、12.5 μmol/L、25 μmol/L)组细胞较IL-1β组TNF-α、IL-6、MMP-3和MMP-13含量显著减少,差异有统计学意义(P<0.05,见图3a,b,c和d)。

注:FTNF-α=293.9,PTNF-α<0.001;FIL-6=83.18,PIL-6<0.001;FMMP-3=136.1,PMMP-3<0.001;FMMP-13=375.8,PMMP-13<0.001。a)与NC组比较,P<0.001;b)与IL-1β组比较,P<0.05;c)与IL-1β组比较,P<0.001。
2.4 YSY-01A对骨关节炎大鼠软骨基质降解的影响
与假手术组相比,在模型组中观察到软骨浅表破坏,软骨侵蚀,大量蛋白聚糖损失和明显的细胞减少,导致透明软骨(HC)厚度减少和钙化软骨(CC)的增加。关节腔内注射不同剂量的YSY-01A导致关节软骨厚度显著增加并改善了软骨损伤,并增加透明软骨厚度和减少钙化软骨(CC),见图4a和b。

图4 YSY-01A对OA大鼠软骨基质降解的影响
2.5 YSY-01A对骨关节炎大鼠炎症反应的影响
与假手术组比较,模型组大鼠血清中COX-2和PGE2含量显著增加,YSY-01A(低剂量,中剂量和高剂量)组较模型组大鼠血清中COX-2和PGE2含量减少,差异有统计学意义(P<0.05,见图5a和b)。与假手术组比较,模型组大鼠组织中iNOS和NO含量显著增加,YSY-01A(低剂量,中剂量和高剂量)组较模型组大鼠组织中iNOS和NO含量减少,差异有统计学意义(P<0.05,见图5c和d)。
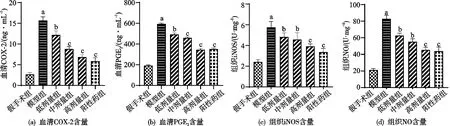
注:FCOX-2=113.5,PCOX-2<0.001;FPGE2=986.6,PPGE2<0.001;FiNOS=22.72,PiNOS<0.001;FNO=102.6,PNO<0.001。a)与假手术组比较,P<0.001;b)与模型组比较,P<0.05;c)与模型组比较,P<0.001。
3 讨论
骨关节炎是最普遍的关节疾病之一,炎症反应与骨关节炎的病理发展密切相关。IL-1β、TNF-α和IL-6作为机体主要的促炎细胞因子,参与并介导骨关节炎病理中的炎症级联反应[10]。众多细胞因子中IL-1β尤为重要,骨关节炎患者滑膜液和软骨细胞中存在大量的IL-1β。IL-1β可以诱导促炎介质和炎症因子的释放,以及分解代谢介质产生,如NO、MMP等[11]。IL-1β主要由软骨细胞、滑膜细胞和巨噬细胞局部分泌,通过细胞表面受体和信号传导途径之间的相互作用加剧软骨损伤[12]。此外,软骨细胞作为软骨组织唯一的细胞,主要负责细胞外基质的合成和降解,其功能障碍及代谢异常也可以加剧骨关节炎的病理进程[13]。研究发现IL-1β处理的软骨细胞通过产生和释放MMP和炎症因子引起细胞外基质降解,可以体外模拟骨关节炎的发展[14]。因此,IL-1β诱导软骨细胞模型通常用于体外骨关节炎的病理和药物干预研究[15]。本研究也发现体外IL-1β诱导软骨细胞中炎症介质(COX-2、NO和PGE2)和促炎细胞因子(TNF-α和IL-6)含量增加,与之前研究一致,这说明本研究建立了骨关节炎体外模型。
NO作为一种重要的炎症介质,可以引起软骨细胞凋亡,与骨关节炎的病理发展密切相关。iNOS作为负责NO产生的酶,与NO在骨关节炎患者的滑膜液中含量明显增加,且MMP表达上调[16]。此外,NO诱导了包括MMP-3和MMP-13在内的基质降解酶的释放[17]。本研究发现YSY-01A体外抑制IL-1β诱导软骨细胞中NO和iNOS的产生,同时体内也能够抑制骨关节炎大鼠组织的iNOS活性和NO含量。另外,炎症因子TNF-α和IL-6是NO产生的促进剂,参与骨关节炎的病理发展。本研究发现YSY-01A也能够抑制IL-1β诱导软骨细胞中炎症因子TNF-α和IL-6产生。PGE2作为花生四烯酸环氧合酶代谢产物,是一种重要的促炎介质。COX-2是机体内PGE2生成的重要酶,非甾体抗炎药主要通过抑制COX-2酶活性降低PGE2含量发挥抗炎活性。本研究也同样发现YSY-01A体外抑制了IL-1β诱导的PGE2产生,并抑制了COX-2的表达。YSY-01A体内也降低了骨关节炎大鼠血清中PGE2和COX-2含量。这些结果说明YSY-01A在体内外对骨关节炎均具有抗炎活性,对骨关节炎具有潜在的治疗价值。
除炎症反应外,软骨细胞外基质降解也是骨关节炎的重要病理特征。软骨细胞与软骨修复、再生、体内平衡和结构完整性密切相关,软骨细胞变性也是骨关节炎的主要原因之一[17]。多种炎症因子刺激下,软骨细胞从“静止”状态变为“激活”状态,上调金属蛋白酶MMP-3和MMP-13表达促进了软骨细胞外基质的降解,加剧了骨关节炎的病理变化[18]。本研究发现YSY-01A体外抑制IL-1β诱导MMP-3和MMP-13释放,这说明YSY-01A可能对软骨基质降解具有潜在活性。骨关节炎动物模型主要包括部分或全部半月板切除、内侧半月板失稳、前十字韧带和后十字韧带横断术等模型[19]。骨关节炎大鼠模型表现为疾病进展快、而且成本低,研究发现术后4周大鼠可表现出轻度的软骨基质破坏,故广泛应用于骨关节炎的药物干预研究[20]。与体外研究一致,发现YSY-01A局部给药能够缓解骨关节炎大鼠的软骨基质降解,但具体机制不太清晰,仍需后续进一步研究。这些结果均说明YSY-01A可以缓解软骨基质降解,对骨关节具有保护作用。
综上所述,本研究表明YSY-01A可以同时抑制炎症反应和软骨基质降解,对骨关节炎具有潜在的治疗活性。但是,YSY-01A的抗炎和抗软骨基质降解的机制仍然不太清晰,需要进一步探索。

