丛枝菌根真菌对植物抗旱性研究进展
喻 志,梁坤南,黄桂华,杨 光,周再知,林明平
(1. 中国林业科学研究院热带林业研究所 / 国家林业和草原局热带林业研究重点实验室,广东 广州 510520;2. 南京林业大学林学院,江苏 南京 210037)
气候变化导致全球范围内干旱事件频发,对农业生产构成了严重的威胁[1],中国是世界上受干旱影响最为严重的国家之一[2]。干旱胁迫引起植物光合能力及速率下降,诱导植物活性氧的累积,降低植物水势,从而引起植物吸收矿质营养能力下降等,阻碍植物生长,严重可造成植物死亡[3-4]。植物有多种策略来缓解胁迫带来的危害,与丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)建立共生关系就是其中之一[5]。AMF 是球囊菌门(Glomeromycota)中一类古老的、专性寄主土壤微生物,不能独立完成生活史,但可与80%以上的陆地植物形成共生关系[6],依靠植物提供碳水化合物以维系其生长,AMF 可有效促进植物从土壤中摄取养分和水分[7],具有“生物肥料”的作用,可有效减少因无机肥料的使用造成的环境污染问题[8]。基于此,AMF 这一资源节约型、生态友好型的“生物肥料”引起了研究人员的普遍关注。
AMF 与植物共生互作研究一直是菌根学领域的重点内容之一。AMF 能缓解植物非生物胁迫和生物胁迫而备受关注[9],如增强植物抗旱性、提高其对高低温的耐受性、增强其耐盐及耐酸能力、缓解重金属对植物的毒害,以及提高植物抗病性和抗虫性等[3,9]。缺水是很多地区,尤其是干旱和半干旱地区影响植物生长和产量下降的主要因素之一[10],越来越多的研究试图阐明AMF 增强植物抗旱的机制,其机制包含改善植物根系构型、提高植物光合能力、增强植物水分代谢能力、促进渗透物质的积累及降低植物氧化损伤等[4]。基于此,本文从形态、生理、生化及基因表达着手,总结AMF 提高植物抗旱性的相关生理机制,并简要总结了干旱对AMF的影响。较为全面地综述了近年来国内外有关AMF 增强植物抗旱性方面的研究,提出了今后研究需注意的问题及建议。以期为加快AMF 这一高效生物技术的应用提供新的见解,这对于实现农、林和草业的可持续发展具有一定的意义。
1 干旱对丛枝菌根真菌的影响
现已证实,菌根共生有助于植物生长,使植物免受干旱的负面影响。对于共生体中植物响应干旱的机理得到了深入研究,但干旱如何影响共生体中AMF 自身变化的研究仍然有限。干旱胁迫能直接影响AMF 的发育周期,抑制孢子萌发、菌丝伸长以及产孢量[11-12],导致菌根侵染率降低。这已经在枳(Poncirus trifoliata)[13]、刺槐(Robinia pseudoacacia)[14]、角豆树(Ceratonia siliqua)[15]、香叶天竺葵(Pelargonium graveolens)[10]中得到了证实。侵染率的下降可能还与干旱胁迫使植物光合能力下降,减小对根部碳水化合物供应有关[16-17]。但上述结论并不是统一的,有人认为干旱胁迫对菌根侵染率的影响可能不显著[18],也有认为显著升高[19-21]。
AMF 在自然界广泛分布,即使干旱和半干旱生态系统中AMF 多样性也很高[22],但干旱降低了AMF 多样性[23]。事实上,人们对AMF 物种多样性的理解在很大程度上取决于研究方法的发展和新技术的应用[23]。截止到2020 年2 月,世界范围内被有效描述的AMF 物种仍非常有限(约334) (http://www.amf-phylogeny.com/amphylo_taxonomy.html)。随着分子生物学鉴定技术被引入到AMF 多样性研究中,将会促进AMF 多样性研究的快速发展。
2 丛枝菌根真菌增强植物抗旱性的机制
全球干旱导致世界范围内作物产量和生长速度明显下降[24]。接种AMF 可有效增强植物对干旱的耐受性,其作用机理有直接作用和间接作用两种。
2.1 直接作用机制
直接作用机制指寄生于根的AMF 菌丝直接吸收水分,改善植物水分状况,提高植物抗旱性的作用[25]。Li等[19]首次从根内根孢囊霉(Rhizophagus intraradices)中克隆出两个水孔蛋白基因,并验证了两个基因的功能,从分子水平上为AMF 给植物输送水分提供了依据。通过分根试验,Ruth 等[26]利用高分辨率的水分传感器量化AMF 对大麦(Hordeum vulgaris)水分吸收的贡献,发现通过菌丝吸收的水分约占植物吸收水分的20%。菌丝和根毛均能为植物吸收水分,对植物而言,干旱条件下AMF 和根毛到底谁不可或缺?对接种AMF 无根毛大麦突变体及野生型进行干旱胁迫试验,结果显示干旱条件下AMF 几乎可以弥补根毛的缺失,且在提高水分利用效率(water use efficiency,WUE)及水势方面占有优势,AMF 比根毛更有利维持植物水分平衡[27],而另一项对接种AMF 柑橘(Poncirus trifoliata)的试验则表明,干旱条件下AMF 菌丝吸水速率为正常供水时的2~7 倍,也表明了菌丝在干旱条件下对植物的重要性[11]。
2.2 间接作用机制
间接作用机制指AMF 通过促进土壤团粒结构的形成、改善植物根系构型、提高植物光合能力、增强对矿质元素的吸收、降低植物氧化损伤、增强植物渗透调节能力及诱导相关基因表达等来间接地提高植物的抗旱性[25]。AMF 能调节植物对干旱胁迫作出响应,这种响应机理是多方面和多层次的(表1),基于此,这部分从形态、生理、生化及基因表达不同层次综述了AMF 增强植物抗旱性的可能潜在机制。
2.2.1 丛枝菌根真菌在形态水平上增强寄主抗旱性
根是植物首个感受到土壤水势变化的器官[28],根系不仅为植物提供物理支持,还为植物吸收水分和养分。干旱胁迫对植物的伤害首先在根系,干旱限制根的生长,导致植物吸收的水分和养分减少[29-31]。对接种AMF 的青杨(Populus cathayana)、圆锥黍(Panicum turgidum)进行干旱胁迫试验发现,干旱降低了植物根长、根体积、根表面积和根尖数,接种处理显著增加了上述根系形态特征[20],与未接种AMF植物相比,青杨雄株的根长、根体积、根表面积和根尖数分别增加了102%、79.03%、142%、30.49%;圆锥黍分别增加了84.36%、28.04%、63.43%、131%。接种AMF 显著增加干旱条件下植物的主根和侧根根毛密度、根毛长度及根毛直径[32-33]。干旱条件下,AMF对宿主植物同化物分配量也有影响,体现为地下部分大于地上部分,这不仅有助于水分的吸收,还减少水分的消耗[34]。张亚敏等[31]以小马鞍羊蹄甲(Bauhinia faberi)为试验材料,不仅发现接种AMF 改变了干旱条件下小马鞍羊蹄甲的根系形态,还减小了根系拓扑指数,改善了根系构型。综上,干旱条件下接种AMF 可有效促进植物根系生长和改善植物根系构型,有助于植物在更大的范围上利用土壤中的水分和养分,提高宿主植物对干旱的抗性。
球囊霉素相关土壤蛋白(GRSP)是AMF 菌丝和孢子壁分泌的一种特殊糖蛋白[41]。GRSP 对土壤的作用体现在两个方面,一是促进团聚体的形成。GRSP 是土壤中的微生物胶,具有“超级胶水”的性能[42],其黏附土壤颗粒的能力比其他土壤碳水化合物能力强3~10 倍,故其在形成大团聚体的过程中发挥着重要作用。另外,AMF 菌丝也可缠绕土壤微粒,促进大团聚体形成[43]。以红橘(Citrus tangerina)为材料,研究不同水分条件下接种摩西斗管囊霉(Funneliformis mosseae)和 幼 套 近 明 球 囊霉(Claroideoglomus etunicatum)对GRSP 的影响,发现干旱处理12 d 后,接种摩西斗管囊霉和幼套近明球囊霉红橘的总球囊霉素含量分别增加了83.78%和61.11%,显著高于未接种处理的28.57%[42]。GRSP对土壤的另一作用表现为提高土壤团聚体的稳定性。通过比较接种摩西斗管囊霉和根内根孢囊霉的桑树(Morus alba)与未接种处理发现,干旱处理接种上述AMF 均能显著影响土壤团聚体的稳定性,其中,接种摩西斗管囊霉和根内根孢囊霉桑树的大团聚体比例分别提高2.57% 和3.28%、团聚体平均质量直径分别提高2.83% 和2.20%、几何平均直径分别提高4.36%和3.54%[44]。根系对土壤团聚体亦有影响,为排除根系的影响,采用两室分隔系统,以摩西斗管囊霉和球状巨孢囊霉(Gigaspora margarita)接种到沙打旺(Astragalus adsurgens),在干旱条件下发现,接种处理对大于5 mm 的水稳定团聚体(WSA>5mm)有显著影响,与未接种处理相比,接种摩西斗管囊霉和球状巨孢囊霉沙打旺的WSA>5mm分别增加了72%和82%,并利用超声波分散技术量化团聚体的结合能,发现干旱条件下,接种处理的WSA0.25~2mm和WSA>2mm的分散能高于未接种处理[45]。土壤团聚体是主要的土壤结构单元,AMF 促进土壤团聚体的形成,提高其稳定性,有助于植物在干旱条件下调控植物对水分的吸收,从而提高植物的抗旱性。
2.2.2 丛枝菌根真菌在生理水平上提高植物抗旱性机制
光合作用是植物生长发育的主要生理过程之一,其对干旱很敏感[27,46]。植物对干旱胁迫的首要响应是关闭气孔以维持其内部水分平衡,导致光合作用减弱[47],气孔关闭使碳的同化作用减小,光系统Ⅱ吸收的光能过剩,造成光损伤[48-49]。近年来,国内外专家学者对枳[50]、番茄(Solanum lycopersicum)[51]、突厥蔷薇(Rosa damascena)[52]、甘薯(Ipomoea batatas)[53]、云南蓝果树(Nyssa yunnanensis)[54]、刺槐[55]、柚木(Tectona grandis)[40]等多种植物进行了研究,发现接种AMF 可有效促进植物在干旱环境下的光合作用。以根内根孢囊霉、摩西斗管囊霉接种刺槐,研究干旱条件下接种AMF 对刺槐光合特性的影响发现,
在干旱处理时接种AMF 可提高刺槐的光合作用水平,与未接种植株相比,接种根内根孢囊霉刺槐的净光合速率(net photosynthetic rate, Pn)、气孔导度(stomatal conductance, Gs)、胞间CO2浓度(intercellular CO2concentration, Ci)及蒸腾速率(transpiration rate,Tr)分别增加了164%、164%、111%和250%;接种摩西斗管囊霉则分别增加了72.89%、134%、111%和158%[55]。与未接种植株相比,总体上(即所有水分条件下的共生体)接种AMF 植物的Gs提高了24%,中度干旱下,接种AMF 植物的Gs是总体上的200%,重度干旱下,达400%[56]。干旱对光合作用的抑制分为气孔限制和非气孔限制[39],在轻度干旱胁迫下,光合作用主要受气孔限制的影响,随着干旱的加重,非气孔限制可能是影响光合作用的主要因素[49]。叶绿素荧光技术因操作简单、无损伤、快速等特点,被广泛用于评估逆境对植物光合作用能力及能量转化效率的影响[34]。在干旱条件下,刺槐[14]、柚木[40]、木棉(Bombax ceiba)[57]、小麦(Triticum aestivum)[48]在接种AMF 后均发现其保持了较高的光能利用效率及光保护能力,强化了植物在干旱胁迫下的生存能力。对木棉的研究中发现,在重度干旱处理15 天后,接种AMF 木棉与未接种木棉相比,其最大光化学效率(Fv/Fm)、PSⅡ实际光量子产量[Y(Ⅱ)]、光化学淬灭系数(qP)、光合电子传递速率(ETR) 分别提高了9.68%、389%、300%和408%,PSⅡ调节性能量耗散的量子产量[Y(NPQ)]、PSⅡ非调节性能量耗散的量子产量[Y(NO)]、非光化学淬灭系数(qN)则分别降低了52.50%、27.45%和22.95%[57]。有学者认为接种AMF 植物在干旱胁迫条件下气体交换能力强、光合机构受伤害小,归功于接种AMF维持了植物较高的水分状况和WUE[5,46],较高的水分状况表明其能从根际吸收更多的水分,或者通过调控气孔行为控制水分流失的能力更强[12]。
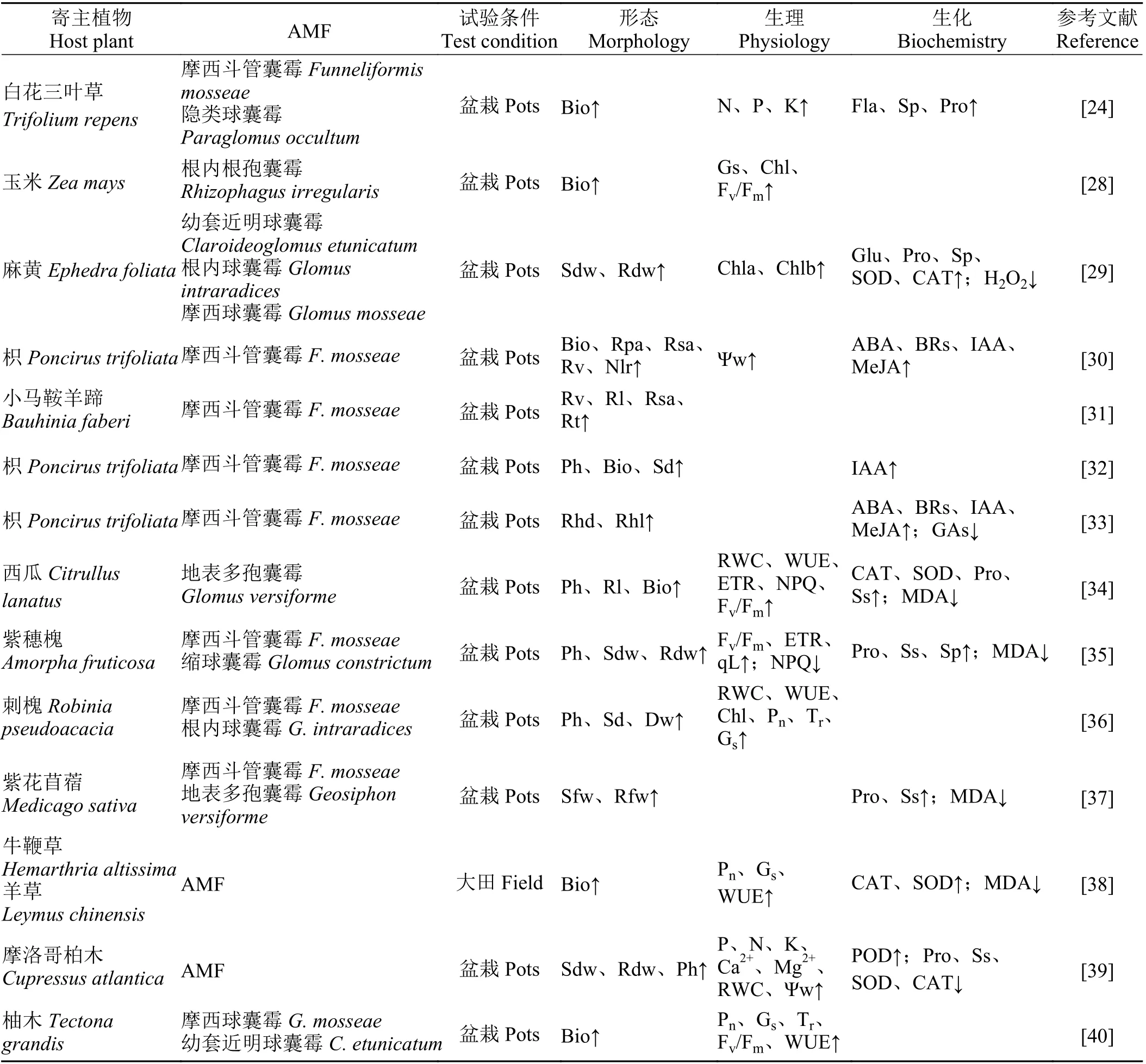
表 1 植物在干旱条件下不同层次上对接种AMF 响应机制Table 1 Response mechanism of plants to inoculation AMF at different levels under drought conditions
磷(P) 作为植物生长必需的大量元素之一,是核酸、ATP 及多种酶等大分子的组成成分[58]。磷在酸性土壤易被铁和铝离子吸附,在碱性土壤易被钙离子吸附,故全球范围内土壤有效磷普遍较低[59],植物对磷的吸收依赖于扩散,干旱条件下磷在土壤中的移动性降低,会在根周围形成贫磷区[4,60],造成潜在的磷胁迫。对桑、向日葵(Helianthus annuus)、木棉及大豆(Glycine max)接种AMF 后,进行干旱胁迫试验,均发现干旱条件下接种AMF 植物的磷含量显著高于未接种植物[61-64]。以摩西斗管囊霉和根内根孢囊霉分别接种桑树,与未接种桑树相比,发现干旱处理时接种摩西斗管囊霉桑树根的磷含量提高了278%(接种根内根孢囊霉时不显著),接种摩西斗管囊霉和根内根孢囊霉桑树茎的磷含量分别提高了202%和107%;接种摩西斗管囊霉和根内根孢囊霉桑树叶片的磷含量分别提高了142%和63.84%[61]。干旱条件下,AMF 对植物吸收矿质元素的积极作用已被广泛报道,但其机理目前仍不完全清楚,归纳总结可能存在的机理如下:1) 根外菌丝间接扩大了植物根系吸收范围。接种AMF 植物其菌丝远远超出了植物根部的营养耗竭区,扩大了植物根系吸收范围,且菌丝直径比根系直径小2 个数量级,能进入直径较小根系不能进入的土壤孔隙内,吸收矿质元素[1,39,64]。2) AMF 可活化土壤中磷素。AMF 可分泌柠檬酸、乙酸、草酸等有机酸,使难溶性磷易于活化,增加土壤中有效磷的含量,提高宿主植物的磷营养[43,65]。3) AMF 可分泌酸性磷酸酶及提高宿主植物根围土壤磷酸酶活性,促进植物对有机磷的分解利用[58,66]。4) AMF 是无隔膜或隔膜非常少的菌丝体,菌丝内的物质转运阻力小[67],接种AMF 植物根内磷的运输速率为20 mm·h-1,是非菌根植物的10 倍,故AMF 可促进磷素的快速运输,增加植物体内的磷素含量[43]。5) AMF 可上调植物根系磷酸盐转运蛋白基因表达量,增加植物在干旱条件下对磷的吸收[58]。
2.2.3 AMF 在生化水平上增强植物抗旱性
当植物受到干旱胁迫时,会产生大量的活性氧(reactive oxygen species,ROS),对植物造成氧化胁迫损伤。过量的ROS 对植物有害,但低浓度的ROS 水平对植物是必不可少的,因为它们参与激活防御途径的信号事件[68]。如正常条件下,接种根内根孢囊霉大豆叶片和根的过氧化氢(H2O2) 浓度显著高于未接种大豆叶片和根的H2O2浓度[69]。植物具有内源抗氧化防护系统以保护自身免受ROS 的氧化损伤。抗氧化防护系统分为酶促清除系统和非酶促清除系统,其中,酶促清除系统包含超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)等[4]。大量研究表明,干旱条件下,接种AMF 能降低ROS 对宿主的氧化损伤[21,29]。通常,有两种机制解释接种AMF 降低植物在干旱条件下的氧化损伤,一是接种AMF 可以提高植物抗氧化剂酶的活性或抗氧化剂的含量[70-71],增强对ROS 的清除能力(图1)。国内外学者对香叶天竺葵[72]、角豆树[15]、海枣(Phoenix dactylifera)[73]、玉米[74]、枳[13]、任豆(Zenia insignis)[75]等多种植物的研究结论表明,在干旱条件下,接种AMF 均可提高上述植物抗氧化酶类或抗氧化剂的含量,降低ROS 对植物的氧化损伤。其中,对接种摩西斗管囊霉和根内根孢囊霉的海枣进行干旱胁迫试验,发现与未接种植株相比,接种摩西斗管囊霉和根内根孢囊霉海枣的SOD 活性分别提高了13.0%和25.3%,POD 活性分别提高了10.4%和32.2%,CAT 活性分别提高了25.3%和48.1%,APX活性分别提高了40.8% 和50.6%,丙二醛含量分别降低了24.6%和34.2%,H2O2含量分别降低了15.5%和25.1%,氧化伤害降低了38.4%和55.7%[73]。二是接种AMF 植物在干旱条件下可通过根外菌丝直接吸收水分,转运给植物,降低了植物的干旱程度,避免了ROS 的产生[39,76],尽管目前菌丝网络对宿主植物供水量的多少说法不一,但菌丝直接吸水对干旱条件下的植物至关重要[77]。近年来,研究发现在干旱条件下接种AMF 可促进植物根H2O2外流,降低植物受氧化损伤的程度(图1)。接种摩西斗管囊霉枳与未接种AMF 植株相比,发现接种AMF 显著促进了枳主根及侧根的H2O2外流,降低接种AMF 枳在干旱胁迫下受到的氧化损伤[78],Zou 等[79]的结论也证实了这一点,接种AMF 的枳在干旱胁迫下的低氧化猝发是较高的抗氧化酶活性、较高的H2O2外流及较高的Ca2+内流共同作用的结果。另一项研究发现,接种AMF 能促进干旱条件下枳叶片钙调蛋白(calmodulin,CaM) 的合成[12],CaM 是Ca2+的靶分子,CaM 含量的增加将结合更多的Ca2+,增强信号强度及加快信号传递速率以触发各种细胞反应。

图 1 AMF 提高植物抗旱性机制图Figure 1 Possible mechanisms of AMF improving drought resistance of plants
渗透调节被认为是植物适应干旱的重要特征之一,对植物在胁迫条件下维持组织水分状态有重要意义[5]。脯氨酸(Pro)是被研究得最多的一种作为渗透保护剂的游离氨基酸,当植物受到干旱胁迫时能在其体内大量积累,对植物具有渗透保护作用[37],这已经在甘薯[53]、紫花苜蓿(Medicago sativa)[37]、大豆[66]、紫穗槐(Amorpha fruticosa)[35]、白三叶[24]及青杨[20]等植物中得到了证实。以摩西斗管囊霉和隐类球囊霉(Paraglomus occultum)接种白三叶,与对照组相比,发现在干旱条件下接种摩西斗管囊霉和隐类球囊霉白三叶根的Pro 含量分别提高了153%和118%[24]。Pro 的积累有助于植物器官维持较高的水合作用及组织膨压,保证植物生长及各项生理活动在干旱条件下的正常进行[80]。然而,也存在很多国内外学者的研究结论与上述结论相悖,在干旱条件下,接种AMF 玉米[74]、枳[13]、阿月浑子(Pistacia vera)[76]及青冈(Cyclobalanopsis glauca)[71]与未接种AMF 植株相比,均发现接种处理降低了植物Pro 含量。Zou 等[81]研究发现,枳在干旱条件下接种AMF降低了Δ1-吡咯啉-5-羧酸合成酶(P5CS)活性,提高了脯氨酸脱氢酶(ProDH)活性,表明接种AMF 枳在干旱条件下较低的Pro 积累可能是Pro合成受抑制和Pro 降解的增加共同作用的结果。对上述迥异的结论有学者认为可能是植物面对干旱胁迫采取的策略不同,即抗旱型(较高的脯氨酸积累)和避旱型(较低的脯氨酸积累)[82]。例如,中度干旱条件下,发现接种AMF 番茄的Pro 含量低于未接种AMF 番茄,作者认为这归功于接种AMF 提高了宿主植物WUE,改善了宿主植物的水分状况,部分阻止了依赖Pro 的抗旱机制的诱导[83]。可溶性糖亦是植物细胞中重要的渗透调节物质,接种摩西斗管囊霉和隐类球囊霉枳与未接种相比,发现干旱条件下接种AMF 显著提高了枳叶片中蔗糖、葡萄糖及果糖的含量[84]。故接种AMF 可改变植物在干旱条件下的糖代谢和脯氨酸代谢,增强其渗透调节能力。
作为固着的生物,植物必须调节自身生长发育以应对外界刺激及不断变化的环境条件[85],植物激素在其中起关键作用。植物激素是植物自身代谢产生的一类信号分子,微量的植物激素就能产生显著的生理效应,可对各种环境胁迫做出快速响应[86]。独脚金内酯(SLs) 是最近发现的一种新型植物激素,因其多功能的特性而备受关注[87-88]。丛枝菌根共生发育始于植物根系与AMF 发生物理接触之前的信号交流,研究表明SLs 启动了其间的分子对话[89]。接触前,AMF 孢子在土壤中萌发,其菌丝延伸生长是不定向及无目的性的[90],直到SLs 被释放到根际,一旦检测到SLs,AMF 会激活氧化代谢,促进菌丝生长和分枝,增加与宿主根物理接触的机率,直至共生关系的形成[91]。研究表明,接种AMF 会诱导莴苣(Lactuca sativa)和番茄SLs 的合成,缓解干旱对生菜和番茄的负面影响,增强其耐旱性,通过实时定量PCR 对参与SLs 合成的两个番茄基因SlCCD7和SlCCD8 的表达进行了定量分析,发现SlCCD8 表达与水分条件及接种处理无关,接种AMF 显著上调SlCCD7 在干旱条件下番茄根中的表达量[92]。植物对干旱环境条件作出一系列的生理生态响应依赖于信号物质的产生及传递[67],土壤干旱信息在植物根与地上部传递主要依赖于非水力化学信号分子脱落酸(ABA)[67,93]。对枇杷(Eriobotrya japonica)[68]、枳[50]、莴苣[92]多种植物进行研究,发现接种AMF可有效提高植物ABA 含量。有研究发现,干旱条件下,接种AMF 番茄显著上调了两个14-3-3 基因(ABA信号通路的关键基因)TFT2 和TFT3 的表达[94],以调节气孔行为,提高植物的WUE 和保水能力,增强植物对干旱的耐受性。然而,在干旱条件下,Wu 等[17]和Ren 等[95]发现接种AMF 枳和玉米的ABA 含量低于未接种AMF 植株。这可能与试验材料及测量方法有关。ABA 除介导植物应答干旱胁迫外,研究发现,ABA 对宿主与AMF 共生关系的建立及运行也很重要[50,92]。此外,干旱条件下,接种AMF 还提高了植物根生长素、茉莉酸甲酯及油菜素内酯的含量[33],较高水平的生长素、茉莉酸甲酯及油菜素内酯有助于植物根系生长发育,提高植物对水分和养分吸收,增强其抗旱能力。
2.2.4 调控水通道蛋白基因的表达
水通道蛋白(aquaporins,AQPs) 作为植物主要的水分通道,其在干旱条件下的功能和调节一直是人们研究的热点。植物在干旱条件下的抗旱性大小主要取决于植物AQPs 的活性。植物在持续干旱下的水分吸收过程受根叶渗透调节、根系构型及AQPs活性的影响,但根系水力导度的调节主要归因于AQPs 活性[47]。接种AMF 枳与未接种植株相比,干旱条件下接种AMF 下调了枳根中的7 个PtPIPs 基因及3 个PtNIPs 基因的表达量,对6 个PtTIPs 基因的表达影响不显著[96]。He 等[97]发现干旱条件下,接种AMF 上调刺槐的RpPIP2;1、RpTIP2;1 基因表达,下调RpTIP1;1、RpPIP1;3 基因表达。He 等[98]发现干旱条件下,接种AMF 上调了枳根中的PtTIP1;2、PtTIP1;3、PtTIP4;1 基 因 表 达, 下 调 了PtTIP2;1、PtTIP5;1 基因表达,对PtTIP1;1、PtTIP2;2 的表达影响不显著。故干旱条件下接种AMF 对植物AQPs基因存在不同的调控模式。PIPs、TIPs 及NIPs 都是多基因家族,仅仅分析几种基因可能不能说明问题。为此,李涛和陈保东[99]分析干旱条件下接种AMF 玉米根系的PIPs 家族共13 个基因的表达情况,发现与未接种植株相比,接种AMF 上调了玉米根系8 个PIPs 基因(ZmPIP2;7 未检测出)。上述接种AMF 对植物AQPs 不同的调控模式,表明上调表达有助于促进植物吸收水分,改善植物干旱条件下的水分代谢,而下调表达有助于植物保水,阻止水分从根系细胞向干旱土壤的反向运输[44],此外,AQPs 的调控方式是多元的,除上述转录水平调控外,还有翻译后修饰(磷酸化、糖基化等)及门控机制等[97]。例如,Quiroga 等[28]给玉米接种异形根孢囊霉(R. irregularis),分析AMF、干旱胁迫及水孔蛋白抑制剂叠氮化钠(NaN3)对玉米根系径向水分运输的影响,发现叠氮化钠处理降低了干旱条件下玉米渗透根水力导度(hydraulic conductivity,Lo),与未接种植株比,接种AMF 玉米其Lo 受NaN3抑制作用更小,相对质外体水通量更大,导致其根系水力导度更高,作者认为这种作用与AMF 通过翻译后修饰调节AQPs 活性有关。
目前对AMF 调控自身AQPs 的研究较少,Li 等[19]首次从根内根孢囊霉中克隆出两个水孔蛋白基因GintAQPF1 和GintAQPF2,干旱条件下发现其在根外菌丝和富含丛枝结构的玉米根系的皮层细胞中大量表达,促进了水分从AMF 向玉米根系的转运,增强了玉米对干旱的耐受性。胡文涛[58]却发现干旱胁迫仅上调Rir-AQP2 表达,下调Rir-AQP1 表达。总之,干旱条件下AMF 对植物及自身AQPs 的调控是复杂的,目前关于AMF 对植物AQPs 的调控研究主要集中在转录水平上,且研究的AQPs 基因种类数有限,缺乏系统深入的研究,以阐明其在干旱条件下转运水分子的机理。
3 结语和展望
AMF 可增强植物对干旱的耐受性,减轻干旱对植物造成的损伤,其机制包括改善植物水分状态、促进土壤团粒结构的形成、优化植物根系构型、增强植物光合作用的能力、提高植物对矿质元素的吸收、减轻活性氧对植物的毒害及促进植物相关基因表达等。总之,AMF 能增强植物的耐旱性(图1)。
当前,AMF 对植物的接种效应的大多数试验是在温室通过盆栽试验开展的(表1),与盆栽试验有限空间相比,田间植物根系可利用的土壤体积更大,摄取的养分及水分更多。且AMF 对植物没有严格的专一性,可通过菌丝可将同种或不同种的植物根系连接起来,形成地下菌根网络系统,进行资源的再分配[77]。因此,干旱对大田试验中的接种AMF植物的影响可能没有盆栽试验中的影响大。故应在大田条件下开展AMF 对植物的接种效应的研究,为AMF 在田间的应用提供理论依据,推动AMF 应用于实际生产。干旱地区降水少,蒸发强度大,干旱会促进盐分在土壤上层积累,造成土壤盐碱化[100],故植物常受旱盐双重胁迫,大量研究表明在可控条件下接种AMF 可提高植物的抗旱性及抗盐性,但接种AMF 是否能在野外同时缓解旱盐双重胁迫仍不得知,因旱盐的双重胁迫可能会推翻可控条件下AMF 增强植物受单个胁迫抗性的结论,有待加强此方面的研究。研究共生对宿主植物水分代谢的影响有以真菌为中心和宿主为中心的方法[101],得益于植物学相关研究方法和体系相对成熟,使得研究集中在以植物为中心方面且进展迅速[102],而以AMF 为中心的研究其则明显滞后。究其原因,一方面与AMF自身生物学和遗传学特性有关[102],另一方面与AMF在植物根系中的转录丰度低,其分析的难度大有关。故今后应重点开展AMF 共生体系协同抗旱机理方面的研究。

