茴香轮作调控土壤细菌群落缓解三七连作障碍的效应及机制
刘海娇,苏应威,方 岚,罗丽芬,王罗涛,张子龙,朱书生,杨 敏*
(1. 云南农业大学植物保护学院/农业生物多样性与病虫害控制教育部重点实验室,昆明 650201;2. 北京中医药大学中药学院,北京 102466)
三七Panax notoginseng是我国特有的名贵中药材,具有散瘀止血、消肿定痛的功效[1]。在种植过程中,三七面临由生物和非生物因素引起的连作障碍问题,严重制约着三七产业的健康发展[2]。众多研究表明,作物连作障碍的发生与根际微生物密切相关,如连作使西洋参[3]、半夏[4]、丹参[5]、番茄[6]等植物根际微生物多样性下降,而病原真菌如尖孢镰刀菌Fusarium oxysporum的相对丰度增加[7]。三七连作土壤微生物类型逐渐由“细菌型”转变为“真菌型”是导致连作障碍发生的重要原因[8];三年生三七根际细菌多样性显著低于未种植三七的对照处理[9];还有研究发现,患根腐病的三七植株根际细菌多样性显著低于健康三七,表明根腐病的发生可能与根际细菌多样性密切相关[10]。
土壤微生物被认为是植物的第二基因组,具有维持植物健康、促进植物生长和降解毒害物质等重要功能[11-13]。细菌广泛分布于土壤中,是数量最多和种群最丰富的土壤微生物,植物根际细菌在保护植物免受病原微生物的侵染过程中扮演着重要角色[14-15]。例如,抗青枯病番茄的根际土壤中高丰度的黄杆菌科Flavobacteriaceae微生物可以帮助易感病番茄抵御青枯菌Ralstonia solanacearum的侵害[16];从人参根际土壤中分离的枯草芽孢杆菌 Bacillus subtilis和哈茨木霉菌 Trichoderma harzianum可以抑制人参灰霉病菌Botrytis cinerea Pers.和根腐病菌Fusarium solani菌丝生长[17]。Luo等[18]研究表明,在三七连作过程中被显著抑制的一些细菌,如假单胞菌属Pseudomonas、芽孢杆菌属Bacillus和伯克氏菌属Burkholderia等对三七根腐病菌表现出很好的拮抗活性,外源添加这些细菌能显著改善三七的连作障碍。因此,能否通过农艺措施改变连作三七的根际细菌群落状态从而减轻三七根腐病的发生值得深入探究。
土壤微生物的结构和功能受到病原菌[19]、温度[20,21]、水分[22,23]、肥料[24]、pH[25,26]等众多生物和非生物因素的影响。农业生产中,轮作和间作等农事操作也会显著改变土壤的微生物,进而影响作物的健康[27,28]。如在香蕉连作地上轮作木薯可使土壤中真菌和病原菌数量显著降低,细菌丰度以及细菌/真菌比值显著增加,香蕉枯萎病发病率从90.4%降低到40.2%[29];玉米与烤烟轮作能够降低烟草黑胫病、根腐病和根结线虫病的发病率,进一步分析发现轮作烟田根际土壤中拮抗菌如鞘脂单胞菌属 Sphingomonas、假单胞菌属Pseudomonas等的相对丰度显著提高[30]。轮作也是缓解三七连作障碍的常用措施,相对于连作土壤,轮作土壤微生物的丰富度指数和物种多样性指数增加[31;水旱轮作对土壤菌群结构也有较好的改善作用,对消减三七连作障碍具有一定的潜力[32]。玉米、小麦、花生、白菜、豆类等常用于与三七进行轮作,但目前轮作周期必须在10年以上[33,34]。因此,筛选适宜植物是轮作缓解三七连作障碍的关键。
茴香Foeniculum vulgare Mill.为伞形科茴香属一年生或多年生芳香草本植物,其果实、根、茎和叶均可药食两用[35]。农业生产上可将茴香与其他植物进行间作或轮作种植用以防控特定病害的发生[36-38]。有研究报道,茴香与甜瓜轮作能够显著提高根际土壤细菌群落物种丰富度和多样性,降低甜瓜根腐病发病程度,从而缓解甜瓜连作障碍[39]。因此,本研究首先将茴香与三七进行轮作种植,评价轮作茴香土壤水浸液缓解三七连作障碍的效果;其次,利用高通量测序方法测定三七连作土壤轮作茴香后对细菌群落结构的影响;最后,通过分离获得的可培养细菌与病原菌的对峙培养试验验证细菌的变化与根腐病发生的关系。通过本研究可探明茴香对土壤微生物细菌群落的影响,为生产上利用茴香与三七轮作缓解连作障碍提供科学依据和理论基础。
1 材料与方法
1.1 供试材料
供试植物:茴香,品种为“四季茴香”,市售。
供试培养基:NA培养基(3 g牛肉浸粉、5 g蛋白胨、2.5 g葡萄糖、18 g琼脂粉,用去离子水定容至1000 mL)用于土壤细菌的分离;PDA培养基(200 g马铃薯、20 g葡萄糖、18 g琼脂粉,用去离子水定容至1000 mL)用于病原真菌培养和拮抗菌的筛选。
供试病原菌:三七根腐病原菌,腐皮镰刀菌Fusarium solani和Monographella cucumerina,由云南农业大学从罹病三七根上分离鉴定并保存的致病能力较强的菌株。
1.2 茴香轮作处理
以沸石、玉米秆发酵物、锯末、蔗渣、生土等为原料,按照一定的比例配置适宜三七生长的土壤,布于生长槽中。2013年12月移栽一年生三七子条,2015年11月全部挖取,连作土从槽中移出后闲置。2017年3月取适量连作土,混匀后置于培养盆(65 cm×40 cm×18 cm)中装满约2/3体积。在盆中播种茴香种子,5月收获后再植一茬茴香并于 11月收获,以放置在相同环境中不种植物的三七连作土为对照。2017年11月采挖茴香时,轻轻抖掉茴香根上附着的大块土壤、砂砾等物质,然后以75%酒精浸泡并晾干的牙刷小心刷取贴附于茴香根上的土壤,即茴香根际土;同时收集相同深度的对照三七连作土壤,全部土壤过40目筛后于-80 ℃冰箱保存备用。本试验在云南农业大学寻甸大河桥三七种植基地进行。
1.3 三七连作土壤轮作茴香后缓解三七连作障碍的效果评价
选取寻甸(103.13° E,25.67° N;海拔1960 m)松树林中未种植过三七的树下区域,除去上层枯枝落叶,用锄头刮取较松软的土层,混匀后过两次筛(先后为20目、40目)除去土壤中的植物残体以及石头等,带回实验室。在培养瓶中加入100 g林下土,点播健康一致的三七种子,每瓶10粒。取轮作茴香后的土壤和三七连作土壤各20 g,分别加灭菌水180 mL,在摇床上以120 r/min摇匀24 h,沉淀取上清液制成10-1g/mL的溶液浇灌三七,每瓶加入20 mL,以加灭菌水为对照处理,每个处理各设置4个重复,旋上培养瓶盖后置于光周期12L : 12D的培养室中。三七出苗长至苗高2 cm左右后开盖,每2 d补充适量灭菌水保持土壤湿润。2018年4月调查并统计三七存苗率。存苗率(%)=存苗株数/播种数×100。
1.4 茴香轮作对三七连作土壤细菌群落的影响测定
取1.2中茴香轮作和对照三七连作土壤样品,提取样品总DNA后,根据保守区V3+V4设计得到引物,在引物末端加上测序接头,进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库,建好的文库先进行文库质检,质检合格的文库用Illumina HiSeq 2500进行测序。得到的原始图像数据文件,经碱基识别(Base Calling)分析转化为原始测序序列(Sequenced Reads)。根据PE reads之间的Overlap关系,将Hiseq测序得到的双端序列数据拼接(Merge)成原始Tags序列(Raw Tags),同时对序列的质量和拼接的效果进行质控过滤,去除嵌合体,得到最终的有效数据(Effective tags)。使用QIIME(version 1.8.0)软件中的UCLUST对Tags在97%的相似度水平下进行聚类、获得OTU,并基于Silva细菌分类学数据库对OTU进行分类学注释。将OTU的代表序列与微生物参考数据库进行比对可得到每个OTU对应的物种分类信息,进而在各水平(phylum,class,order,family,genus,species)统计各样品群落组成。最后对各样品的数据进行均一化处理后进行后续的Alpha多样性分析(ACE指数、Chao1指数和Shannon 指数)和Beta多样性分析(主成分分析,Principal component analysis,PCA)及后续分析。本部分试验在百迈客生物科技有限公司完成。
1.5 茴香根际土壤中拮抗细菌的分离鉴定及拮抗能力验证
采用稀释平板法对供试土壤中的细菌进行分离。取10 g土样加入90 mL无菌水,以120 r/min振荡30 min后静置20 min,取上清液即为10-1g/mL的土壤菌悬液,然后用无菌水依次稀释到10-2、10-3、10-4g/mL。取100 µL 10-4g/mL的菌悬液加入到NA培养基表面,然后用涂布棒涂布均匀,置于28 ℃恒温培养箱中培养。待细菌菌落长出后,挑取不同形态的单菌落进行纯培养,得到纯菌落后在NA培养基斜面上置于4 ℃保存备用。
对分离到的细菌进行16S rDNA鉴定。采用细菌DNA基因组试剂盒(昆明硕阳科技有限公司)提取细菌基因组DNA,方法参见该试剂盒说明书。以细菌16S rDNA通用引物27F/1492R进行PCR扩增,通用引物序列:27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-TACGGCTACCTTGTTACGACTT-3′。
PCR 反应体系:无核酸酶水 19 μL,2×PCR Taq Master Mix 25 μL,27F(10 μmol/L) 2.0 μL,1492R(10 μmol /L)2.0 μL,DNA模板 2.0 μL,总体积 50 μL。PCR流程为:95 ℃变性4.5 min后,94 ℃变性40 s,55 ℃退火45 s,72 ℃延伸1 min,共30个循环;72 ℃反应10 min,得到PCR产物,用1%的琼脂糖凝胶电泳检测后,送至北京擎科生物科技有限公司(昆明分公司)测序,将拼接序列输入NCBI数据库进行BLAST比对,选取相似度高的菌株,确定其分类地位。
结合高通量测定的结果,采用平板对峙法验证显著变化属的细菌分离物对三七根腐病菌的拮抗活性。将供试三七病原菌用打孔器制成直径5 mm的菌饼接种于PDA培养基平板中央,在与其距离2.5 cm的位置对称接种4株相同的细菌分离物,于28 ℃恒温培养箱培养。每处理设置4次重复,以只接病原菌的PDA平板作为对照。待对照菌落长至培养皿的2/3时,观察是否出现抑菌圈,筛选对三七主要病原菌具有拮抗活性的细菌分离物,并采用“十字交叉法”测量菌落半径,按下列公式计算抑菌率。抑制率(%)=(对照菌落半径—对峙培养菌落半径)/对照菌落半径×100。
1.6 数据统计与分析
试验数据利用Excel 2010和SPSS 18.0、Origin Pro等软件进行统计分析并绘图,采用独立样本T检验和Duncan氏新复极差法进行差异显著性分析。
2 结果与分析
2.1 轮作茴香能缓解三七连作障碍
在浇灌无菌水、三七连作土壤水浸液和茴香轮作土壤水浸液3个处理中,浇灌灭菌水的存苗率(50%)显著高于另外两个处理,浇灌茴香轮作土壤水浸液的存苗率次之,连作土壤水浸液最低,不足30%,表明连作土壤水浸液会显著降低三七的存苗率;浇灌轮作茴香土壤水浸液存苗率显著高于连作土壤,表明轮作茴香一定程度上能缓解三七的连作障碍,但存苗率仍低于浇灌灭菌水的处理(图1)。

图1 三七连作土壤轮作茴香后土壤水浸液对三七存苗率的影响Fig. 1 The effect of fennel rotation soil extract on survival rate of P. notoginseng
2.2 轮作茴香对三七连作土壤细菌群落的影响
2.2.1 轮作茴香对土壤细菌多样性的影响 在97%的序列相似度水平上,将轮作茴香和三七连作土壤的序列划分到2010和1987个OTU上,轮作茴香后获得的OTU数量显著高于三七连作土(表2)。轮作茴香后细菌丰富度指数(ACE index)显著增加,细菌多样性指数(Shannon index)也呈增加趋势,但未达到显著水平(表2)。

表2 三七连作土壤轮作茴香后对细菌多样性的影响Table 2 Bacterial diversity index in the treatment soil samples
在OTU水平上对轮作茴香和三七连作土壤做主成分分析(PCA)以反映两组样本间的差异(图2)。由图2可知,PC1和PC2是造成两组样品的最大差异特征,贡献率分别为77.61%和18.01%,可以解释变量的绝大部分信息。轮作茴香和三七连作土壤可以完全分开,表明两组样本间差异相对较大,即轮作茴香明显改变了三七连作土壤的细菌群落结构。

图2 OTU水平上茴香轮作和三七连作土壤主成分分析Fig. 2 Principal component analysis of fennel rotation soil and continuous cropping soil of P. notoginseng at OTU level
2.2.2 轮作茴香对土壤细菌门水平群落结构的影响 在门水平上,高通量测序得到的轮作茴香和三七连作土壤中的细菌归类到23个门(图3A)。两组处理中相对丰度大于1%的优势门均有8个,分别为变形菌门 Proteobacteria、放线菌门 Actinobacteria、酸杆菌门 Acidobacteria、绿弯菌门 Chloroflexi、芽单胞菌门Gemmatimonadetes、拟杆菌门Bacteroidetes、蓝藻门Cyanobacteria和疣微菌门Verrucomicrobia(图3B)。在这些类群中,轮作茴香后变形菌门、放线菌门和疣微菌门相对丰度呈增加趋势,其余5个门的相对丰度呈下降趋势(图3B)。
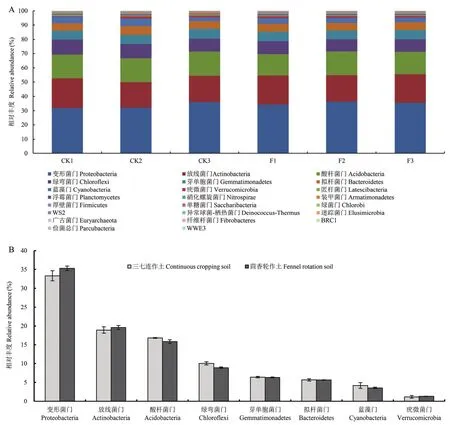
图3 三七连作土壤轮作茴香后对细菌门水平的影响Fig. 3 Effect of fennel rotation on bacteria at phylum level in continuous cropping soil of P. notoginseng
2.2.3 轮作茴香对土壤细菌属水平群落结构的影响 在属水平上,检测到的细菌归类到357个属。同三七连作土壤相比,轮作茴香使相对丰度显著增加的属有66个,归属于10个门,其中变形菌门31个,放线菌门 10个,拟杆菌门 8个,酸杆菌门和绿弯菌门各 5个,蓝藻门和疣微菌门各 2个,厚壁菌门Firmicutes、迷踪菌门Elusimicrobia和芽单胞菌门Gemmatimonadetes各1个。在这10个门中,除厚壁菌门和迷踪菌门外,其余8个均为相对丰度大于1%的优势门(图4)。轮作茴香使相对丰度显著减少的属有30个,归属于6个门,其中变形菌门10个,放线菌门8个,酸杆菌门7个,拟杆菌门和绿弯菌门各2个,厚壁菌门1个(图4)。在这6个门中,除厚壁菌门外,其余5个均为优势门。从图4中还可以看出,轮作茴香后变形菌门和放线菌门显著增加的属多于显著下降的属,与2.2.2中这两个门相对丰度增加的趋势一致;酸杆菌门显著增加的属少于显著下降的属,与2.2.2中该门相对丰度减少的趋势也一致。
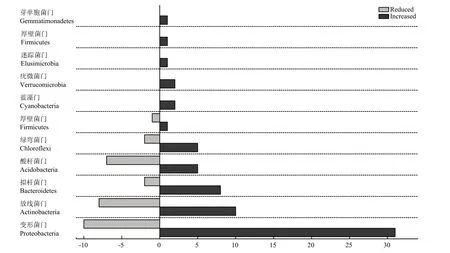
图4 不同门水平上相对丰度显著增加或减少的细菌属的数量Fig. 4 Overall changes of bacteria at genus level
在相对丰度显著增加和减少的96个属中,丰度均值>0.2%的优势属见表3。轮作茴香后显著增加的优势属有13个,相对丰度最高的是放线菌门的Pseudarthrobacter,其相对丰度在三七连作土和茴香轮作土中分别是1.775%和3.519%;其次是绿弯菌门的Roseiflexus,其相对丰度分别是0.737%和0.924%。在显著增加的优势属中,还有比较常见的病原菌拮抗属假单胞菌属Pseudomonas和芽孢杆菌属Bacillus,这两个属在三七连作土和茴香轮作土中的相对丰度分别是0.166%和0.407%、0.114%和0.328%。轮作茴香后显著减少的优势属有8个,其中相对丰度最高的是酸杆菌门的一类不可培养的属uncultured_c_Subgroup_6,在三七连作土和茴香轮作土中分别是 3.471%和 3.067%;其次为放线菌门的 Nocardioides,其相对丰度分别是3.263%和2.343%;酸杆菌门的Bryobacter相对丰度也比较高,在两种处理中分别是1.734%和1.306%(表3)。整体来看,三七连作土壤轮作茴香后细菌相对丰度显著增加的属多于显著减少的属,且丰度增加的属中还包含抗根腐病的细菌属,即轮作茴香使土壤朝着利于三七生长的方向发展。
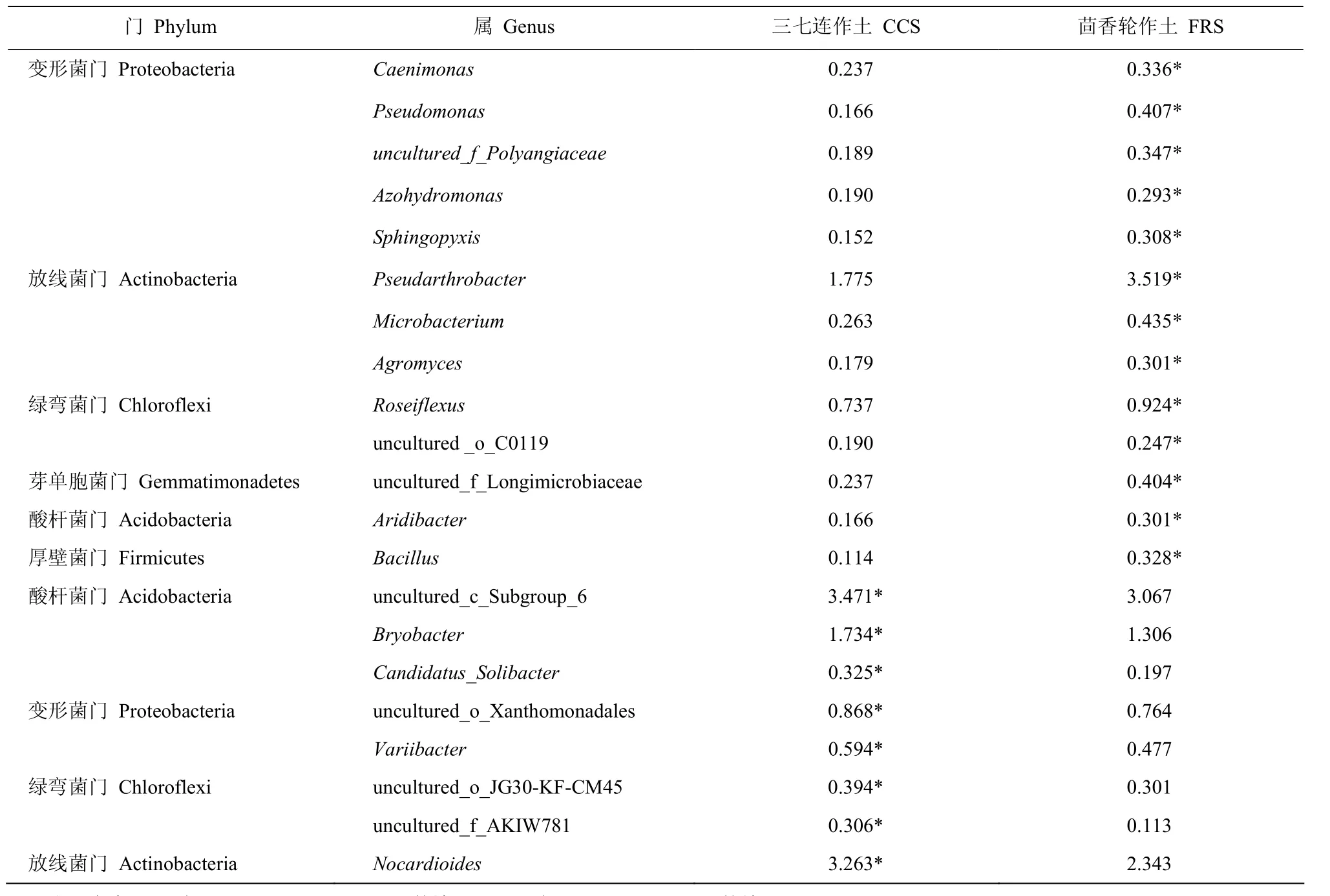
表3 轮作茴香后相对丰度显著增加和降低的优势属Table 3 Genera with significant changes in relative abundance > 0.2% in the continuous cropping soil (CCS) and fennel rotation soil (FRS)
2.3 芽胞杆菌和假单胞菌对三七根腐病菌的拮抗效果
在上述丰度显著变化的属中,假单胞菌属Pseudomonas和芽胞杆菌属Bacillus被认为是常见的拮抗病原菌生长的有益菌属[40-43]。为更好地利用茴香根际微生物防控三七根腐病,本研究从茴香轮作土壤中分离到细菌45株,结合高通量测序的结果,确定其中有7株假单胞菌和4株芽胞杆菌。将分离得到的假单胞菌和芽孢杆菌与三七根腐病菌腐皮镰刀菌Fusarium solani和Monographella cucumerina进行对峙培养,筛选出2株假单胞菌和1株芽孢杆菌具有较好的拮抗活性,将其编号为P_1、P_2和B_1。P_1、P_2和B_1对腐皮镰刀菌Fusarium solani的抑制率均在40%左右(++);对Monographella cucumerina的拮抗效果更好,抑制率均在65%~75%之间(+++)。

图5 拮抗细菌鉴定及拮抗活性测定。Fig. 5 Identification of antagonistic bacteria and antagonistic activity tests.
3 讨论
三七连作障碍的形成机制较为复杂,涉及到病原微生物增加、自毒物质积累(皂苷和酚酸等)、土壤理化性质恶化(养分、pH、电导率等)、生长环境改变(温度、光照、湿度)等诸多因素,轮作是克服连作障碍最常用和简单有效的方法[2]。本研究的试验结果显示,相对于连作土壤,轮作茴香后的土壤水浸液能够显著提高三七的存苗率;张子龙[31]的研究也证实,三七连作土轮作玉米、小麦等作物7年后,所栽植三七的存苗率(65.11%)显著高于连作2年土(9.09%),与新土上的存苗率(77.43%)无显著差异。由此可见,轮作可提高三七的存苗情况,对于消减三七的连作障碍具有明显效果。
众多研究表明,轮作可通过减少病原菌数量[44,45]、促进下茬植物生长[46]、改善根际微生物状况[6,47]等来缓解作物连作障碍,而根际微生物与植物健康密切相关[16,48]。本研究的结果显示,轮作茴香的土壤与三七连作土壤的根际细菌群落在 PCA图上可明显分开,轮作茴香后根际细菌丰富度显著提高。因此,茴香轮作土壤水浸液促进三七存苗的机制可能与改善土壤细菌群落状况有关。
在属水平上,轮作茴香后相对丰度显著增加的属有66个,其中优势菌属(相对丰度>0.2%)有13个,包含芽胞杆菌属Bacillus和假单胞菌属Pseudomonas等常见拮抗菌属。凡责艳[40]从不同类型土壤中分离对三七根腐病菌有较好拮抗效果的细菌,芽孢杆菌属Bacillus是最主要的类群;假单胞菌属Pseudomonas是常见的植物根际促生菌(Plant Growth Promoting Rhinoacteria,PGPR),对植物生长和拮抗病原菌具有很好的效果[41-43]。本研究也从土壤中分离到1株芽孢杆菌和2株假单胞菌,对峙试验发现其对三七根腐病菌生长有较强的抑制效果。根腐病爆发是三七连作障碍最主要的表现[2],茴香轮作可能通过抑制根腐病菌的生长减轻根腐病的发生从而缓解三七的连作障碍。除常见的拮抗菌属外,优势属 Pseudarthrobacter和Roseiflexus在轮作茴香后相对丰度也显著增加,在三七连作土和茴香轮作土中的相对丰度分别为1.775%和3.519%、0.737%和0.924%。已有研究报道,Pseudarthrobacter的细菌具有固氮作用和溶磷作用,能提高植物对氮素的吸收同化能力,增加植物对磷的吸收,提高作物产量[49];从马铃薯根际土壤中分离出的一株Pseudarthrobacter还能够分泌物植物生长激素吲哚乙酸(Indole acetic acid,IAA)[50]。Roseiflexus为绿色非硫光合细菌,具有较强的代谢能力和物质转化能力,对作物生长发育有益[51]。因此,茴香轮作后Pseudarthrobacter和Roseiflexus等微生物可能通过帮助三七养分吸收促进三七生长,进而缓解因养分失衡导致的三七连作障碍。在轮作茴香后显著减少即在三七连作土中相对丰度更高的优势菌属有一类不可培养的属uncultured_c_Subgroup_6、Nocardioides和Bryobacter等,在三七连作土和茴香轮作土中的相对丰度分别是3.471%和3.067%、3.263%和2.343%和1.734%和1.306%。有研究报道,Nocardioides是造成健康与易感病(黑胫病、根腐病和青枯病)烟草根际土壤微生物群落组成差异的关键物种之一,在易感病烟草根际土壤中的相对丰度更高,可能与烟草病害的发生有关[52];但也有研究发现西藏青稞根际的Nocardioides具有一定的溶磷、抗病和产IAA的能力[53],故Nocardioides对三七生长及抗根腐病的作用需要进一步的研究。uncultured_c_Subgroup_6和Bryobacter与植物生长和病害的关系报道较少,故也需要进一步的试验证实其在三七生长中的作用。由于本研究只选用了单一的NA培养基在固定的环境条件下分离可培养细菌,故分离到并进行功能验证的细菌种类较少。未来试验中将参照培养组学[54]的方法,进一步选用 LB(Luria-Bertani)、TSA(Tryptose Soya Agar)、R2A琼脂(R2A Agar)等多种培养基结合不同的培养条件分离更多细菌并进行功能验证。
轮作茴香能够提高三七的存苗率可能还与茴香根系分泌物对病原菌的化感抑制作用以及对三七生长的促进作用有关。有研究发现,茴香根系分泌物对甜瓜枯萎病菌尖孢镰刀菌Fusarium oxysporum具有化感抑制作用,而对甜瓜种子萌发和幼苗生长表现出促进效果[39];茴香根系能使烟草疫霉菌 Phytophthora parasitica游动孢子裂解,茴香组织挥发物和浸提液对疫霉菌菌丝生长也有抑制作用[55]。本研究仅从轮作茴香对根际细菌群落的改善角度解析轮作效果并不全面,后续还需明确茴香轮作后三七根腐病菌数量变化,解析茴香化感物质对三七及根腐病原菌的化感作用现象及机理。
综上,茴香轮作后的土壤水浸液可以提高三七存苗率,轮作后土壤的细菌群落丰富度增加,有益菌尤其是对根腐病菌具有抑制活性的拮抗菌的丰度增加,有利于减轻三七根腐病发生,使土壤微生物朝着利于三七生长的方向改变。因此,利用茴香与三七轮作用于缓解连作障碍具有一定的潜力。

