畸胎瘤衍生生长因子1在胰腺癌中的表达及其预后价值
高 翔,徐 强,张荣华,鲁 涛,潘伯驹,廖 泉
中国医学科学院 北京协和医学院 北京协和医院 1基本外科 2病理科,北京 100730
胰腺癌作为恶性程度最高的肿瘤之一,其总体5年生存率仅9%[1]。据报道,2015年中国新增胰腺癌患者约91 000人,死亡约79 400人,居所有因癌症死亡人数的第5位[2]。目前手术和化疗是胰腺癌的主要治疗手段,但仅有15%~20%的患者有机会接受根治性手术,而且接受手术的患者5年生存率也不到25%[3]。而以吉西他滨为代表的化疗常出现耐药的情况,临床疗效有限。胰腺癌难治的根源包括高侵袭性的生物学行为、早期诊断的困难以及辅助治疗手段的缺乏。研究胰腺癌的发生发展机制和寻找相关治疗靶点一直是胰腺癌的研究热点。畸胎瘤衍生生长因子1又称Cripto- 1,是表皮生长因子CFC基因家族的成员之一,其在胚胎的早期发育,尤其是干细胞的再生、分化过程中发挥重要作用[4- 5]。研究表明在多种恶性肿瘤,如乳腺癌、结直肠癌、胃癌等中Cripto- 1高表达,而在相应正常组织中Cripto- 1不表达或低表达,并且发现Cripto- 1在肿瘤的早期诊断、靶向治疗、预后评估等多方面有重要价值[6- 10]。在胰腺癌中,关于Cripto- 1的表达情况及其临床意义的报道较少,本研究通过检测Cripto- 1在正常胰腺和胰腺癌等相关组织中的表达情况,探讨Cripto- 1表达在胰腺癌发生发展中的作用并分析其临床意义。
资料和方法
组织病理标本组织芯片购自上海芯超生物科技有限公司,芯片编号为HPan-Ade060CD- 01、HPanA150Su01,采用的胰腺癌组织标本均为本院2004年9月至2008年12月经石蜡病理确诊的胰腺导管腺癌。所有纳入的病例满足以下条件:(1)所有标本均为手术切除后标本;(2)术后经组织病理学检查确诊为胰腺导管腺癌;(3)所有患者均未行新辅助放化疗。采用国际抗癌联盟第7版TNM分期系统进行胰腺癌分期;按2010年WHO肿瘤分类消化分册中的组织病理分级系统对胰腺癌分化程度进行分级[11]。入组的共有85例胰腺癌组织标本、70例癌旁标本、4例胰腺癌转移灶活检标本、12例胰腺癌手术获取的淋巴结标本、4例慢性胰腺炎标本和4例正常胰腺组织标本。所纳入的患者均已签署知情同意书,并且通过了中国医学科学院北京协和医院伦理委员会的审批。
免疫组织化学染色方法石蜡包埋切片标本经二甲苯脱蜡和梯度酒精水化后,按抗体说明将切片浸入沸腾的0.01 mol/L枸橼酸缓冲液中微波炉解冻档加热修复抗原,使用生物笔进行组织圈定后滴加3%过氧化氢封闭内源性过氧化物酶活性10 min;磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗3次,滴加适量的Cripto- 1抗体(美国abcam公司,ab19917,1∶300稀释)覆盖切片,4℃条件下孵育过夜;PBS 冲洗3次,滴加即用型二抗,室温孵育1 h;PBS冲洗3次,滴加适量新鲜配置的二氨基联苯胺四盐酸显色液,显微镜下观察控制显色时间;滴加苏木素染液染色约1 min,PBS冲洗;经梯度酒精脱水、二甲苯透明、中性树胶封片后镜检并拍照。
结果判定由与本研究无关的2名病理科医师盲法观片并采用半定量计分法完成。细胞质不着色判为阴性,计0分,细胞质着色判为阳性并按染色深度计分:淡黄色计1分、棕黄色计2分、棕褐色计3分;阳性细胞百分比计分:无阳性细胞计0分、1%~24%计1分、25%~49%计2分、50%~74%计3分、75%~100%记4分(阳性细胞百分比定义为3个任意高倍镜视野下阳性细胞所占百分比的平均值)。总分(染色深度计分×阳性细胞百分比计分)0~6分为低表达(0分为阴性表达),7~12分为高表达。
统计学处理采用SPSS 22.0软件(IBM,Armonk,NY,USA)进行统计学分析。计数资料以数值和百分比表示,组间比较采用χ2检验或Fisher确切概率法进行分析;对于符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验;对不符合正态分布的计量资料以中位数(四分位数间距)表示,组间比较采用秩和检验。采用Kaplan-Meier法计算累积生存差异,使用Log-rank检验比较不同组别的生存差异。多因素生存分析采用Cox比例风险回归模型,P<0.05为差异有统计学意义。作图软件采用Graphpad Prism 6.0(GraphPad Software,San Diego,California,USA)。
结 果
一般资料共纳入85例胰腺导管腺癌患者,男53例、女32例,平均年龄(62.1±10.6)岁(34~83岁);37例TNM分期为Ⅰ期、48例为Ⅱ/Ⅲ期;胰头癌49例、胰体尾癌36例;低分化者29例、中高分化者56例;中位随访时间10(1,36)个月(0~81个月)。
Cripto- 1的表达采用免疫组织化学方法检测85例胰腺癌组织标本(其中70例有对应癌旁组织)、4例正常胰腺组织标本、4例慢性胰腺炎标本、4例胰腺癌转移灶活检标本、12例胰腺癌手术获取的淋巴结标本(8例阳性、4例阴性)中Cripto- 1的表达情况,并进行免疫组织化学染色评分,结果显示Cripto- 1主要在细胞浆和细胞膜表达,少量表达于细胞核(图1)。Cripto- 1在胰腺癌的表达水平显著高于癌旁组织(Z=-3.164,P=0.002)。正常胰腺组织标本和阴性淋巴结中Cripto- 1的表达水平差异无统计学意义(Z=-0.316,P=0.752),但低于胰腺癌(Z=-2.235,P=0.025)、慢性胰腺炎(Z=-2.352,P=0.019)、胰腺癌转移灶(Z=-2.366,P=0.018)及阳性淋巴结(Z=-2.637,P=0.008),差异有统计学意义(图2)。
Cripto- 1表达与胰腺癌临床病理参数的关系以χ2检验分析85例胰腺癌组织中Cripto- 1表达水平与临床病理参数的相关性,结果表明在低分化胰腺癌组织中Cripto- 1倾向于高表达,与中-高分化胰腺癌相比,差异有统计学意义(χ2=5.934,P=0.015)。Cripto- 1表达水平与胰腺癌患者性别、年龄、肿瘤部位、T分期、N分期和TNM分期均无相关性(表1)。
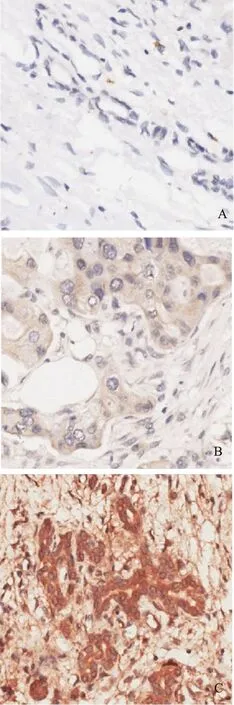
A.阴性表达;B.低表达;C.高表达
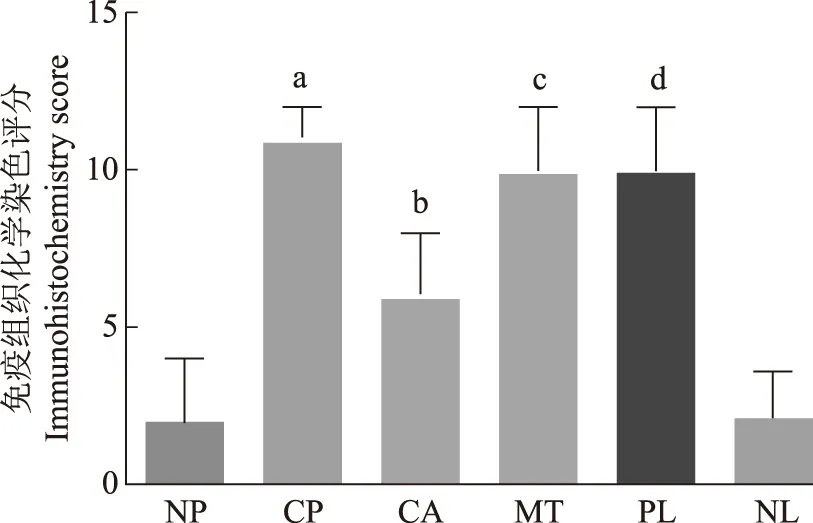
NP:正常胰腺;CP:慢性胰腺炎;CA:胰腺癌;MT:转移灶;PL:阳性淋巴结;NL:阴性淋巴结;与NP比较,a P=0.019,b P=0.025,c P=0.018,d P=0.008
Cripto- 1表达与胰腺癌患者的预后关系根据胰腺癌患者的Cripto- 1表达水平、年龄、性别、肿瘤部位、肿瘤分化程度、T分期、N分期等进行分组,绘制Kaplan-Meier生存曲线,通过log-rank检验比较Cripto- 1不同表达组的生存差异,结果表明Cripto- 1高表达胰腺癌患者的中位生存期短于Cripto- 1低表达患者,差异有统计学意义(8个月比16个月,χ2=4.787,P=0.029)(图3)。进一步在不同性别、年龄、肿瘤TNM分期、肿瘤分化程度的亚组中分析显示,在N0分期患者(7个月比42个月,P=0.021)和女性患者(8个月比43个月,P=0.029)中,Cripto- 1高表达胰腺癌患者的中位生存期短于Cripto- 1低表达患者(图4)。采用Cox回归模型对Cripto- 1表达水平及胰腺癌患者相关临床病理因素行单因素及多因素分析,结果表明肿瘤分化程度低(HR=2.444,95%CI=1.417~4.217,P=0.001),TNM分期高(HR=2.328,95%CI=1.348~4.019,P=0.002)是胰腺癌患者不良预后的独立危险因素。单因素分析显示Cripto- 1高表达是胰腺癌患者不良预后的危险因素(HR=1.716,95%CI=1.037~2.839,P=0.038),但多因素分析未得出相同结论(表2)。
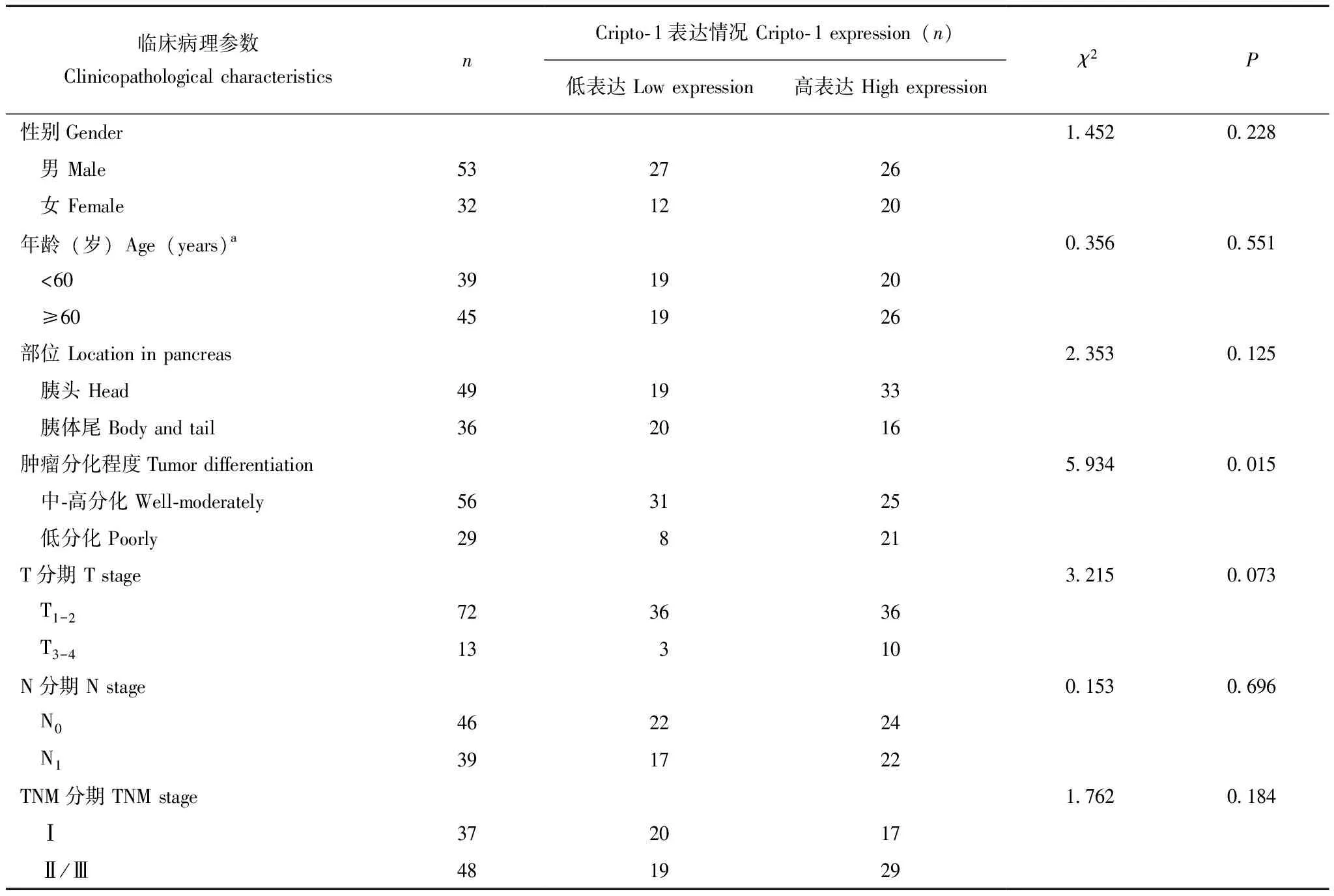
表1 胰腺癌患者Cripto- 1表达与临床病理参数的关系
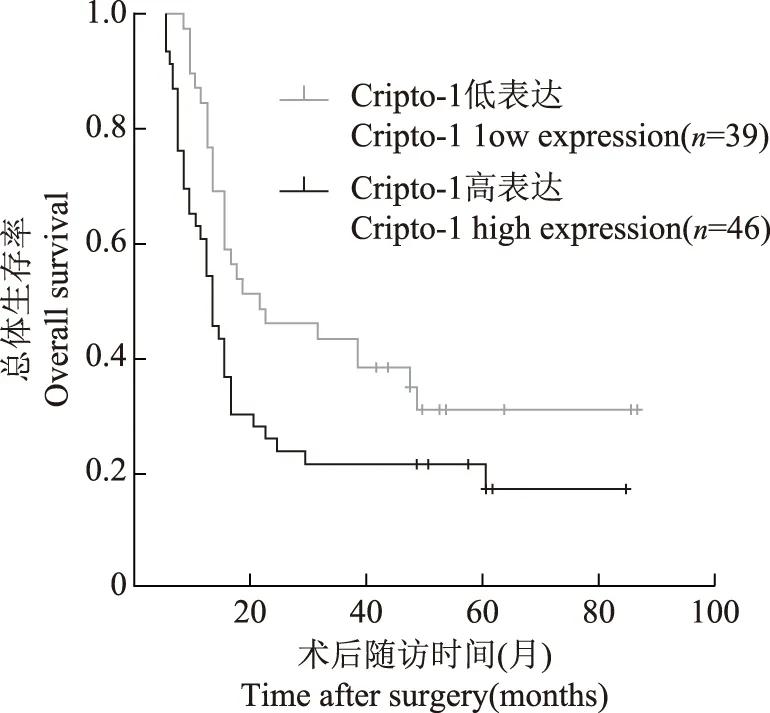
图3 Cripto- 1表达与患者的Kaplan-Meier生存曲线
讨 论
Cripto- 1在胰腺癌的相关研究较少,Friess等[12]和Tsutsumi等[13]早期的研究表明,Cripto- 1在正常胰腺组织中很少表达,而在慢性胰腺炎和胰腺癌组织中高表达,这与本研究的结果一致。Hong等[14]的研究显示Cripto- 1在胰胆管型和胃型胰腺导管乳头状黏液瘤和交界性胰腺肿瘤中高表达。慢性胰腺炎和导管乳头状黏液瘤都是胰腺癌的高危因素和早期病变,这些都提示Cripto- 1可能在胰腺癌的早期发生和发展过程中发挥重要作用[3,15]。但Cripto- 1高表达在胰腺癌当中的意义及对患者预后的影响目前尚无大样本量的患者及长期随访的研究报道。
Cripto- 1在胚胎组织中高表达,而在成熟组织中几乎不表达,Cripto- 1的不恰当表达,就有可能促进多种肿瘤生成[7,16- 17]。本研究显示Cripto- 1在胰腺癌的表达水平高于癌旁组织,差异有统计学意义。值得一提的是,胰腺癌癌旁组织中Cripto- 1的表达水平也高于正常胰腺组织,这一特点可能和“区域性癌变”理论相关,即手术取下的胰腺癌标本周围组织尽管在形态学上看似正常,但已有早期致癌基因变化,已具有癌化的倾向[18]。
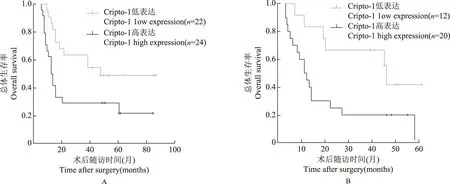
A.N0分期亚组患者;B.女性患者
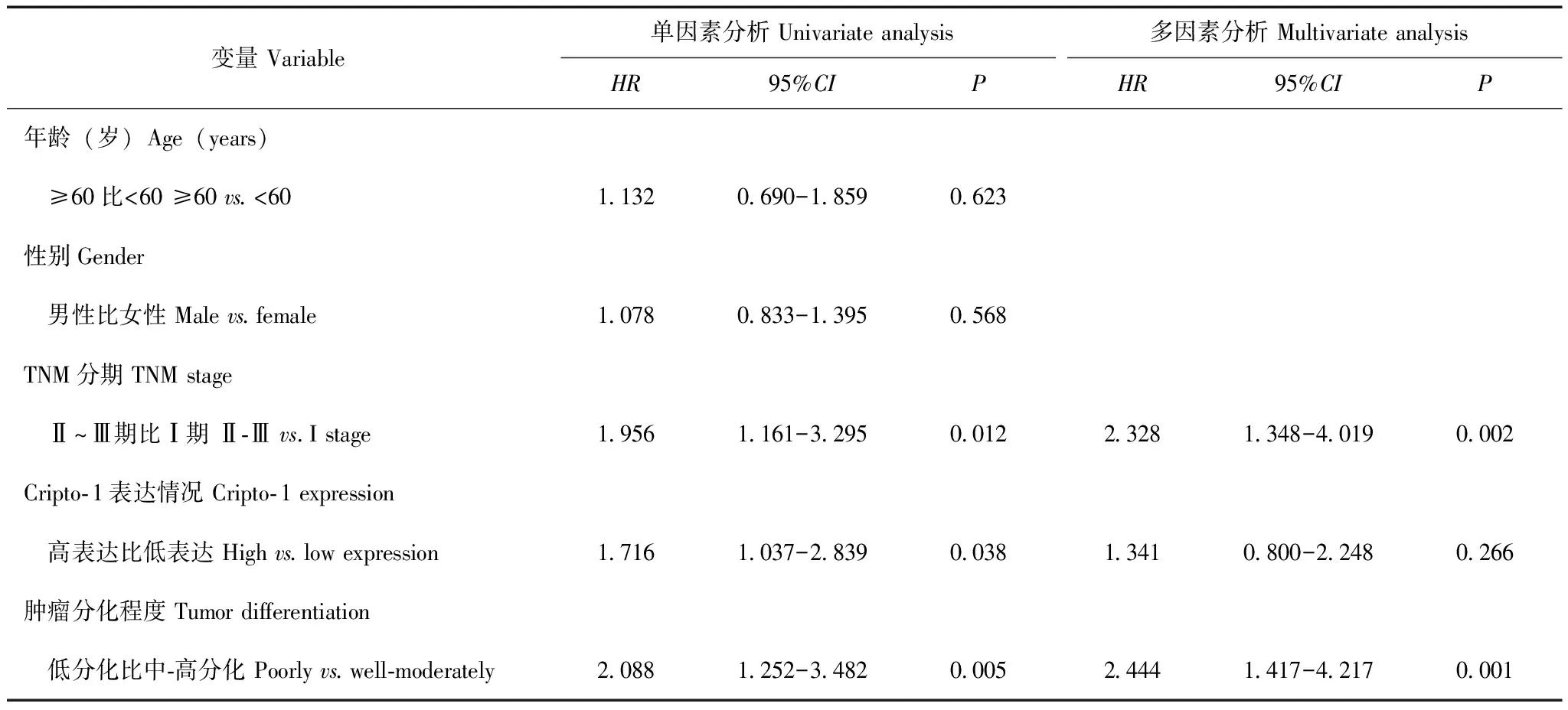
表2 胰腺癌患者预后因素的Cox回归分析
本研究显示Cripto- 1与胰腺癌的分化程度相关,在低分化胰腺癌组织中Cripto- 1倾向于高表达。低分化的胰腺癌恶性程度更高,肿瘤恶性表型更明显,预后更差,提示Cripto- 1的高表达可能与胰腺癌的恶性生物学行为有关。在结直肠癌、胃癌、乳腺癌、肾透明细胞癌等多种恶性肿瘤的研究中,Cripto- 1与分化程度差、高TNM分期和淋巴结转移等侵袭性肿瘤表现相关[7- 8,10,19],均与本研究相似。
通过绘制Kaplan-Meier生存曲线及Cox回归的方法进行单因素分析显示,Cripto- 1高表达是胰腺癌患者不良预后的危险因素,这与在其他多种恶性肿瘤中的发现一致[9- 10,20],但在多因素分析中并未得出同样的结论,可能与样本量有限有关。另外,亚组分析显示,N0分期患者和女性患者Cripto- 1高表达提示预后不良。胰腺癌在美国人群的男女比为1.1∶1,我国人群的男女比为1.4∶1[1- 2],这一分布差异可能与激素的差异有关。Normanno等[21]研究显示,在缺乏雌激素的琼脂培养基中,低表达Cripto- 1的乳腺癌MCF- 7neo细胞和高表达Cripto- 1的MCF- 7CR- 1细胞均无法形成细胞集落,在加入雌激素后MCF- 7CR- 1细胞形成的集落较MCF- 7neo细胞明显增多(P<0.05),提示雌激素可能与Cripto- 1存在协同作用;女性体内较高水平的雌激素可能和Cripo- 1协同促进胰腺癌的恶性生物学行为,导致预后不良,但具体机制尚待进一步研究。
本研究的局限性有以下两点。第一:本研究样本量偏小,尤其是正常胰腺组织的标本偏少,这与正常胰腺组织获取困难有关。后续需要多中心大样本量的研究验证本研究的结论。第二:本文仅从免疫组织化学层面阐述Cripto- 1与胰腺癌的关系,具有一定局限性。后续本课题组将继续从细胞和动物实验层面进一步探讨Cripto- 1在胰腺癌发生和发展过程中的具体作用及其分子机制。
综上,Cripto- 1在正常组织中几乎不表达而在恶性组织中高表达,其在乳腺癌、结直肠癌等恶性肿瘤的动物种植模型中已被证实可作为一个新型标志物和治疗的靶点[22]。本研究首先阐述了Cripto- 1在胰腺癌中的表达特点及其临床意义。Cripto- 1在胰腺正常组织中的表达水平显著低于其在慢性胰腺炎及胰腺癌中的表达水平,提示Cripto- 1可能在胰腺癌的早期发生和发展过程中发挥重要作用。同时,Cripto- 1在低分化胰腺癌组织中高表达,在N0患者和女性患者中,Cripto- 1高表达提示不良预后,对胰腺癌患者预后有一定指导意义。进一步扩大样本量的临床研究和深入分子机制的基础研究具有重要的临床意义。

