扶正抑瘤汤通过PI3K/Akt/mTOR信号通路抑制非小细胞肺癌增殖、凋亡及自噬
孟东雪 郭玉荣 罗斌军 周新华 傅尧 曹天雄
肺癌是全球癌症相关死亡的主要原因之一,其中非小细胞肺癌(non⁃small cell lung cancer,NSCLC)约占肺癌的 80%[1⁃3]。目前,尽管 NSCLC 的治疗取得了很大进展,但患者的临床生存率仍然很低[4]。因此,寻找有效的治疗药物及靶点迫在眉睫。
传统中药用于治疗恶性肿瘤历史悠久,也是化学抗癌药物和多种化疗药物的重要来源[5⁃6]。扶正抑瘤汤是由三棱(10 g)、莪术(15 g)、龙葵(15 g)、白英(10 g)、半枝莲(30 g)、白花蛇舌草(30 g)、黄芪(9 g)、当归(30 g)、茯苓(30 g)、白术(10 g)等10种中草药按一定比例混合而成的经典方剂[7]。目前研究表明扶正抑瘤汤能抑制前列腺癌、肝癌生长[8⁃9]。然而,扶正抑瘤汤对NSCLC的影响及其机制尚不清楚。越来越多证据表明,凋亡通路失调可促进肿瘤发生[10⁃11]。PI3K/Akt/mTOR信号通路参与NSCLC细胞凋亡过程[12],失活的 PI3K/Akt/mTOR信号通路可以抑制NSCLC细胞存活,诱导细胞自噬和凋亡[13]。细胞凋亡是一种程序性细胞死亡,涉及许多生理和病理过程,有助于维护基因组完整性[14]。本研究探讨扶正抑瘤汤对人肺癌A549细胞增殖、凋亡和迁移的影响及其是否通过PI3K/Akt/mTOR信号通路影响NSCLC的生物学行为,旨在为扶正抑瘤汤治疗NSCLC提供实验基础。
1 材料与方法
1.1 主要材料与试剂
人肺腺癌细胞株A549购自中国上海生物化学和细胞生物学研究所;扶正抑瘤汤中药购自桂林市中西医结合医院药房;CCK⁃8试剂盒购自默沙克有限公司;胎牛血清购自 Gibco公司;一抗 Beclin⁃1、LC3B、P62、PI3K、p⁃PI3K、Akt、p⁃Akt、mTOR以及p⁃mTOR均购自英国Abcam(上海)公司;β⁃actin购自美国Santa Cruz公司;山羊抗小鼠和山羊抗兔IgG(H+L)购自英国Abcam(上海)公司;BCA蛋白浓度测定试剂盒购自上海碧云天公司;细胞培养小室购自美国Becton公司;Annexin V⁃APC/PI细胞凋亡检测试剂盒购自Bioswamp公司。
1.2 细胞培养与分组
A549细胞用含DMEM和10% FBS培养液,置于37℃、5% CO2饱和湿度条件下培养,待细胞长至70%~80%时用胰蛋白酶消化后传代。将A549细胞置于96孔板(1×104/孔)中,孵育 6 h,待细胞贴壁后,用不同浓度(12.5 mg/mL、25 mg/mL、50 mg/mL、100 mg/mL、200 mg/mL、400 mg/mL)扶正抑瘤汤处理A549细胞,阴性对照组为培养基培养的A549细胞,空白对照组为150 μL DMSO。
1.3 药物的制备与处理
扶正抑瘤汤采用常规方法煎制和浓缩。用乙醇沉淀后在高速离心机中去除沉淀杂质;用PBS溶解提取物,并采用0.22 μm滤器过滤除菌,合并滤液、减压浓缩成1 g/mL的药液,贮存于4℃以下冰箱中备用。
1.4 CCK⁃8法检测细胞增殖情况
将A549细胞接种至96孔板(1×104/孔)中,并置于37℃培养箱内孵育6 h,待细胞贴壁后,用不同浓度扶正抑瘤汤处理A549细胞,继续孵育24 h后,每孔加入10 μL CCK⁃8溶液,37 ℃下孵育4 h,用酶标仪检测在450 nm波长处的光密度(OD)值。实验重复3次。细胞抑制率(%)=[(对照组OD值−实验组OD值)/对照组OD值]×100%。
1.5 Transwell实验检测细胞侵袭能力
将对照组、DMSO组和200 mg/mL扶正抑瘤汤处理后的A549细胞用含8% FBS的培养液配制成密度为3×105/mL的细胞悬液后,加入预先铺好基质胶的Transwell小室上室,下室加入含有20% FBS的培养液,于37℃、5% CO2、饱和湿度条件下培养12 h。取出Transwell小室,经甲醛固定、1%结晶紫染色、PBS漂洗后,用棉签拭去残留细胞,在显微镜下计数穿膜细胞数并拍照,实验重复3次。
1.6 划痕实验检测细胞迁移能力
将对照组、DMSO组和200 mg/mL扶正抑瘤汤处理后的A549细胞分别接种于6孔板(6×103/孔)中培养,待细胞的融合度达75%以上时,用200 μL的移液管尖垂直皿底横线做划线,PBS洗去脱落细胞,无血清的RPMI 1640培养基继续培养,分别于0 h和24 h用倒置显微镜拍摄划痕区,Image J软件测量划痕边缘之间的距离来量化偏移率,实验重复3次。用相机拍照。
1.7 流式细胞仪检测细胞凋亡情况
将对照组、DMSO组和200 mg/mL扶正抑瘤汤处理后的A549细胞接种于6孔板(5×105/孔)中培养,按照Annexin V⁃FITC/PI细胞凋亡检测试剂盒的操作步骤,各组细胞经PBS溶液洗涤后,分别加入5 μL Annexin V和10 μL PI,再加入400 μL 稀释液混匀。用流式细胞仪检测细胞的凋亡率。实验重复3次。
1.8 Western blot检测自噬和PI3K/Akt/mTOR信号通路相关蛋白的表达水平
收集培养24 h后的各组A549细胞,用RIPA裂解缓冲液冰上裂解10 min后,提取细胞总蛋白。采用增强型BCA蛋白检测试剂盒测定蛋白浓度。12% SDS⁃PAGE分离40 μg的总蛋白样本并转至PVDF⁃膜,用5%脱脂牛奶封闭1 h后,加入Beclin⁃1、LC3B、P62、PI3K、p⁃PI3K、Akt、mTOR和β⁃catin一抗,4 ℃孵育过夜;加入与辣根过氧化物酶(HRP)偶联的二级抗体(1∶3 000;Santa Cruz),室温孵育1 h,加入ECL显影,Bio⁃Rad 全功能成像系统采集图像,Image⁃ProPlus分析光密度。以β⁃actin为内参,计算各组蛋白质的相对表达量。实验重复3次。
1.9 透射电镜观察细胞自噬体的形成情况
将A549细胞接种于6孔板(6×103/孔)中培养,待细胞融合度达到75%以上时,收集细胞。PBS清洗,戊二醛固定2 h;再用PBS清洗2次,经浓度梯度分别为50%、70%、80%、90%、100%的乙醇和100%丙酮依次脱水15 min,Epon 812包埋和超薄切片后,醋酸铀和枸橼酸铅双重染色并置于透射电镜下观察。实验重复3次。
1.10 统计学方法
采用SPSS 17.0软件进行数据分析。计量数据采用均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,若组间差异有统计学意义,进一步多重比较采用Tukey检验。以双侧P<0.05表示差异有统计学意义。
2 结果
2.1 扶正抑瘤汤对A549细胞增殖的影响
CCK⁃8检测结果显示,A549细胞增殖抑制率呈浓度依赖性上升,不同浓度扶正抑瘤汤作用的细胞增殖率差异有统计学意义(F=10.227,P<0.001),且扶正抑瘤汤浓度为200 mg/mL、400 mg/mL时细胞增殖抑制率高于0 mg/mL组(P=0.019;P<0.001),见图1。本研究选择200 mg/mL扶正抑瘤汤进行后续实验。
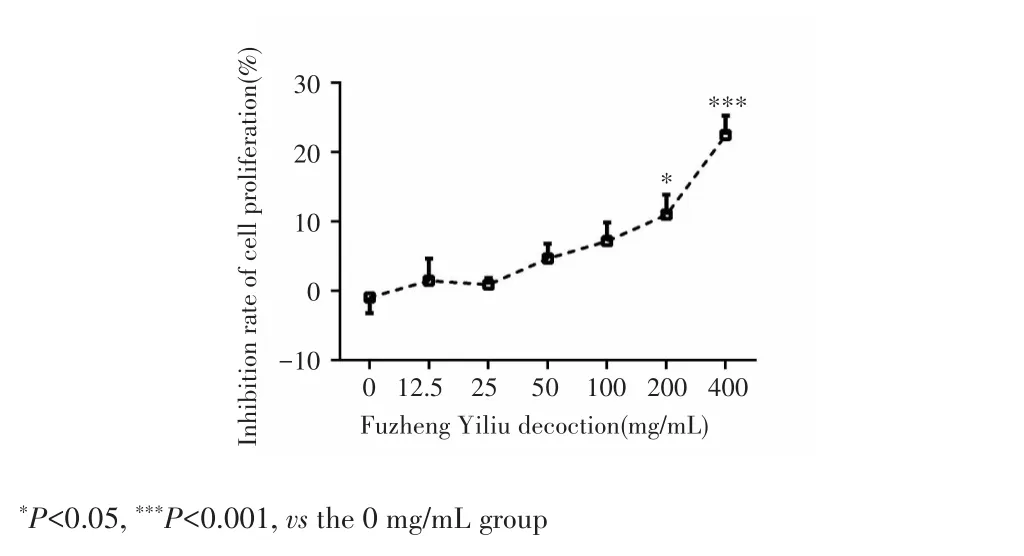
图1 不同浓度扶正抑瘤汤对NSCLC细胞A549增殖的影响Fig.1 Effects of Fuzheng Yiliu decoction with different concentra‐tions on the proliferation of NSCLC cell A549
2.2 扶正抑瘤汤对A549细胞侵袭、迁移和凋亡的影响
200 mg/mL扶正抑瘤汤处理后,对照组、DMSO组和扶正抑瘤汤组A549细胞侵袭数组间比较差异有统计学意义(F=17.423,P<0.001),其中扶正抑瘤汤组细胞侵袭数低于对照组(P=0.004),见图2A~B。划痕实验结果显示,A549细胞迁移率在各组间比较差异有统计学意义(F=5.118,P=0.014),扶正抑瘤汤组细胞迁移率低于对照组(P=0.027),见图2C~D。流式细胞术结果显示,A549细胞凋亡率在各组间比较差异有统计学意义(F=28.707,P<0.001),扶正抑瘤汤组细胞凋亡率高于对照组(P=0.001),见图2E~F。
2.3 扶正抑瘤汤对A549细胞自噬的影响
Western blot检测结果显示,经扶正抑瘤汤处理后,各组细胞内自噬相关分子Beclin⁃1、LC3 Ⅱ/Ⅰ和P62蛋白表达水平差异有统计学意义(均P<0.05)。与对照组相比,扶正抑瘤汤处理组Beclin⁃1和LC3Ⅱ/Ⅰ蛋白表达水平上调(P=0.043;P=0.041),P62蛋白表达水平下调(P=0.028),见图3A~B。24 h后,透射电镜下观察到扶正抑瘤汤处理组细胞包浆内可见大量自噬溶酶体形成,DMSO组偶见少量自噬体形成,而对照组无明显自噬体形成,见图3C。

图3 扶正抑瘤汤对A549细胞自噬相关蛋白表达及自噬体形成的影响Fig.3 Effects of Fuzheng Yiliu decoction on autophagy related pro‐tein expression and autophagosome formation in A549 cells
2.4 扶正抑瘤汤对A549细胞PI3K/Akt/mTOR信号通路的影响
Western blot检测结果显示,经扶正抑瘤汤处理后,A549细胞内PI3K、Akt、mTOR总蛋白水平在各组间比较差异均无统计学意义(均P>0.05),细胞内p⁃PI3K、p⁃Akt、p⁃mTOR总蛋白水平在各组间比较差异有统计学意义(均P<0.05),且磷酸化比值 p⁃PI3K/PI3K、p⁃Akt/Akt、p⁃mTOR/mTOR水平在各组间比较差异有统计学意义(均P<0.05)。与对照组相比,扶正抑瘤汤处理组的磷酸化蛋白p⁃PI3K、p⁃Akt、p⁃mTOR均下调(P=0.003,0.028,0.004),其磷酸化比值 p⁃PI3K/PI3K、p⁃Akt/Akt、p⁃mTOR/mTOR降低(P=0.021,0.011,0.016),见图4。

图4 扶正抑瘤汤对A549细胞PI3K/Akt/mTOR信号通路相关蛋白表达的影响Fig.4 Effects of Fuzheng Yiliu decoction on PI3K/Akt/mTOR signaling pathway related protein expression in A549 cells
3 讨论
目前尽管NSCLC治疗取得较大进展,但临床生存率仍很低。因此,寻找有效的NSCLC治疗靶点迫在眉睫。中药具有多种生物活性成分,能发挥良好的抗癌作用,被用于治疗包括癌症在内的多种疾病。在NSCLC治疗中也已有较多报道,例如,有研究报道中药温下肠腑方能抑制A549细胞系体外增殖和体内肿瘤生长,还能有效抑制化疗引起的免疫器官萎缩[15]。扶正抗癌方能有效抑制肝癌的侵袭与转移进而逆转肝癌细胞上皮间质转化(EMT)进程[16]。也有研究发现补肺汤能抑制NSCLC发生和发展[17]。本研究采用不同浓度扶正抑瘤汤处理A549细胞,CCK⁃8结果表明,在扶正抑瘤汤抑制A549细胞增殖过程中,细胞增殖抑制率呈剂量依赖性。另外,Transwell小室侵袭和划痕实验表明扶正抑瘤汤能抑制A549细胞侵袭和迁移。同时,流式细胞仪研究结果还显示扶正抑瘤汤处理细胞凋亡率明显升高。这些结果说明扶正抑瘤汤具有抑制A549细胞增殖、侵袭和迁移,并促进A549细胞凋亡的作用。
细胞自噬是一种被激活的程序性细胞死亡,通过消除细胞异常增殖以维持体内稳态,被认为是癌症治疗的靶点[18]。自噬由多种信号通路(如PI3K/Akt/mTOR信号通路)和细胞应激(如营养剥夺、缺氧或代谢应激)触发,但目前对基础自噬和刺激自噬的区别知之甚少。在癌症晚期,自噬正性增强,并通过吸收营养物质和能量促进肿瘤细胞增殖,抑制细胞凋亡[19]。自噬的启动一般始于ULK1激活,在自噬发生过程中,LC3Ⅰ与脂质磷脂酰乙醇胺(PE)结合形成LC3Ⅱ,最终被招募到细胞膜上,其蛋白表达水平和自噬溶酶体数量呈正相关。这种脂偶联形式的LC3作为自噬小体标记已被确立[20]。最终,自噬体的内容物被降解为大分子前体,自噬体与溶酶体融合后被循环利用或为代谢途径提供燃料。在此过程中,LC3通过P62降解测定自噬通量,该蛋白与其他作为自噬体和LC3Ⅱ重要底物的蛋白一起降解[20]。本研究采用扶正抑瘤汤处理A549细胞后,发现可上调Beclin⁃1蛋白表达,LC3Ⅱ/Ⅰ比值上升,且P62下调,自噬溶酶体数量增加,这些自噬相关蛋白及自噬溶酶体的变化表明扶正抑瘤汤能诱导A549细胞发生自噬。
P13K/Akt/mTOR信号通路是目前肿瘤发生发展研究的热点之一,在肺癌组织中活化表达,已成为肺癌的治疗靶点之一[21]。有研究报道,在酵母[22]、果蝇[23]和哺乳动物细胞[24]中,mTOR作为PI3K/Akt信号通路的下游成分,对自噬发挥着至关重要的作用。正常情况下,磷酸化的PI3K磷酸化Akt,然后激活mTOR[25],随后,mTOR 通过抑制协同自噬起始的ULK1负调控自噬[26]。本研究发现扶正抑瘤汤可降低A549细胞中P13K、Akt以及mTOR磷酸化水平,提示扶正抑瘤汤可能通过抑制P13K/Akt/mTOR信号通路促进自噬,从而抑制A549细胞恶性生物学行为的发展。
综上所述,本研究发现扶正抑瘤汤是治疗NSCLC的潜在有效药物,可以抑制A549细胞增殖、侵袭和迁移以及诱导细胞凋亡,其作用机制可能与扶正抑瘤汤阻断P13K/Akt/mTOR信号通路进而促进细胞自噬有关。

