鸭肠炎病毒gD蛋白亚细胞定位及其对病毒感染相关作用分析
张杨子 王璇 吴玙彤 潘淑惠 文正常 文明
摘要:本试验旨在研究鸭肠炎病毒(DEV)gD蛋白亚细胞定位及其对病毒感染的相关作用。本研究经过对DEV病毒扩增处理,利用原核表达系统获得重组gD基因胞外区蛋白(gDw),以兔抗gDw IgG为抗体,进行免疫荧光反应,对比病毒对照组,检查gD蛋白在吸附、侵入以及传播之间起到的作用。结果表明,经过荧光显微镜观察,接种DEV后4h可见绿色荧光,主要在细胞核附近。持续观察6~24h发现荧光随着时间增加明显加强,细胞轮廓清晰,主要存在于胞浆中。激光显微镜下观察接种DEV后4h可观察到绿色荧光,经过PI染色12h后可见绿色荧光更加明显,主要在胞浆中呈现,在胞核内没有出现特异性荧光。染色后72h可在细胞膜上观察到绿色荧光,且轮廓清晰。添加兔抗gDw IgG不会影响病毒粒子吸附率,在病毒粒子吸附中糖蛋白D并未产生明显作用。观察组吸附率和噬斑数与对照组有显著差异(P<0.05),添加兔抗gDw IgG后可有效降低病毒粒子侵入DEF,糖蛋白D具有阻止病毒侵入DEF的作用。添加兔抗gDw IgG后病毒噬斑直径明显减小,证实了在DEV细胞之间传播过程中糖蛋白D起到抵抗作用。DEF感染DEV后2h可检查到gD基因转录,经过免疫荧光实验,4h后可合成gD蛋白,出现在核膜和核周,12h出现在胞浆上,72h出现在细胞膜上。DEVgD参与病毒侵入以及细胞之间传播的作用,对于病毒吸附不明显,添加gDw Igw抗体后,细胞病变具有延迟反应。
关键词:鸭肠炎;病毒gD蛋白;亚细胞定位;病毒感染作用
鸭肠炎即鸭瘟,是由鸭肠炎病毒(DEV)引发的禽类感染传染病,具有较强的传染性,发病急,死亡率高[1]。一般情况下,禽类感染潜伏期约为3~5d,患病鸭表现出爱独处,头颈卷缩,双脚麻痹,羽毛松乱,不愿意行走。随着病情恶化开始腹泻,排泄物呈白色或绿色,有腥臭味,食欲减退、肛门红肿[2]。经过解剖,患鸭出现体腔积血以及组织出血,存在器官坏死。gD蛋白亚细胞是病毒传播的重要蛋白,具有中和病毒作用,作为一种中和抗原,能够诱导保护反应,鸭肠炎疫苗就是通过将病毒结构蛋白作为抗原免疫,从而达到预防作用。通过研究gD蛋白定位和感染病毒作用,能够实现鸭肠炎的预防和治疗。
1资料与方法
1.1实验材料
采购10日龄左右的鸭胚,制备鸭胚成纤维细胞(DEF)[3]。采购鸭肠炎病毒弱病株。准备分子生物学试剂以及生化试剂。准备DMEM细胞培养基、低熔点琼脂糖。配置PBS缓冲液、甲醇固定液以及碳酸盐缓冲液等。
1.2方法
1.2.1 gD蛋白亚细胞定位根据gD基因序列,收集不同感染时间的DEF,并取正常细胞为对照组。提取RNA,经过酶处理后,进行PCR扩增反应,将产物电泳处理。将DEV接种在载玻片上,接种1、2、4、6、12、24、72h后收获细胞。使用PBS溶液进行单层细胞的冲洗,同时使用多聚甲醛进行固定处理,重复冲洗3次。使用PBS溶液处理细胞。冲洗后使用羊抗兔IgG孵育1h,用PI染色液染色处理,再次用PBS冲洗,固定在载玻片上,进行显微镜观察。
1.2.2 gD蛋白对病毒的感染作用
1)吸附作用。将病毒溶解于DMEM(无血清)、兔抗gDw IgG、兔阴性血清中,接种单层DEF,处理2h去除接种物,使用PBS进行冲洗,将没有结合的游离粒子冲洗干净。在37℃条件下进行培养,对照组不需进行冲洗,直接覆盖低熔点琼脂糖。
2)侵入作用。将病毒溶解于DMEM(无血清)、兔抗gDw IgG、兔阴性血清中,在37℃条件下进行处理1h,丢弃接种物。对照组使用PBS溶液进行清洗,观察组使用醋酸盐缓冲液进行冲洗,经过2min处理后,侵入粒子完全灭活。
3)傳播作用。使用半固体营养琼脂充分吸收释放病毒粒子,DEV通过细胞之间直接传播形成噬斑。用病毒进行接种,然后覆盖有DMEM的营养琼脂经过培养后形成噬斑。进行染色处理后,测量噬斑直径。观察组中含有兔抗gDw IgG。
1.3统计学方法
采用SPSS 23.0软件处理数据,使用t检验计量资料,结果以平均值±标准差表示;使用卡房检验计数资料(%),P<0.05视为差异有统计学意义。
2结果
2.1 gD蛋白亚细胞定位
经过荧光显微镜观察,正常DEF在激发光下没有发现特异性荧光,经过PI染色后呈红色,可见椭圆形清晰轮廓。接种DEV后4h可见绿色荧光,主要在细胞核附近。持续观察6~24h发现荧光随着时间增加明显加强,细胞轮廓清晰,主要存在于胞浆中。激光显微镜下没有观察到DEF出现特异性绿色荧光。观察组接种DEV后4h可观察到绿色荧光,经过PI染色12h后可见绿色荧光更加明显,主要在胞浆中呈现,在胞核内没有出现特异性荧光。染色后72h可在细胞膜上观察到绿色荧光,且轮廓清晰。
2.2病毒gD蛋白对病毒吸附前后噬斑的变化
观察组处理后噬斑(64.71±2.54)个,吸附率(71.29±1.34)%。2组对比,无明显差异。具体结果详见表1。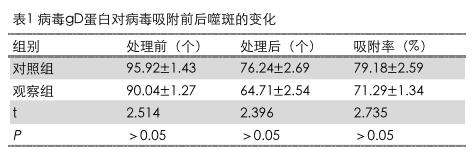
2.3病毒gD蛋白对病毒侵入前后噬斑的变化
观察组处理后噬斑(51.56±1.70)个,侵入率(65.12±2.31)%。两组对比,差异显著(P<0.05)。具体结果详见表2。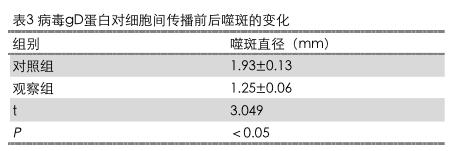
2.4病毒gD蛋白对细胞间传播前后噬斑的变化
观察组噬斑直径(1.25±0.06)mm。两组对比,差异显著(P<0.05)。具体结果详见表3。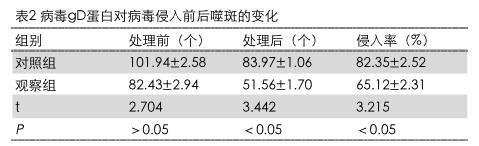
3讨论
gD是病毒囊膜的重要构成部分,对病毒侵入细胞有重要意义,负责病毒包膜的融合和病毒释放与扩散的介导作用。在病毒复制和中和抗体中gD也产生重要作用,是体液免疫、宿主细胞免疫的重要靶标。若病毒缺少gD基因,无法和细胞膜发生吸附作用,将造成病毒失去感染能力[4]。在病毒基因组中有至少80多个基因产物,但合成gD主要出现在病毒感染的早期,在DNA复制后合成,当病毒复制活跃后,6~12h开始大量聚集。通过免疫荧光技术可观察到感染4h后gD在核周囊泡上定位[5]。本研究也显示,经过荧光显微镜观察,正常DEF在激发光下没有发现特异性荧光,经过PI染色后呈红色,可见椭圆形清晰轮廓。接种DEV后4h可见绿色荧光,主要在细胞核附近。持续观察6~24h发现荧光随着时间增加明显加强,细胞轮廓清晰,主要存在于胞浆中。使用激光显微镜进行观察,没有观察到DEF出现特异性绿色荧光。观察组接种DEV后4h可观察到绿色荧光,经过PI染色12h后可见绿色荧光更加明显,主要在胞浆中呈现,在胞核内没有出现特异性荧光。染色后72h可在细胞膜上观察到绿色荧光,且轮廓清晰。可见gD定位表现出动态变化过程,和gD发挥功能以及DEF增殖存在密切关联性。在感染后4~6h为糖蛋白合成的活跃时期,从核膜向胞浆上转移,显微镜可观察到绿色荧光增加。感染24h后gD大量合成,胞浆内病毒数量增加,向胞外释放。在72h后观察到细胞膜上出现明显绿色荧光。
经本试验研究,添加gD抗体后会延迟DEV病变的发生,病变局限在少数细胞中,无法形成大范围噬斑,也证明了DEV感染过程是一个膜融合的过程。本研究显示,添加兔抗gDw IgG不會影响病毒粒子吸附率,在病毒粒子吸附中糖蛋白D并未产生明显作用。主要对病毒侵入和细胞之间感染产生抑制作用。gD并不会锚定包膜上,gD抗体中和病毒会造成病毒gD数量减少,从而影响病毒的侵入以及传播,最终造成病变延迟。本研究也显示,观察组处理后噬斑(51.56±1.70)个,侵入率(65.12±2.31)%。观察组与对照组对比,差异显著,证实观察组吸附率和噬斑数和对照组有显著差异,添加兔抗gDw IgG后可有效降低病毒粒子侵入DEF,糖蛋白D具有阻止病毒侵入DEF的作用。观察组与对照组对比,差异显著。添加兔抗gDw IgG后病毒噬斑直径明显减小,证实了在DEV细胞之间传播过程中糖蛋白D起到抵抗作用。目前关于gD蛋白的基因研究还相对较少,未来还需要针对gD亚单位疫苗、gD核酸疫苗展开研究,从而有效预防和治疗鸭肠炎。
4小结
综上所述,DEF感染DEV后2h可检查到gD基因转录,经过免疫荧光试验,4h后可合成gD蛋白,出现在核膜和核周,12h出现在胞浆上,72h出现在细胞膜上。DEVgD参与病毒侵入以及细胞之间传播的作用,对于病毒吸附不明显,添加gDw Igw抗体后,细胞病变具有延迟反应。█
参考文献:
[1]张旭,郑敏,吴征卓,等.鸭肠炎病毒感染对鸭十二指肠转录组的影响[J].动物医学进展,2020,41(10):73-79.
[2]杨霞,蒲翠敏,胡安东,等.鸭肠炎病毒感染对鸭肠道菌群多样性的影响[J].中国预防兽医学报,2020,42(8):772-778.
[3]张旭,吴征卓,姚碧琼,等.鸭肠炎病毒感染对鸭肠道黏膜组织转录组变化分析[J].基因组学与应用生物学,2020,39(5):1972-1981.
[4]毛娅卿,张兵,王团结,等.UL56基因下游3513bp对鸭肠炎病毒生物特性的影响[J].中国农业科学,2019,52(23):4390-4397.
[5]孙莹,张兵,李岭,等.表达H9亚型禽流感病毒HA基因重组鸭肠炎病毒的构建[J].中国农业科学,2019,52(23):4398-4405.

