腺苷酸活化蛋白激酶α在高血糖大鼠急性创面再上皮化过程中的表达
王治兵,徐秋燕,王宝宏,张艳冰,曹露莹,马 凯,侯绍章,董俭达
(1.宁夏贺兰县人民医院,贺兰 750200;2.宁夏医科大学临床学院,银川 750004;3.宁夏医科大学基础医学院病理学系,银川 750004)
中国是目前糖尿病患者最多的国家[1]。我国因慢性创面住院的患者,其中糖尿病相关创面达32.6%[2]。早期发现糖尿病慢性难愈创面的危险因素,积极干预急性创面延迟愈合(delayed wound healing,DWH)的问题,对预防糖尿病足等慢性难愈性创面的发生具有关键作用[3-4]。再上皮化障碍(re-epithelialization disorder,RED)是DWH的关键事件,与DWH恶化及慢性难愈性创面发生密切相关[3-4]。腺苷酸活化蛋白激酶(AMPK)是细胞内重要的能量感受器,在糖尿病发生和发展中具有重要作用[5]。有研究[6]发现AMPK的激活剂二甲双胍对糖尿病创面愈合有促进作用,其机制尚不清楚。本研究通过建立高血糖大鼠模型,制备大鼠皮肤急性创面,利用二甲双胍局部处理创面,动态观察AMPKα其创面再上皮化(re-epithelialization,RE)区角质形成细胞(KCs)中的表达,为糖尿病创面DWH的机制研究提供实验线索,为糖尿病创面临床治疗提供潜在的靶点。
1 资料与方法
1.1 材料及仪器
雄性Sprague Dawley(SD)大鼠30只,体质量150~160g,由宁夏医科大学实验动物中心提供[Ⅰ级动物,合格证编号SCXK(N)2015-0001]。链脲佐菌素(STZ,Sigma公司,美国),盐酸二甲双胍肠溶片(批号:148880484;天安药业股份有限公司),血糖测试仪(博仕珑,GLM-7911W,中国),皮肤取样器(皮肤环钻,直径5 mm,Acuderm公司,美国),小鼠单克隆IgG2a(kappa轻链)AMPKα1/2抗体(克隆号:D-6;Santa Cruz公司,美国),ABC试剂盒为VECTASTAIN Elite ABC HRP Kit(Peroxidase,Mouse IgG)(PK-6102),ImmPACT DABPeroxidase(HRP)Substrate(SK-4105),均购自美国Vector Laboratories公司,苏木素-伊红试剂(DH0006,Leagene公司,中国)。
1.2 方法
1.2.1 动物分组和高血糖大鼠制备 实验大鼠随机分为正常血糖对照组(NC)、高血糖组(DC)、高血糖二甲双胍干预组(DM),每组10例。饲养于宁夏医科大学实验动物中心,温度22℃,明暗周期12 h∶12 h,在实验室饲养并适应1周。血糖检测前,禁食12~24 h,尾静脉取血备检。以pH为4.6的柠檬酸-柠檬酸钠缓冲液配制10%STZ,以65 mg·kg-1剂量腹腔注射,注射后每天观察并测量大鼠体质量、食入量、饮水、毛色及活动情况,继续饲养1周,测定尾静脉血糖。血糖检测前大鼠尾静脉取血,血糖计检测,以空腹血糖>16.7 mmol·L-1作为高血糖状态的判定标准[7]。
1.2.2 创面制备、处理及标本收集 10%水合氯醛腹腔注射(0.3 mL/100 g)予以麻醉,背部备皮,常规消毒,利用王宝宏发明并制作的动物皮肤创面制备装置(专利证书号:10032087),在大鼠背部脊柱两侧制备4个两两对称的5 mm全层皮肤创面模型[8]。无菌条件下,将二甲双胍研磨至粉末,与医用凡士林1∶2充分混匀,配为霜剂,4℃冰箱保存备用。DM组创面1 cm×1 cm区域涂抹二甲双胍凡士林霜剂,1次/d。于实验第1、3、6、9、12天,每个时间点每组麻醉2只大鼠,快速切取创面组织。收集创面周围1 cm×1 cm区域皮肤全层创面组织,每组8个创面,创面旁放置比例尺并用相机拍照记录,创面组织沿最大直径切开,一半创面置于4%甲醛溶液中固定24 h,垂直放入包埋盒,组织梯度乙醇脱水过夜,浸蜡,石蜡包埋,连续切片10张(厚度4μm),另一半创面组织-80℃冻存。皮肤创面照片利用Photoshop软件进行伤口最大直径测量。
1.2.3 苏木素-伊红染色(HE) 石蜡切片二甲苯脱蜡,梯度乙醇至水,苏木精液染色室温10 min,流水冲洗,1%盐酸乙醇分化1~3 s,流水冲洗,自来水浸泡返蓝,0.5%伊红液染色30~60 s,梯度乙醇浸泡,80%乙醇1~2 s,95%乙醇1~2 s,无水乙醇1~2 s,二甲苯10 min,中性树胶封片。由Motic数字切片系统扫描保存为数字切片。
1.2.4 免疫组化染色 切片二甲苯脱蜡至水,0.01 mol·L-1柠檬酸钠缓冲液(pH 6.0)微波加热修复10 min,冷却,3%H2O2室温孵育10 min,PBS冲洗,10%山羊血清室温封闭30 min,吸去,AMPKα1/2的一抗工作液4℃过夜,同时另一切片以PBS取代一抗4℃孵育过夜作为阴性对照;PBS冲洗,生物素化的山羊抗小鼠二抗室温孵育30min,PBS冲洗,试剂盒A(1∶50)和B(1∶50)混合液(A:Avidin溶液;B:生物素化辣根过氧化物酶)室温孵育30 min,PBS冲洗,DAB显色,苏木素复染,中性树脂封片,由Motic数字切片系统扫描保存为数字切片。免疫组化结果判定标准[9]:染色分为阳性和阴性两种结果,以细胞胞膜和(或)胞质出现棕黄色颗粒状着色判断为阳性,以细胞胞膜和(或)胞质内无棕黄色颗粒状着色判断为阴性。AMPKα的阳性着色分布于细胞膜和(或)胞质。
1.2.5 计量组织学分析方法 在每个时间点选取每组大鼠4个不同创面的组织切片,利用采用Motic图像软件测量表皮伤口直径、真皮伤口直径[9]。表皮伤口直径=两侧创缘再上皮化表皮之间区域的长度。AMPKα染色结果的半定量检测[9]:在每个时间点选取每组大鼠4个不同创面的组织切片,镜下区分创旁正常表皮区及RE区,在以上区域分别随机选取5个高倍视野(HPF)。利用Image J软件,将AMPKα染色结果的扫描图片从TIF格式转为8-bit图片,利用软件中Threshold功能选定阳性区域,Threshold参数0.28~2.71,所有待检图片参数保持一致;随后利用Image J软件检测平均OD值(阳性强度,OD值范围:0~2.71)及阳性面积百分数(阳性率,阳性区域占总检测区域的百分比)检测,检测3次,取平均值作为参考值。AMPKα平均阳性强度=AMPKα测量OD值/检测区域总面积。分别检测待测样本每个HPF的AMPKα平均阳性强度,计算多个高倍视野平均阳性强度的均值作为本组样本的测量参考值。AMPKα在RE区KCs细胞中的相对表达水平计算公式:AMPKα相对表达水平=AMPKα在RE区平均阳性强度(OD值)/AMPKα在对应周边正常表皮中的平均阳性强度(OD值)。
1.3 统计学方法
用SPSS 23.0统计软件对数据进行统计学分析,计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用方差分析,方差不齐时用多个独立样本非参数检验,P≤0.05为差异有统计学意义。
2 结果
2.1 大鼠体质量及血糖
实验前各组大鼠体质量及血糖差异均无统计学意义(P均>0.05)。实验后(注射STZ 1周后),与NC组大鼠比较,DC组和DM组大鼠出现多饮、多食、多尿及体质量减轻,毛色无光泽,活动度降低;与NC组比较,DC组和DM组大鼠体质量均降低(P均<0.05);血糖方面,与NC组比较,DC组和DM组大鼠尾静脉血糖均升高(P均<0.05);与DC组比较,DM组体质量和血糖的差异均无统计学意义(P均>0.05),见表1。
2.2 创面愈合过程的大体观察
各组大鼠背部急性创面制备成功后,伤口形状规则、圆形,直径5 mm,创面清洁,创缘整齐,仅见极少量出血,无明显渗出。实验第1天,肉眼观察各组大鼠背部创面,伤口均呈较为规则的圆形,创缘周边组织轻度发红、肿胀并略微隆起,创腔内可见少量血痂附着,未见明显脓性渗出及新鲜出血。实验第3天,NC组大鼠伤口收缩减小,创缘整齐;DC组和DM组大鼠伤口肉眼观察亦有收缩变小,与NC组大鼠比较,伤口收缩减小程度较小。实验第6天,NC组大鼠较之前伤口明显收缩减小,甚至个别大鼠伤口已完全愈合;DC组和DM组大鼠伤口肉眼观察亦有收缩变小。实验第9天,NC组大鼠创面均已完成愈合;DC组大鼠较之前伤口轻度收缩变小,尚未完全愈合;DM组大鼠较之前伤口明显收缩变小,呈较规则点状及小圆形,已基本完成愈合。实验第12天,NC组和DM组大鼠伤口均已完全愈合;DC组大鼠伤口明显收缩变小,但尚未完全愈合,见图1。
2.3 创面愈合的镜下特征
实验第1天,由皮肤表层到皮下组织由上到下观察,各组大鼠伤口开放,创底深达浅层皮下组织层(符合模型制备全层皮肤创面的要求)。实验第3天,各组大鼠伤口均显示开放,创缘可见数量不一的再生性KCs细胞构成的RE区,伤口底部可见肉芽组织形成。伴随实验时间变化,各组大鼠镜下伤口长度呈变小的趋势,至实验第12天,仅DC组大鼠部分创面未完全愈合,其他组大鼠均已完全愈合,见图2。镜下表皮伤口长度的测量结果显示,实验第3天,与NC组比较,DC组和DM组伤口均较大(P均<0.05);与DC组比较,DM组伤口较大(P>0.05)。实验第6天,与NC组比较,DC组伤口较大(P<0.05),DM组差异无统计学意义(P>0.05);与DC组比较,DM组伤口较小(P<0.05)。实验第9天,与NC组和DM组分别比较,DC组伤口较大(P均<0.05);NC组及DM组伤口已完成RE区KCs细胞完全覆盖,完成RE过程。实验第12天,与NC组和DM组伤口分别比较,DC组较大(P均<0.05);DC组尚未完成RE区KCs细胞覆盖,见表2。
表1 不同处理组大鼠体质量和血糖检测结果比较(±s)

表1 不同处理组大鼠体质量和血糖检测结果比较(±s)
与NC组比较*P<0.05。
?
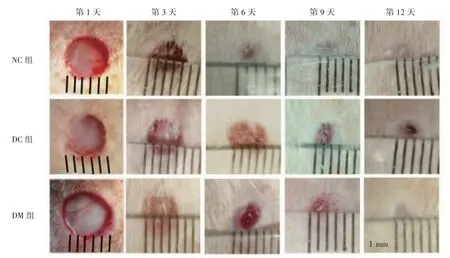
图1 各组大鼠创面愈合过程大体图
2.4 AMPKα的表达
2.4.1 AMPKα在各组大鼠皮肤组织中的表达 AMPKα主要表达在表皮、毛囊、皮脂腺及浅层横纹肌组织中,其中在表皮角质形成细胞中的表达最多。AMPKα在大鼠皮肤表皮各层细胞中表达不同,基底细胞显示低表达,棘层细胞低到中等强度表达,颗粒层及角化层细胞高表达。为定位于胞质和胞膜的棕黄色染色。AMPKα在大鼠正常表皮中的表达,NC组OD值为(0.51±0.08)(n=40 HPF),DC组OD值为(0.53±0.08)(n=60 HPF),DM组OD值为(0.54±0.07)(n=60 HPF),与NC组比较,DC组和DM组表达差异均无统计学意义(P均>0.05),见图3。
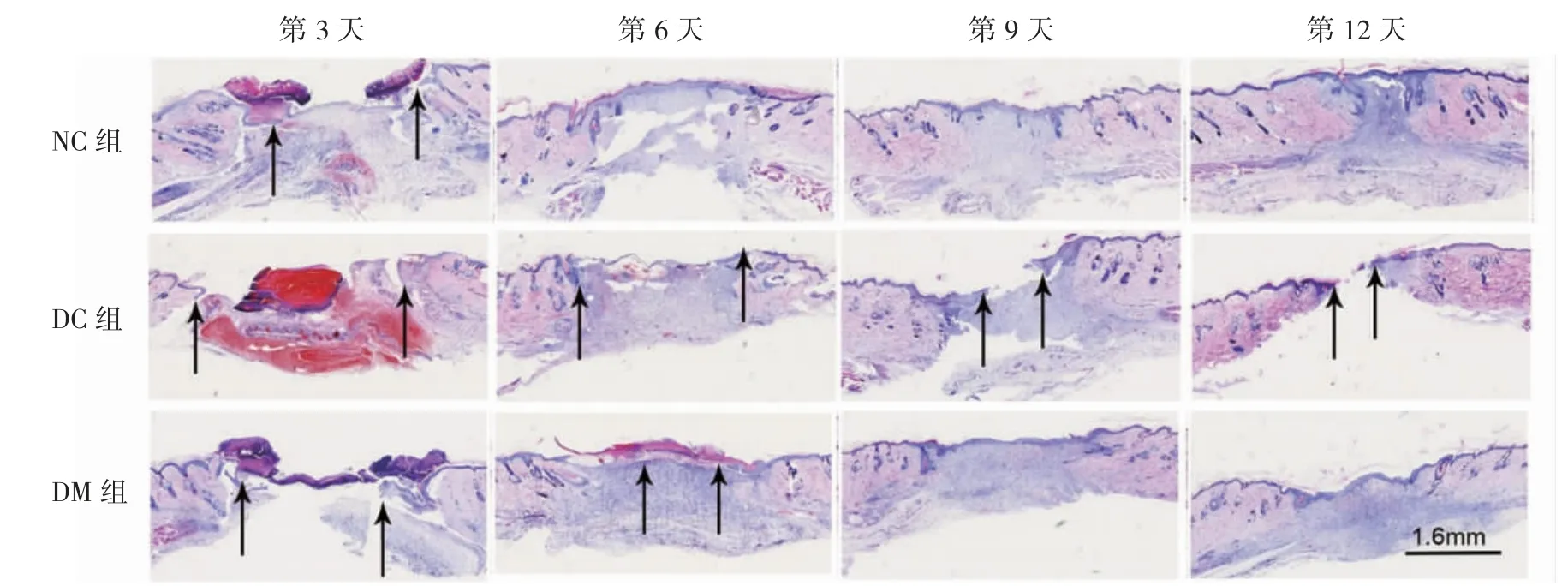
图2 各组大鼠创面组织HE染色(箭头:镜下表皮创缘)
表2 各组大鼠镜下表皮伤口长度比较(±s,mm)
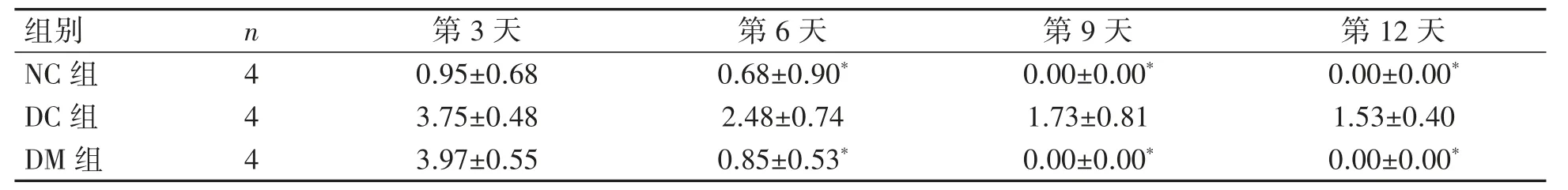
表2 各组大鼠镜下表皮伤口长度比较(±s,mm)
与同时间DC组比较*P<0.05。
?
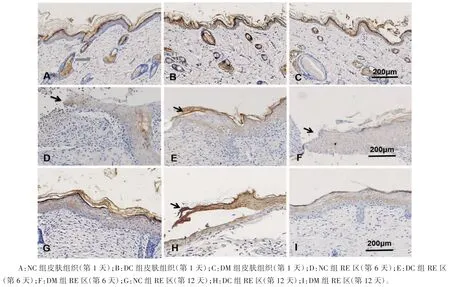
图3 AMPKα的免疫组化染色(黑箭头为创缘)
2.4.2 AMPKα在各组大鼠创面RE区KCs细胞中的表达 AMPKα在NC组、DC组及DM组大鼠创面RE区KCs细胞中呈淡黄色或黄色低强度表达(图3D~I)。第6天和第12天,不同处理组大鼠RE区AMPKα表达OD值测量结果显示:NC组、DC组和DM组RE区均低于其对应周边表皮组织(P均<0.05),见表3。
表3 不同处理组大鼠皮肤创面AMPKα表达的OD值测量结果比较(±s)
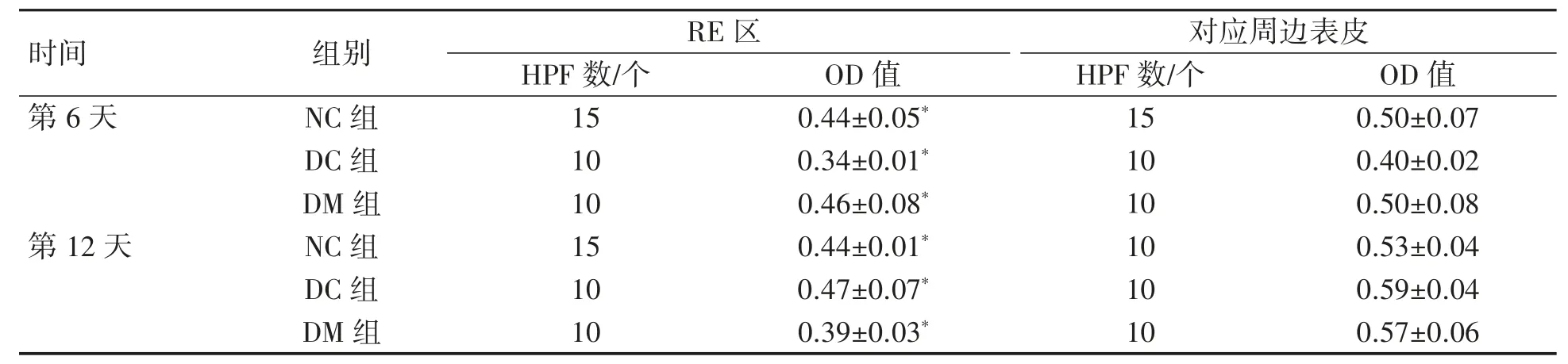
表3 不同处理组大鼠皮肤创面AMPKα表达的OD值测量结果比较(±s)
与对应周边表皮比较*P<0.05。
?
2.4.3 AMPKα在各组大鼠创面RE区KCs细胞相对表达水平的比较 比较不同处理组大鼠RE区AMPKα的相对表达水平:第6天和第12天,NC组、DC组及DM组的三组间比较差异均有统计学意义(P均<0.05);NC组与DC组间差异无统计学意义(P均>0.05);与NC组比较,DM组均较低(P均<0.05);与DC组比较,DM组较低(P均<0.05),见图4。
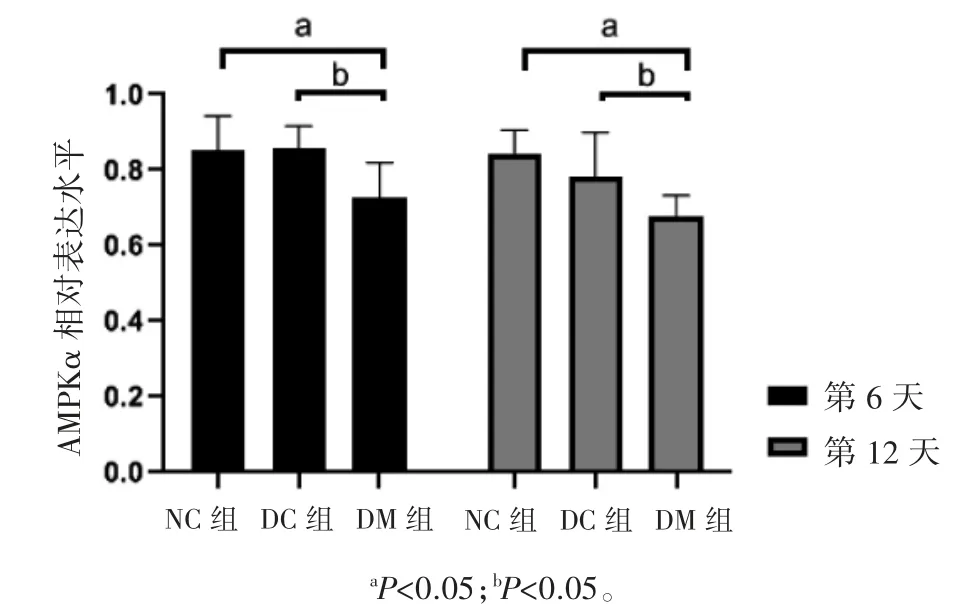
图4 AMPKα在再上皮化角质形成细胞相对表达水平比较
3 讨论
研究发现,糖尿病创面难愈可能与创面高糖微环境,糖基化终末产物(AGEs)增多以及活性氧(ROS)过度激活的损伤有关[10]。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是一种在进化上保守的丝氨酸/苏氨酸激酶,广泛参与对蛋白质、脂肪、糖和核苷酸代谢的调节[5]。AMPK是一个异三聚体结构,包含1个催化亚基α(α1和α2)及两个调节亚基β(β1和β2)及γ(γ1,γ2和γ3),β亚基连接α及γ亚基,γ亚基具有AMP和ATP的理论结合位点[5]。研究发现[11]AMPK能够直接感知葡萄糖,通过溶酶体途径磷酸化激活AMPK。目前AMPK在创面愈合过程中RE区的表达模式还不清楚。本研究通过建立高血糖大鼠急性皮肤创面模型,为AMPK参与调控创面修复的机制研究提供实验证据。
本研究的实验结果显示,DC组和DM组大鼠血糖均高于16.7 mmol·L-1,体质量低于NC组大鼠,与文献报道一致[12]。在创面愈合过程动态观察中发现,实验第6天NC组大鼠愈合明显,未愈合区伤口规则,创面清洁;DC组大鼠虽有收缩变小,但创面缺损区面积较NC组大,伤口形状欠规则,提示高血糖大鼠创面愈合不良,发生DWH。本实验的镜下表皮伤口长度测量结果也显示,实验第3、第6、第9和第12天,DC组大鼠均大于NC组;实验第12天NC组大鼠伤口RE区已被再生表皮完全覆盖,完成RE过程,但DC组大鼠仍有部分区域未完全愈合,RE区未完全被再生表皮覆盖。以上结果证实高血糖大鼠创面出现DWH,并出现RED情况与文献报道基本一致[8],提示本研究的高血糖大鼠创面延迟愈合(DWH)模型制备成功。皮肤创面RE区的KCs细胞属于上皮细胞,在创面修复过程中,再生的上皮细胞可以转变为具有增殖和移行能力的间质样细胞,其成熟上皮的标记物(K10和CFTR等)或细胞间连接蛋白(E-cadherin及Zo-1等)出现下调表达[9]。本实验发现,在NC组、DC组及DM组大鼠中,伴随创面愈合过程,RE区AMPKα均出现下调表达低于周围正常皮肤表皮,这与文献报道[9]的成熟上皮标记物及细胞间连接蛋白表达模式非常类似,提示AMPK可能是KCs细胞成熟分化的潜在标记物,其下调表达可能参与了对其增殖和移行的促进作用。本实验的结果还显示,DC组大鼠皮肤表皮AMPK本底表达水平较正常血糖组高,提示高糖可能会诱导AMPK表达升高并参与对RE过程影响和调节。有研究[13]发现,AMPK激活剂可以抑制体外培养的KCs细胞生长,提示AMPK介导的能量代谢途径对KCs细胞有潜在影响。AMPK还可以被其上游钙相关的激酶LKB1磷酸化激活,磷酸化激活的AMPK可以部分介导上皮细胞紧密连接的组装和分解[14-15]。以上研究提示AMPK上调表达与上皮细胞的成熟分化正相关,成熟分化的上皮细胞会出现增殖和移行能力的降低。在创面愈合过程中,RE区KCs细胞E-cadherin可出现先下调表达情况[16],这一点与AMPK的表达模式也非常相似。因此,AMPK在RE区的下调表达可能有利于KCs细胞增殖和移行,促进RE过程早期和中期快速覆盖创面的过程;一旦RE过程完成,AMPK在再生的表皮中可能会逐步上调表达,逐渐完成对表皮结构和功能的重建和恢复,当然这还属于科学假设,需要未来的工作进一步研究证实。
降糖药二甲双胍外用可以促进糖尿病大鼠创面愈合过程[6,8,17],同时二甲双胍是AMPK的激活剂已被证实[5];但二甲双胍是否是通过影响AMPK表达参与创面修复的调节,目前还不清楚。本实验中,我们利用二甲双胍霜剂局部处理高血糖大鼠(DM组)创面,结果显示,在DM组大鼠创面愈合明显好于DC组大鼠,并接近NC组的愈合情况。在本实验的第6、第9和第12天,DM组大鼠表皮伤口长度小于高血糖组;实验第12天DM组大鼠伤口RE区已被再生KCs细胞完全覆盖,完成RE过程。提示二甲双胍促进了高血糖大鼠创面愈合过程,改善了其DWH和RED问题,可能对RE过程具有一定的调节作用。本实验进一步观察了二甲双胍处理的高血糖大鼠创面RE区AMPK的表达情况,发现第6天及第12天,DM组大鼠RE区AMPK表达均低于NC组和DC组,提示AMPK的相对低表达对于创面愈合的RE过程具有潜在促进作用,二甲双胍促进糖尿病创面愈合可能与改善RED有关。研究表明AMPK可能不单通过其磷酸化调节细胞功能[5],其本身的表达也会对细胞功能产生影响,当然具体机制阐明也一定需要结合未来对AMPK磷酸化情况研究进一步证实。有研究发现AMPK可以抑制转化生长因子、血管紧张素及醛固酮诱导的上皮间质转化(EMT)过程,同时促进间质上皮转化(MET)[18]。还有研究发现AMPK可以被其上游钙相关的激酶LKB1磷酸化激活,磷酸化激活的AMPK可以部分介导上皮细胞紧密连接的组装和分解[14,19],提示AMPK参与对EMT/MET的复杂调节作用,这样的情况在气道[20]和消化道上皮[15]上也被验证。以上研究与本项目关注的皮肤表皮KCs细胞的实验结果相似,提示AMPK对上皮细胞功能状态的调控作用可能具有相对的广泛性。高糖可引起皮肤KCs细胞AMPK表达升高,但AMPK激活剂却可以下调其表达,其中具体作用机制仍不清楚,需进一步研究。

