6个马铃薯新品系的细胞学及SSR分析
李 靓,于 卓,于肖夏,杨东升,卢倩倩,李景伟,李佳奇,刘宇飞
(内蒙古农业大学 农学院,内蒙古 呼和浩特 010019)
马铃薯(Solanum tuberosumL.)起源于南美洲的秘鲁、玻利维亚等短日照地区的安第斯山,约17纪中叶传入中国,目前是仅次于水稻、小麦、玉米的世界第四大粮食作物[1]。马铃薯亦粮亦菜[2],块茎含有丰富的营养成分,素有“地下苹果”的美称。我国是马铃薯第一生产大国和消费大国[3],种植面积和总产约占世界总面积和总产的1/4[4],然而,与西方发达国家相比,我国马铃薯加工产业较滞后,特别是加工专用型及特色保健型彩色马铃薯品种缺乏。
专用型马铃薯品种分为鲜食专用型(包含块茎为白肉和黄肉的普通鲜食型、块茎薯肉为彩色的特色马铃薯)、薯条薯片油炸专用型、淀粉和全粉加工专用型等[5]。鲜食专用型马铃薯品种要求芽眼浅,薯块淀粉含量13%~17%,食味好,不麻口,煎、炒时不易成糊状。薯片或薯条油炸专用型马铃薯品种要求薯块为圆形或长圆形,还原糖含量低于0.2%。淀粉加工专用型马铃薯品种要求薯块淀粉含量19%以上[6],全粉加工型马铃薯品种要求干物质含量24%以上,还原糖含量小于0.3%。目前,我国90%的马铃薯是以鲜食形式消费,仅有小部分用于加工利用[7]。今后马铃薯产业发展亟待选育优质高产抗病性强的特色保健型的彩色马铃薯和加工专用型马铃薯新品种。
近几年来,内蒙古农业大学马铃薯遗传育种实验室采用常规杂交及分子标记辅助选择相结合的方法,选育出6个综合农艺性状表现优异的马铃薯新品系NNS-P 11、NNS-H 6、NNS-H 4、NNS-C 10、NNS-L 9和NNS-Y 40,本试验拟采用常规制片法对这6个马铃薯新品系的花粉育性及其减数分裂中期Ⅰ(PMCMⅠ)染色体配对构型进行分析,以明确其细胞遗传学差异;并利用具有共显性的SSR(Simple sequence repeats)分子标记技术[8]分析各品系间在DNA水平上的遗传差异,旨在为下一步的新品种育成和登记利用提供分子细胞遗传学依据。
1 材料和方法
1.1 试验材料与种植方式
材料为马铃薯新品系NNS-P 11(黑美人×MIN-021)、NNS-H 6(HLH×MIN-021)、NNS-H 4(HLH×MIN-021)、NNS-C 10(H027×黑美人)、NNS-L 9(陇薯7号×MIN-021)和NNS-Y 40(4Y×MIN-021),对照材料为MIN-021。种薯由内蒙古农业大学马铃薯遗传育种研究室提供,种薯级别为原种。试验于2019年5-9月在托克托县古城镇南的力图马铃薯育种试验基地进行。土壤为沙壤土,pH值7.5~8.1,肥力中等。种植方式为单垄穴播,株距25 cm,行距75 cm,播深约12 cm,各材料均种植200 株。在植株生长期间,防杂草,并适时灌水、施肥,以满足植株生长发育的需求。
1.2 试验方法
1.2.1 花粉育性的观测 在马铃薯的盛花期,随机采集各材料盛开的花蕾带回室内,用镊子将花药中的花粉均匀的抖落在载玻片上,滴1%醋酸洋红染液,染色15 s,在10倍显微镜下观察统计各材料可育和不可育花粉粒数,约150个视野。观察标准:染色均匀且较深,内容物饱满的花粉粒为可育花粉;染色不均匀且畸形、瘪缩的花粉粒为不可育花粉。花粉可育率(%)=(可育花粉粒总数/观察的花粉粒总数)×100%[9]。
1.2.2 PMCMⅠ(花粉母细胞减数分裂中期Ⅰ)染色体配对行为观测 在马铃薯的现蕾期,于8:30-11:00在田间采取各材料的幼小花蕾,立即放入装有卡诺试液的试管中,带回实验室先放在4 ℃冰箱固定24 h,取出后用95%酒精洗涤2~3次,存放在70%酒精中,置4 ℃冰箱中备用[10-11]。制片时,用镊子取一个花蕾放置在干净的载玻片上,剥出花药,挤出花粉母细胞,去除杂质后加一滴卡宝品红试剂染色20 s,盖上载玻片用镊子轻敲、压片。在Olympus BX51显微镜100倍下观察并统计染色体数目,每个材料观察细胞数约150个,选取染色体清晰的细胞拍照。
1.2.3 供试材料DNA提取及纯度检验 在苗期每种材料随机选取0.20 g嫩叶,用植物DNA试剂盒及说明步骤提取基因组DNA。用1.5%的琼脂糖凝胶电泳和UV-2401PC双光束紫外分光光度计检验各供试材料的纯度和浓度后,将DNA的浓度稀释至50 ng/μL,置于-20 ℃冰箱中保存备用[12]。
1.2.4 SSR引物来源及合成 本试验所用的35对引物从NCBI网站公布的马铃薯SSR特异性引物中选取,委托上海生工生物有限公司合成[13]。用新品系NNS-P 11、NNS-H 6及对照MIN-021的基因组DNA进行SSR适宜引物筛选出了条带清晰、多态性好的SSR引物10对(表1)。

表1 SSR适宜引物名称和碱基序列Tab.1 SSR suitable primers name and base sequence
1.2.5 PCR扩增体系与程序 SSR-PCR扩增反应总体积为20.0 μL,包括上下游引物(0.500 μmol/L)各0.7 μL,模板DNA 2.0 μL,TaqDNA聚合酶0.1 μL,dNTPs(0.225 mmol/L)1.4 μL,10×PCR Buffer(含Mg2+)2.0 μL,13.1 μL的ddH2O。
扩增反应程序:94 ℃预变性5 min;94 ℃变性0.5 min,55 ℃退火45 s,72 ℃延伸90 s,5个循环;95 ℃变性30 s,53 ℃退火45 s,72 ℃延伸90 s,35个循环;72 ℃延伸10 min反应终止后,将扩增产物置于4 ℃冰箱中保存。
1.2.6 供试材料PCR扩增产物的电泳检测 将灌好的6% PAGE胶板静止2 h后,在恒定功率70 W的电泳仪上预电泳30 min,点样量5.2 μL,Marker 100 bp DNA Ladder 2.5 μL,电泳时间1.2 h。电泳结束后将胶板放入固定液(冰乙酸20 mL、无水乙醇200 mL、蒸馏水1 800 mL)中,在摇床上低速摇荡20 min,用蒸馏水漂洗3 min,用AgNO3溶液于黑暗条件下银染15 min后,蒸馏水速漂2次,再放入显影液(30 g NaOH、2 L蒸馏水、10 mL甲醛)中轻轻摇晃直至条带清晰,于通风处晾干后扫描并统计[14]。
1.2.7 SSR多态性位点统计 胶板上SSR等位基因多态性位点的统计采用0/1赋值法,有条带计“1”,无条带计“0”,生成“0”、“1”二元数据矩阵,计算多态性条带位点百分率(Percentage of polymorphic bands,简称P)=(扩增出的多态性条带数目/扩增出的条带总数)×100%[15]。
2 结果与分析
2.1 供试材料花粉育性及PMCM Ⅰ染色体配对构型
2.1.1 各新品系及对照的花粉育性 各马铃薯新品系及对照的花粉育性结果如表2所示。对照品种MIN-021的花粉可育率为50.86%。各新品系花粉可育率变幅在39.95%~81.12%,其中新品系NNS-Y 40的花粉育性最低,为39.95%,<50.00%,宜作母本材料进一步杂交改良利用,其余材料的花粉育性均>50.00%,NNS-P 11、NNS-H 4、NNS-C 10的花粉育性较高分别为81.12%,77.94%,77.76%,其次是新品系NNS-H 6、NNS-L 9的花粉育性,分别为67.27%,69.71%,它们均可作为父本材料进一步杂交利用。
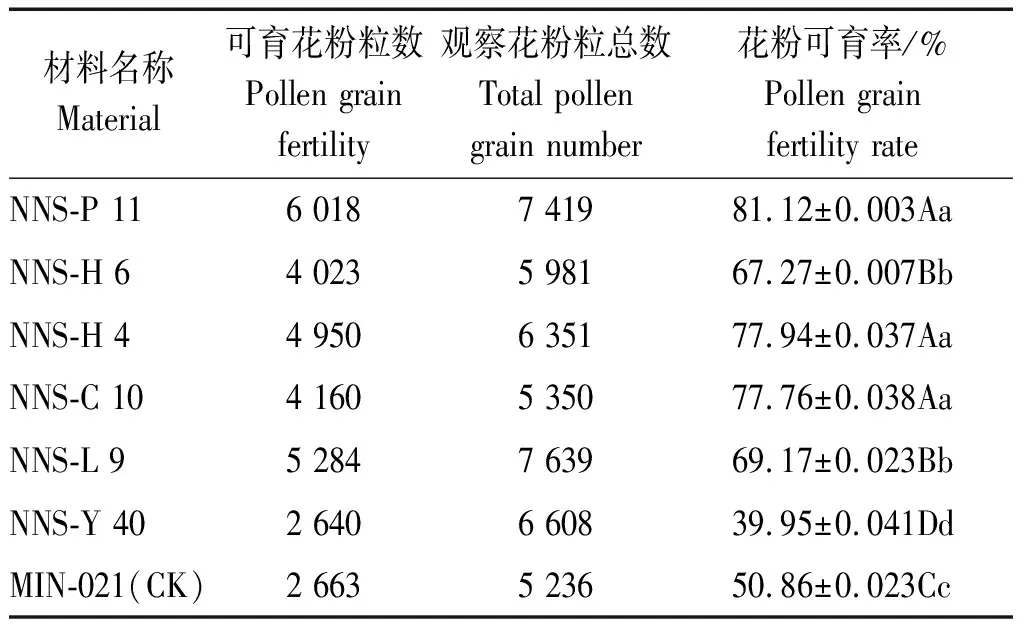
表2 各新品系及对照的花粉可育率观测结果Tab.2 Observation results of the pollen fertility rate for the new strains and control sample
2.1.2 新品系及对照的细胞PMCMⅠ染色体配对构型分析 由图1和表3可知,各供试材料花粉母细胞减数分裂中期Ⅰ(PMCMⅠ)的染色体配对构型有一定差异。对照品种MIN-021的染色体构型为2n=4x=48=6.94Ⅰ+8.32Ⅱ+4.02Ⅲ+3.09Ⅳ,其中6个马铃薯新品系间的单价体频率变幅为1.08~8.23,二价体频率变幅为6.92~14.89,三价体频率变幅为1.18~6.07,四价体频率变幅为1.93~3.40。6个马铃薯新品系NNS-P 11、NNS-H 6、NNS-H 4、NNS-C 10、NNS-L 9和NNS-Y 40的染色体配对构型依次分别为2n=4x=48=1.08 Ⅰ+14.89 Ⅱ+1.18Ⅲ+3.40Ⅳ、2n=4x=48=2.35Ⅰ+11.96Ⅱ+3.59Ⅲ+2.74Ⅳ、2n=4x=48=2.10Ⅰ+14.21Ⅱ+1.35Ⅲ+3.02 Ⅳ、2n=4x=48=3.31Ⅰ+13.98Ⅱ+2.99Ⅲ+1.94 Ⅳ、2n=4x=48=3.45Ⅰ+12.94Ⅱ+2.81Ⅲ+2.56 Ⅳ和2n=4x=48=8.23 Ⅰ+6.92 Ⅱ+6.07 Ⅲ+1.93 Ⅳ。
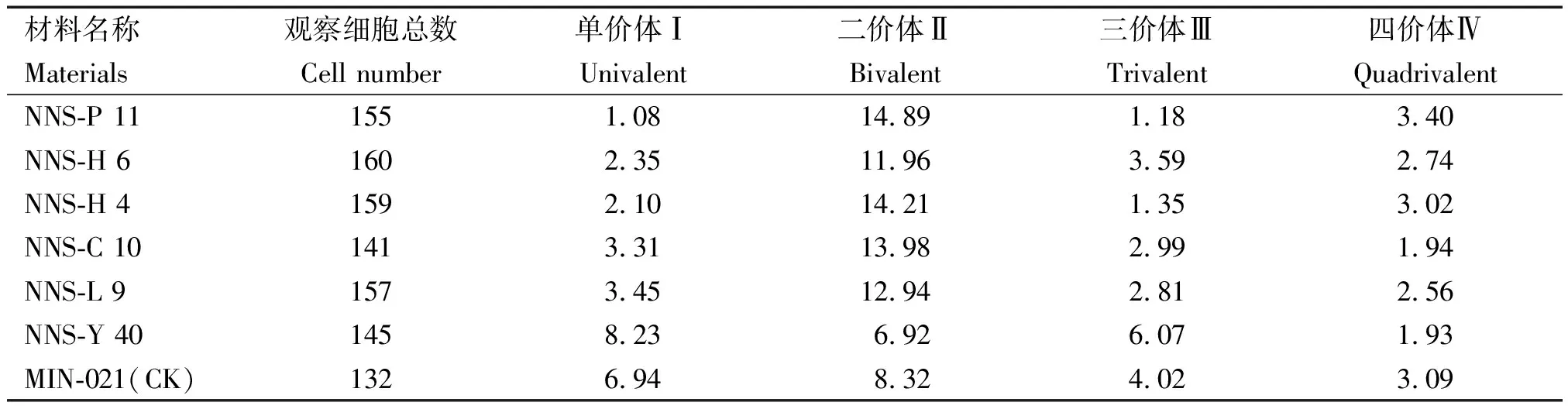
表3 各新品系及对照PMCMⅠ染色体配对构型Tab.3 Chromosome configuration of the new strains and control sample at PMCMⅠ
2.2 马铃薯新品系及对照材料的SSR分析
2.2.1 供试材料基因组DNA的质量检测 6个马铃薯新品系及对照品种的DNA进行琼脂糖凝胶电泳检测,结果显示,基因组DNA的电泳条带清晰稳定,无拖尾,表明提取的各试样DNA纯度高,符合SSR分子标记电泳分析的要求(图2)。
2.2.2 供试材料基因组DNA的SSR指纹特征 利用筛选出的10对SSR适宜引物对各供试材料基因组DNA进行PCR扩增,结果见表4。10对引物扩增出的片段在280~380 bp,共扩增出清晰稳定的SSR条带105个,其中多态性条带82个,每对引物扩增出5~13条多态性条带,平均每对引物扩增出10.5个多态性条带,多态性比率为78.10%,表明这7个供试材料间的遗传差异较大。其中引物S153扩增出的总条带数与多态性条带数最多,S170扩增出的总条带数与多态性条带数最少,多态性比率分别为81.25%,83.33%。
另外,用特异性引物S153进行PCR扩增建立了能明确区分6个马铃薯新品系及对照的SSR指纹图(图3),为下一步新品种的育成登记和保护利用提供了可靠的分子依据。
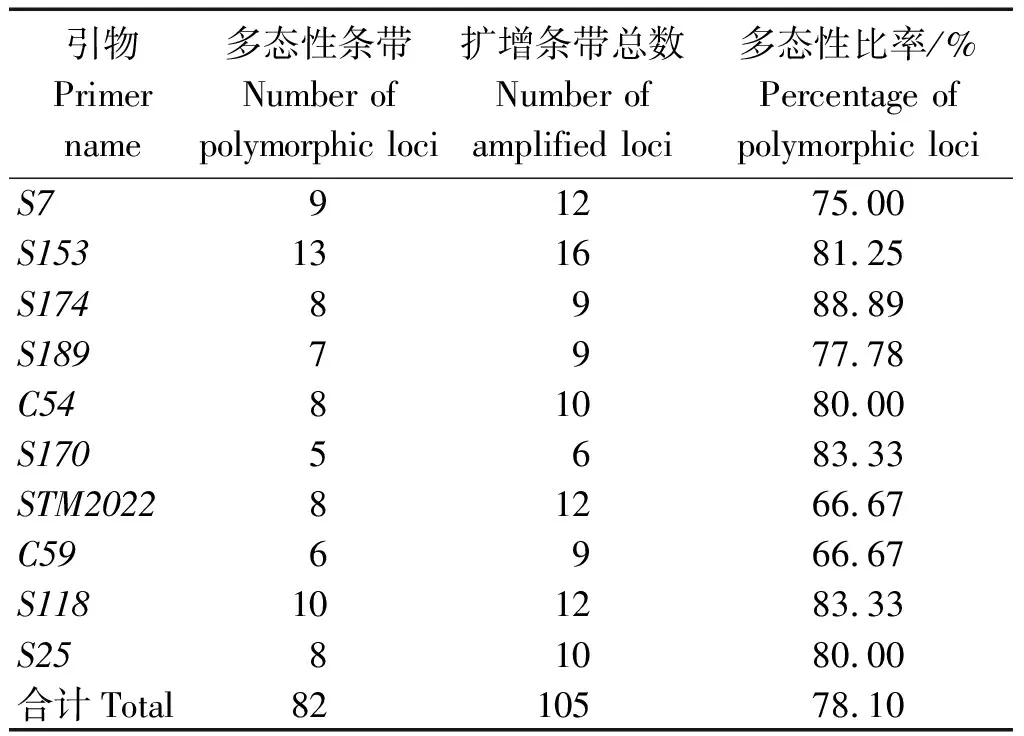
表4 10对适宜引物对各供试马铃薯材料基因组DNA的SSR多态性扩增Tab.4 Amplification results of 10 pairs of appropriate primers for potato strains genome DNA
2.3 马铃薯品系及对照材料的遗传距离和聚类分析
根据遗传距离矩阵结果显示表明(表5),各供试材料的遗传距离(GD)变幅为0.244 4~0.687 5,平均遗传距离为0.480 0,这表明各供试材料间存在一定程度的遗传差异。NNS-P 11与NNS-Y 40之间的遗传距离最小,其GD值为0.244 4,其次为NNS-H 4与NNS-H 6,其GD值为0.313 4,再者为NNS-P 11与NNS-L 9,其GD值为0.333 3,而NNS-H 4与NNS-C 10之间的遗传距离最大,其GD值为0.687 5,NNS-H 6与NNS-L 9的遗传距离也相对较远,其GD值为0.621 6。
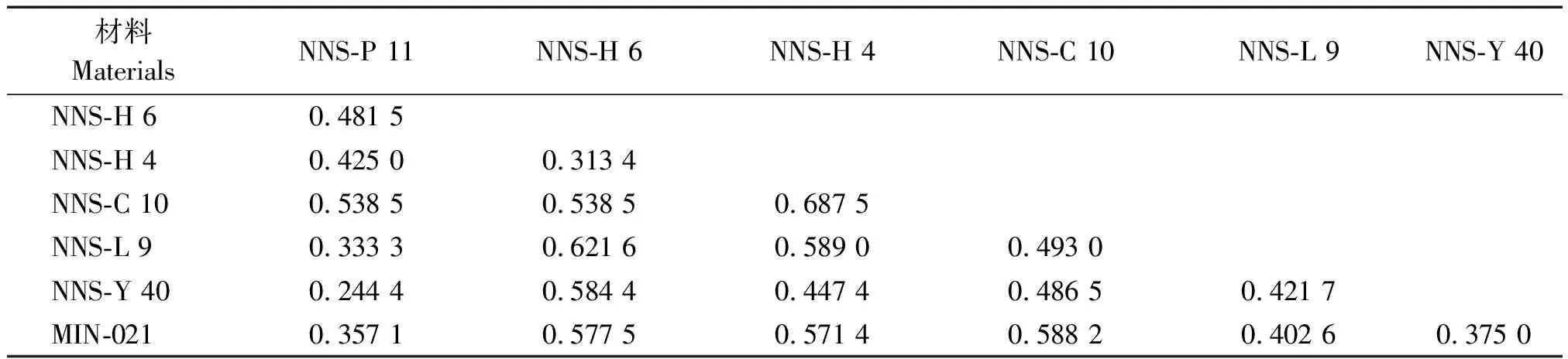
表5 马铃薯各品系的遗传距离矩阵Tab.5 Genetic distance matrix of the potato strains
利用筛选出的10对引物的0/1数值进行聚类,以GD值0.40为基准,将7个材料划分为3类:NNS-P 11、NNS-L 9、NNS-Y 40和对照MIN-021为一类,呈偏父本遗传(因它们的父本材料均为MIN-021);新品系NNS-H 6和NNS-H 4为一类,而新品系NNS-C 10单独为一类(图4)。
3 讨论与结论
在植物花粉母细胞减数分裂中期Ⅰ(PMCM Ⅰ),染色体配对过程较为复杂,常会受到某些基因不同程度的影响,如基因倒位或断裂等变异,都会导致减数分裂出现异常,遗传物质发生交换,最终产生遗传物质不完整且大小不同的花粉粒,致使花粉败育[16]。已有研究表明,在玉米[17]、大豆[18]、水稻[19]等作物上花粉败育或育性低的主要原因是杂种F1的染色体组来自于不同亲本,产生了配对不平衡现象,如较高频率的单价体、多价体和落后染色体等导致的杂种F1不育,故在减数分裂过程中二价体的出现频率越高,同源染色体进行正常联会,其花粉育性就越高。本试验对6个马铃薯新品系及对照材料PMCMⅠ的染色体配对构型和花粉育性观测结果与前人在其他作物上的研究结果具有一致性,二价体出现频率高的新品系,其花粉可育率亦相对较高,而单价体和多价体出现频率高的新品系,其花粉可育率亦较低。如新品系NNS-Y 40的单价体和三价体频率较高(8.23,6.07),其花粉育性最低为39.95%,新品系NNS-P 11的二价体频率最高(14.89),花粉育性较高为81.12%,该研究结果为6个马铃薯新品系的育性鉴定和作为中间材料进一步利用提供了细胞遗传学依据。
SSR标记是继RAPD标记后以PCR反应为基础的分子标记技术之一,因其呈共显性遗传,重复性好,多态性丰富[20],已被广泛应用于植物的遗传多样性分析、目的基因定位及分子标记辅助选择育种等方面[21-23]。聚类分析则是按亲缘关系将品种或品系进行分类,同一类品种或品系间遗传距离小,相似程度高,不同类别的品种或品系间遗传距离大,相似程度低。在杂交育种亲本选配中应选择亲缘关系远、遗传差异大的品种。聚类分析模型可直观、简明的显示出各材料间的亲缘关系,增加杂交育种的成功率。张招娟等[24]利用22对SSR引物对19个马铃薯品种进行遗传多样性分析,其多态性高达96.6%。李芳弟等[25]利用筛选出10对重复性好的SSR引物对227份加工型马铃薯实生群体进行UPGMA聚类分析,将其分为2大类。本试验选用的10对SSR适宜引物对6个马铃薯新品系及对照材料的基因组DNA进行PCR扩增得到82个多态性条带,多态性比率为78.10%,说明各材料间有较大的遗传差异。聚类结果显示,以GD值0.40为基准,将7个马铃薯材料分为3类,NNS-P 11、NNS-L 9、NNS-Y 40与对照MIN-021为一类,表明这4个供试材料间亲缘关系较近,而新品系NNS-H 6和NNS-H 4为一类,新品系NNS-C 10单独为另一类,表明两者间存在着一定程度的差异性。另外,利用筛选出的1对特异性引物S153成功地建立了各供试材料的SSR指纹图,可将7份马铃薯材料很好地区分开来。上述结果充分验证了SSR标记技术用于马铃薯新品系鉴定和多态性分析是可行的,这为6个马铃薯新品系的育成登记及利用提供了可靠的分子依据。

