解淀粉芽孢杆菌ck-05发酵液的抑菌活性
刘小玉 付登强 刘立云 齐兰


摘要:对解淀粉芽孢杆菌ck-05菌株发酵液中生物活性物质的抑菌作用及稳定性进行初步研究。采用菌丝生长速率法测定菌株ck-05发酵液对11种病原菌的抑菌作用。结果表明,ck-05菌株发酵液对供试植物病原菌均具有较强的抑菌作用,其中对香蕉枯萎病的抑制性最强,抑菌率达82.22%。另外,以香蕉枯萎病为指示菌,测定不同条件下ck-05菌株发酵液的抑菌稳定性。结果表明,发酵液热稳定性较好;对酸碱性条件比较敏感,pH值为6~8时具有较强的抑菌作用;紫外线和自然光照射下稳定性较好,对蛋白酶不敏感。
关键词:解淀粉芽孢杆菌ck-05;抑菌活性;稳定性;生长速率法;香蕉枯萎病;发酵液
中图分类号:S182文献标志码:A
文章编号:1002-1302(2021)04-0078-04
作者簡介:刘小玉(1986—),女,江西九江人,硕士,助理研究员,主要从事土壤微生物方面的研究。E-mail:liuxiaoyu06120210@163.com。
近年来,化肥的施用为作物产量的提高做出了突出贡献,但盲目过量施用化肥,造成部分地区植物土传病害日益加重[1]。利用化学药剂防治植物病害会引起诸多副作用,生物防治逐渐成为农业生产中一种新的发展趋势。解淀粉芽孢杆菌具有广泛抗菌能力,属革兰氏阳性芽孢杆菌。有研究表明,解淀粉芽孢杆菌通过产生吲哚-3-乙酸(IAA),分泌葡聚糖酶、几丁质酶以及抗菌活性物质,达到防治植物病害的目的[2-3]。笔者所在课题组在前期工作中获得解淀粉芽孢杆菌菌株ck-05,为进一步将该菌株应用到实际生产中,对该菌株发酵液的抑菌活性及不同条件下的稳定性进行研究,旨在为将该菌株开发为生物农药提供技术支撑。
1材料与方法
1.1试验时间及地点
试验于2019年在海南省文昌市文清大道496号椰子研究所实验室(19°33′12″N,110°47′14″E)开展。
1.2供试菌株及培养基[4]
解淀粉芽孢杆菌ck-05和11种病原菌(槟榔炭疽病、椰子茎腐病、菜心炭疽病、油茶炭疽病、油棕心腐病、椰子灰斑病、板栗疫病、香蕉枯萎病、油茶叶斑病、槟榔心腐病、花生果腐病)均由中国热带农业科学院椰子研究所实验室保藏。
LB(Luria-Bertani)培养基:5g酵母粉,10gNaCl,10g蛋白胨,18~20g琼脂,1L水,pH值为7.0~7.2。
马铃薯葡萄糖琼脂(PDA)培养基:200g土豆,20g葡萄糖,18~20g琼脂,1L水。
发酵培养基:20g葡萄糖,20g蛋白胨,0.8g无水氯化钙,1.3gK2HPO4,0.2gMgSO4,0.8gMnSO4·H2O,pH为值7.0~7.2。
1.3无菌发酵液的制备[5]
将活化的菌株ck-05接入LB液体培养基中,30℃、200r/min摇床培养24h(D600nm>0.8)为种子液。将种子液分别按体积分数5%接入灭好菌的发酵培养基中,30℃发酵培养48h。发酵液10000r/min离心20min,上清液用0.22μm微孔滤膜过滤,得到菌株ck-05无菌发酵液。
1.4ck-05发酵液抑菌谱的测定
将10mLck-05菌株发酵液与90mLPDA培养基混合均匀,制成含菌株ck-05无菌发酵液的培养基平板。分别在平板中央接入11种不同的供试病原菌菌块(5mm),以10mL无菌水为对照(CK)。置于28℃的恒温培养箱中培养,待对照组菌落长满培养皿时,采用十字交叉法测量各处理组菌落直径,并计算无菌滤液的抑菌率[6-7]。
抑菌率=(对照菌落生长直径-处理菌落生长直径)/对照菌落生长直径×100%。
1.5ck-05发酵液的稳定性测定
1.5.1热稳定性
在40、60、80、100℃条件下,分别将ck-05菌株发酵液处理30、60、120min及121℃灭菌20min[8-9],测定ck-05无菌发酵液对香蕉枯萎病的抑菌率,CK为不作温度处理的发酵液。待观察并测量各处理组菌落直径,并计算抑菌率,计算方法同上。
1.5.2酸碱稳定性pH值设为1.0~13.0等13个梯度,用HCl和NaOH调整ck-05菌株无菌发酵液的pH值,静置24h后调回发酵液原始pH值(pH值=7.2),测定ck-05无菌发酵液对香蕉枯萎病的抑菌率[9]。
1.5.3紫外线稳定性
将ck-05菌株发酵液置于距离30W紫外灯30cm处,紫外线照射时间分别设为10、20、30、40、50、60min等不同处理,测定ck-05无菌发酵液对香蕉枯萎病的抑菌率[10]。
1.5.4光照稳定性将ck-05菌株无菌发酵液在自然光下照射4、8、12、16、20、24h,测定ck-05无菌发酵液对香蕉枯萎病的抑菌率[10-11]。
1.5.5酶稳定性酶的终质量浓度为50mg/L,温度设为37℃。用胃蛋白酶、蛋白酶K和胰蛋白酶处理ck-05菌株发酵液,分别处理0.5、1.0、1.5、2.0h,测定ck-05无菌发酵液对香蕉枯萎病的抑菌率,得出蛋白酶耐受性[10,12]。
2结果与分析
2.1ck-05菌株无菌发酵液的抑菌谱测定
由表1可知,ck-05菌株发酵液除对菜心炭疽病病菌的抑菌作用为43.47%外,对其他10种供试病原菌的抑菌率均达到50%以上,发酵液对香蕉枯萎病的抑制作用最强,抑菌率达82.22%,其次为花生果腐病病菌和椰子茎腐病病菌,抑菌率分别为79.44%和78.89%。由此可见,ck-05菌株发酵液抗菌范围较广。
2.2ck-05菌株发酵液的热稳定性
以香蕉枯萎病病菌为指示菌,由图1可知,经过不同温度处理后,ck-05菌株发酵液仍具有较强的抑菌作用,热稳定性较好。40、60、80℃处理不同时间后抑菌作用无明显变化,但温度高于80℃处理后发酵液抑菌活性明显下降,100℃高温处理120min后发酵液抑菌率为31.48%,经121℃高压蒸汽灭菌后发酵液抑菌率仅为19.26%。当温度达到100℃后,ck-05菌株发酵液的抑菌率明显降低,这可能是由于高温能够使其抑菌活性物质结构发生变化,导致活性物质变性失活,最终使发酵液抑菌活性下降。
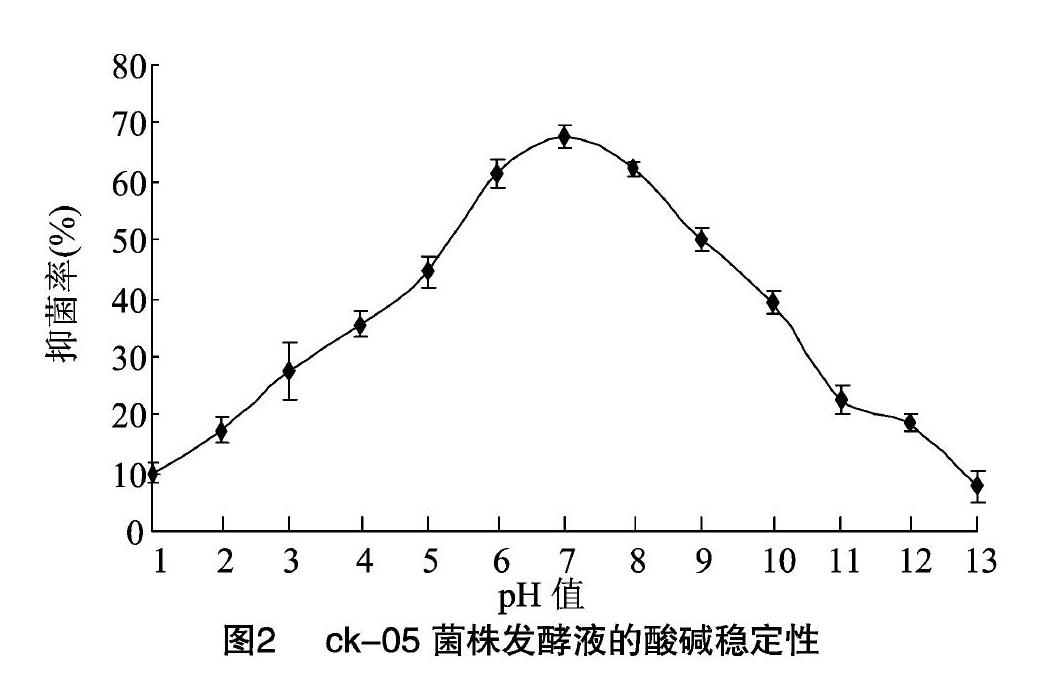
2.3ck-05菌株发酵液的酸碱稳定性
由图2可知,ck-05菌株发酵液的抑菌活性对pH值较敏感。pH值为7时,其发酵液抑菌活性最大,pH值为5时,抑菌率为44.44%;pH值为3时,抑菌率为27.41%,pH值为1时,抑菌率仅为10.00%,与对照组CK相比分别下降34.43%、59.56%、85.25%,pH值为9时,抑菌率为50.00%、pH值为11时,抑菌率为22.59%;pH值为13时,抑菌率仅为7.78%,與对照CK相比分别下降26.23%、66.67%、88.52%。
2.4ck-05菌株发酵液的紫外线照射稳定性
紫外线照射稳定性是抑菌活性物质开发药品、食品防腐剂的重要指标,若紫外稳定性差将会降低药效[13]。由图3可知,与对照CK相比,经紫外线照射30min内,ck-05菌株发酵液抑菌率下降较小;40min后随着紫外线照射时间不断延长,抑菌活性明显降低,但紫外线照射60min时其抑菌率仍在40%以上。由此可知,ck-05菌株发酵液的抑菌活性受紫外线照射的影响较小,该结果与葛平华等的报道[8]一致。
2.5ck-05菌株发酵液的自然光照稳定性
由图4可知,ck-05菌株发酵液在自然光照射0~24h后,其抑菌活性均无明显变化。当持续光照24h后,ck-05菌株发酵液仍具有较强的抑菌活性,抑菌率为64.81%,与CK相比,其抑菌率变化不明显,由此可见,ck-05菌株发酵液的抑菌活性受自然光照的影响较小。
2.6ck-05菌株发酵液的蛋白酶稳定性
由图5可知,不同蛋白酶对ck-05菌株发酵液的抑菌活性影响不明显,说明其发酵液的抑菌作用对3种供试蛋白酶均不敏感。
3讨论与结论
李杨等研究结果表明,解淀粉芽孢杆菌ZJ01对苹果轮纹病病菌有较强的抑制作用[14]。王晓辉等认为解淀粉芽孢杆菌K1发酵液可有效抑制灰霉病病菌的生长[15]。Caldeira等认为,菌株CCMI1051能较强地抑制哈茨木霉及根霉生长,抑菌作用分别为74.7%、99.8%[16]。张宝俊等从解淀粉芽孢杆菌LP-5中获得1种对梨黑斑病病菌具有较强抑制作用的抗菌蛋白[17]。EvaArrebola等研究表明,菌株PPCB004能有效抑制青霉属真菌的菌丝生长,其中对壳青霉菌的抑菌率达73.3%[18]。解淀粉芽孢杆菌的抑菌机制表现在不同的方面,不同的菌株其抑菌机制可能不同,但主要是产生抑菌活性物质。抑菌活性物质主要有甜蛋白、抗生素肽类物质、伊枯草菌素、芬枯草菌素、表面活性素、几丁质酶、芽孢素类和细菌素等[19]。本研究发现,解淀粉芽孢杆菌ck-05发酵液对11种供试植物病原菌的菌丝生长均具有较强的抑制作用,尤其是对香蕉枯萎病的抑菌作用最强,抑制率达82.22%。以香蕉枯萎病病菌为指示菌,ck-05菌株发酵液在温度低于80℃时具有较好的热稳定性;对酸碱性条件比较敏感,pH值为6~8时具有较强的抑菌作用;紫外线和自然光照射下稳定性较好,对蛋白酶不敏感。该菌株发挥抑菌作用的具体活性物质及抑菌机制还有待进一步研究。
参考文献:
[1]李洪连,黄俊丽,袁红霞.有机改良剂在防治植物土传病害中的应用[J].植物病理学报,2002,32(4):289-295.
[2]ChenXH,VaterJ,PielJ,etal.StructuralandfunctionalcharacterizationofthreepolyketidesynthasegeneclustersinBacillusamyloliquefaciensFZB42[J].Journalofbaeteriology,2006,188(11):4024-4036.
[3]李统华,冯中红,杨成德.高寒草甸牧草内生解淀粉芽孢杆菌216MY6发酵工艺优化[J].草地学报,2019,27(2):503-509.
[4]张玲玲.具有抑菌活性土壤拮抗放线菌C3-11菌株的筛选研究[D].贵阳:贵州大学,2010.
[5]贾淑颖,郝再彬,陈圣怡,等.苏云金芽孢杆菌发酵上清液抑菌谱及稳定性[J].食品与生物技术学报,2018,37(6):661-665.
[6]张丰.毛壳菌Chaetomiumspp.分离、筛选及生防机制初步研究[D].泰安:山东农业大学,2013.
[7]赵颖.张家口地区谷子赤霉病病情调查、病原鉴定及药剂筛选[D].张家口:河北北方学院,2018.
[8]葛平华,马桂珍,付泓润,等.海洋解淀粉芽孢杆菌GM-1菌株发酵液抗菌谱及稳定性测定[J].农药,2012,51(10):730-732,741.
[9]王琦,汪晶晶,顾春霞,等.两株抗菌海洋细菌对白色念珠菌的抗菌作用稳定性研究[J].药物生物技术,2016,23(3):226-230.[HJ2.05mm]
[10]葛平华.海洋颉颃菌的筛选及其对核盘菌抑制作用的研究[D].南京:南京农业大学,2013.
[11]吴庆菊,曾会才,弓淑芬.放线菌WZ162菌株发酵液抗香蕉枯萎病菌稳定性研究[J].广西农业科学,2009,40(4):366-369.
[12]王慧萍.拮抗性芽孢杆菌F53抑制茄子黄萎病菌Verticilliumdahliae的研究[D].南京:南京师范大学,2005.
[13]房耀维,王淑军,刘姝,等.一株海洋专性放线菌的分类鉴定及其抑菌活性[J].农药,2014,53(2):136-139.
[14]李杨,陈东玫,杨凤秋,等.解淀粉芽孢杆菌ZJ01对苹果轮纹病菌抑制作用[J].河北果树,2019(4):4-6.
[15]王晓辉,王贵鹏,张庆芳,等.一株抗灰霉病解淀粉芽孢杆菌的筛选鉴定及抑菌蛋白的分离[J].吉林农业科学,2015,40(1):64-67.
[16]CaldeiraAT,FeioSS,ArteiroJMS,etal.BacillusamyloliquefaciensCCMI1051invitroactivityagainstwoodcontaminantfungi[J].AnnalsofMicrobiology,2007,57:29-33.
[17]张宝俊,张家榕,韩巨才,等.内生解淀粉芽孢杆菌LP-5抗菌蛋白的分离纯化及特性[J].植物保护学报,2010,37(2):143-147.
[18]ArrebolaE,SivakumarD,KorstenL.EffectofvolatilecompoundsproducedbyBacillusstrainsonpostharvestdecayincitrus[J].BiologicalControl,2010,53(1):122-128.
[19]RomanoA,VitulloD,diPietroA,etal.AntifungallipopeptidesfromBacillusamyloliquefaciensstrainBO7[J].JournalofNaturalProducts,2011,74(2):145-151.

