初治癌性神经病理性疼痛滴定策略的临床研究
崔健 侯军君 黄丽 吴红 崔月倩 高勇 管林
【摘要】 目的:探討一种针对初治癌性神经病理性疼痛快速、有效的滴定策略。方法:选取2018年1月-2020年1月在某肿瘤专科医院初治的癌性神经病理性疼痛患者120例,按随机数字表法分为干预组和对照组,各60例。对照组应用盐酸吗啡片常规滴定,疼痛有效控制后改为羟考酮缓释片维持。干预组应用羟考酮缓释片联合加巴喷丁治疗。比较两组治疗第24、48、72小时及第1周时疼痛控制、负性情绪、睡眠质量改善情况及不良反应发生请况。结果:干预组治疗第24、48、72小时的疼痛控制率均高于对照组(P<0.05)。干预组治疗第24、48小时的焦虑情绪与睡眠质量改善率均高于对照组(P<0.05)。干预组治疗第24小时的抑郁情绪改善率高于对照组(P<0.05)。干预组恶心呕吐及便秘发生率均低于对照组(P<0.05)。结论:羟考酮为背景用药联合加巴喷丁滴定治疗初治癌性神经病理性疼痛可快速有效地控制患者疼痛、改善负性情绪及睡眠质量,且安全性好,值得临床推广。
【关键词】 羟考酮 加巴喷丁 癌性神经病理性疼痛 滴定
Clinical Study on Titration Strategy of Primary Malignant Neuropathic Pain/CUI Jian, HOU Junjun, HUANG Li, WU Hong, CUI Yueqian, GAO Yong, GUAN Lin. //Medical Innovation of China, 2021, 18(01): 073-077
[Abstract] Objective: To explore a rapid and effective titration strategy for primary malignant neuropathic pain. Method: A total of 120 patients with malignant neuropathic pain initially treated in a specialized cancer hospital from January 2018 to January 2020 were selected. They were divided into intervention group and control group according to the random number table method, with 60 patients in each group. The control group was routinely titrated with Morphine Hydrochloride Tablets, and after the pain was effectively controlled, Oxycodone Sustained Release Tablets were used for maintenance. The intervention group was treated with Oxycodone Sustained Release Tablets combined with Gabapentin. Pain control, improvement of negative mood, sleep quality at 24, 48, 72 h and
1 week of treatment and adverse reactions were compared between the two groups. Result: The pain control rate at 24, 48 and 72 h of treatment in the intervention group were higher than those in the control group (P<0.05). The anxiety and sleep quality improvement rates at 24 and 48 h of treatment in the intervention group were higher than those in the control group (P<0.05). The improvement rate of depression at 24 h of treatment in the intervention group was higher than that in the control group (P<0.05). The incidence of nausea, vomiting and constipation in the intervention group were lower than those in the control group (P<0.05). Conclusion: Oxycodone as background drug combined with Gabapentine titration in the treatment of primary malignant neuropathic pain can rapidly and effectively control patients pain, improve negative mood and sleep quality, and is safe. which is worthy of clinical promotion.
[Key words] Oxycodone Gabapentin Malignant neuropathic pain Titration
First-authors address: Taian Tumor Prevention and Treatment Hospital, Taian 271000, China
doi:10.3969/j.issn.1674-4985.2021.01.019
神经病理性疼痛(neuropathic pain,NP)是由于躯体感觉系统的损伤或疾病引起的疼痛[1]。其中癌性神经病理性疼痛(malignant neuropathic pain,MNP)在肿瘤诊疗中较为常见,39%的癌痛患者伴有神经病理性疼痛[2]。其病因较为复杂,肿瘤侵犯神经、某些具有神经毒性的化疗药物、手术及放疗损伤均可导致[3]。中国卫生健康委员会癌痛诊疗规范及美国综合癌症网络(NCCN)指南均推荐伴有神经病理性疼痛的癌痛患者可辅助使用抗抑郁药、抗惊厥药进行治疗[4-5]。加巴喷丁作为新一代抗惊厥药,可通过抑制感觉神经的过度电冲动发挥镇痛作用,对神经性疼痛有较好的治疗效果,且能明显降低神经病理性癌痛者阿片耐受指数[6-9]。相关研究显示阿片类药物联合加巴喷丁治疗中重度癌痛患者疗效确切,在老年癌性神经病理性疼痛治疗中也有着良好的效果及安全性[10-12]。但针对初治癌性神经病理性疼痛患者的研究较少,本研究采用前瞻性随机对照方法,观察羟考酮为背景用药联合加巴喷丁初始滴定对癌性神经病理性疼痛的疗效及安全性,取得良好效果,现报道如下。
1 资料与方法
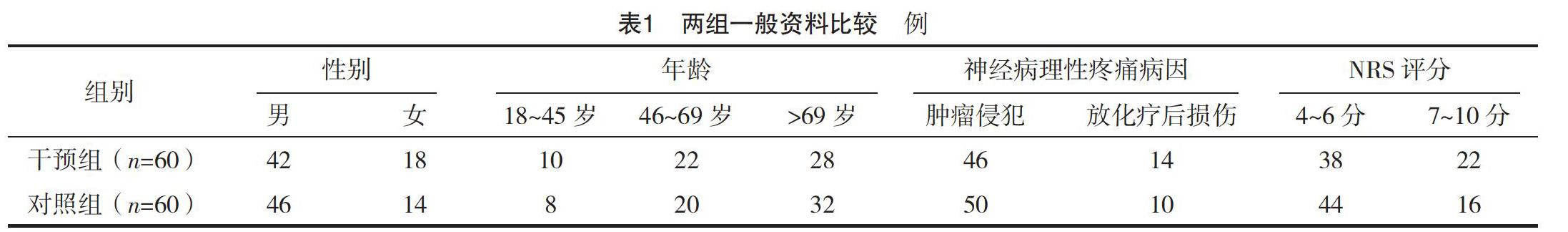
1.1 一般资料 选取2018年1月-2019年11月在某肿瘤专科医院治疗的癌性神经病理性疼痛患者120例。纳入标准:年龄≥18岁;既往无阿片类药物治疗史;利兹神经病理性症状和体征疼痛评分(LANSS)≥12分,疼痛数字评分法(NRS)≥4分,焦虑自评量表(self-rating anxiety scale,SAS)≥53分,抑郁自评量表(self-rating depression scale,SDS)≥50分,匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)>7分;预计生存期≥1个月。排除标准:不能口服给药者;认知障碍者;对药物成分过敏者。按随机数字表法将患者分为干预组和对照组,各60例。所有患者及家属均知情同意并签署知情同意书,本研究已经医院伦理委员会批准。
1.2 方法 对照组采用盐酸吗啡片(生产厂家:杭州民生药业集团有限公司,批准文号:国药准字H63020014,规格:5 mg)治疗。根据阿片未耐受患者滴定原则,NRS 4~6分者,口服盐酸吗啡片10 mg/次,1次/4 h;NRS 7~10分者,口服盐酸吗啡片15 mg/次,1次/4 h。疼痛有效控制后按照2︰3的换算关系将盐酸吗啡片换算为等量的羟考酮缓释片(生产厂家:BARD PHARMACEUTICALS LIMITED,注册证号:国药准字J20140124,规格:5 mg)每12小时口服维持治疗。干预组羟考酮缓释片联合加巴喷丁(生产厂家:江苏恒瑞医药股份有限公司,批注文号:国药准字H20030662,规格:0.1 g)治疗。NRS 4~6分者口服羟考酮缓释片10 mg/次,1次/12 h为背景用药;NRS 7~10分者应用羟考酮缓释片20 mg/次,1次/12 h为背景用药;在此基础上同步加用加巴喷丁胶囊,第一天服用加巴喷丁0.3 g/次,1次/d;第二天服用0.3 g/次,2次/d;第三天服用0.3 g/次,3次/d。根据缓解疼痛的需要按照每次加用0.3 g,最高可至1.8 g/d,分3次服用。当出现不良反应不能耐受时酌情减量。期间两组均接受盐酸吗啡片治疗爆发痛。当患者NRS评分≤3分,爆发痛次数≤3次/24 h时,停止调整羟考酮缓释片及加巴喷丁的固定剂量。
1.3 观察指标与判定方法 比较两组治疗第24、48、72小时及第1周时疼痛控制、负性情绪及睡眠情况改善情况。疼痛情况采用NRS评分判定:数字0~10分别代表0~10分,0代表无痛,10代表最痛,1~3分轻度疼痛,4~6分中度疼痛,7~10分重度疼痛。焦虑情况采用SAS评分判定:标准总分≥50表示存在焦虑情绪。抑郁情况采用SDS评分判定:标准总分≥53分,表示存在抑郁情绪。睡眠质量采用PSQI评分判定:总分0~21分,≤7分为睡眠质量基本满意,>7分为睡眠质量差。当患者各评分低于分界点视为改善,即疼痛控制为NRS评分≤3分;焦虑改善为SAS<50分;抑郁改善为SDS<53分;睡眠情况改善为PSQI≤7分。比较两组不良反应发生情况。包括恶心呕吐、便秘、头晕、嗜睡、尿潴留、呼吸抑制及皮肤瘙痒。
1.4 统计学处理 采用SPSS 17.0软件对所得数据进行统计分析,计量资料用(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 兩组一般资料比较 两组性别、年龄、神经病理性疼痛病因等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
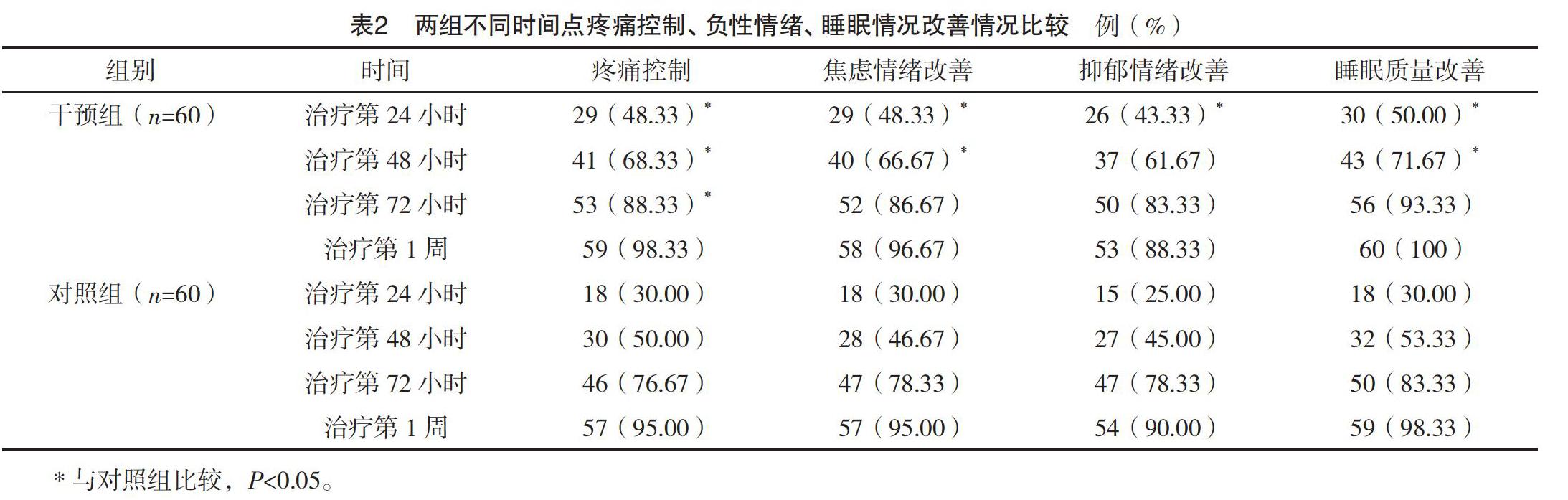
2.2 两组治疗后不同时间点疼痛控制、负性情绪及睡眠质量改善情况。干预组治疗第24、48、72小时的疼痛控制率均高于对照组(P<0.05)。干预组治疗第24、48小时的焦虑情绪与睡眠质量改善率均高于对照组(P<0.05)。干预组治疗第24小时的抑郁情绪改善率高于对照组(P<0.05)。治疗1周时,两组疼痛控制、负性情绪及睡眠质量改善情况比较,差异均无统计学意义(P>0.05)。见表2。
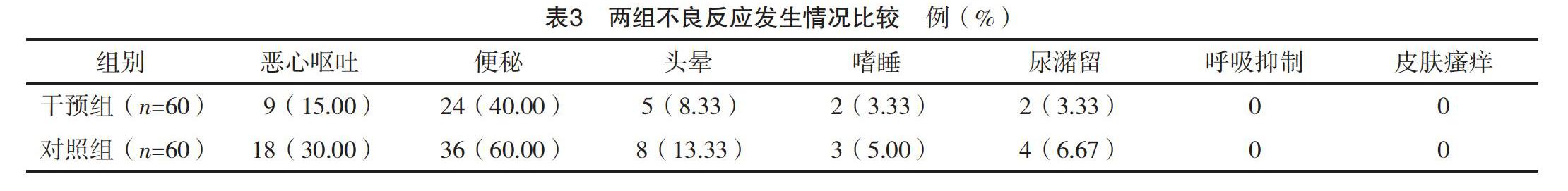
2.3 两组不良反应发生情况比较 干预组恶心呕吐与便秘发生率均低于对照组,差异均有统计学意义(P<0.05)。两组头晕、嗜睡及尿潴留发生率比较,差异均无统计学意义(P>0.05)。两组均未发生呼吸抑制与皮肤瘙痒。见表3。
3 讨论
癌症相关的神经病理性疼痛非常普遍,肿瘤细胞的侵袭、化疗药物的损伤都可导致神经病理性疼痛的发生[13]。对于MNP尚缺乏可靠的流行病学研究与有效的诊断评估工具,临床医师和癌痛患者对其的认知水平还需进一步提高[14]。其病因及形成机制复杂,往往合并多种因素,癌痛性质多样化,应用单一药物通常效果不显著,中枢神经和外周神经敏化导致的疼痛信号放大,是疼痛控制不佳的最主要原因[15-16]。多项研究证实阿片类药物对神经病理性疼痛有效,其中以羟考酮最为明显,其不仅作用于μ受体,同时也作用于κ受体[17]。目前推荐抗惊厥、抗抑郁类药物为治疗癌性神经病理性疼痛的首选[18]。加巴喷丁即1-氨甲基-环己烷乙酸,是一种新型抗癫痫药,2002年美国食品药品管理局正式批准通过其成为治疗神经病理性疼痛的一线用药[19]。它能作用于电压依赖性钙通道,可选择性与钙离子通道α2δ亚单位相结合,降低钙离子的内流、抑制谷氨酸盐、去甲肾上腺素和P物质等神经递质的释放,产生镇痛、抗惊厥和抗焦虑的作用[3]。国内外研究资料表明,其临床应用安全,患者耐受性好,不良反应发生率低,药物之间相互作用轻微,是治疗NP的理想药物。但由于NP的机制比较复杂,有时可能需要针对不同的发病机制制定几种药物联合治疗方案[20]。
基于上述观点,本研究针对MNP应用羟考酮联合加巴喷丁的治疗方式进行滴定治疗,并与常规吗啡滴定法进行比较。与大部分研究方法不同的是本研究着重观察不同时间点两组疼痛控制,负性情绪及睡眠质量改善情况。本研究结果显示,干预组治疗第24、48、72小时的疼痛控制率均高于对照组(P<0.05);干预组治疗第24、48小时的焦虑情绪与睡眠质量改善率均高于对照组(P<0.05);干预组治疗第24小时的抑郁情绪改善率高于对照组(P<0.05);在治疗第1周两组疼痛控制、负性情绪及睡眠质量改善情况趋于一致;干预组恶心呕吐与便秘发生率均低于对照组(P<0.05),本研究中两种治疗方式在治疗第1周时分别有98.33%、95.00%的患者达到疼痛控制,但对比发现,羟考酮联合加巴喷丁在快速镇痛、快速改善负性情绪、睡眠质量方面存在明显优势,减少相关不良反应发生率,提高用药安全。
综上所述,羟考酮为背景用药联合加巴喷丁滴定治疗初治癌性神经病理性疼痛可快速有效地控制患者疼痛、改善负性情绪及睡眠质量,且安全性好,值得临床推广。下一步笔者将针对不同原因(肿瘤侵犯、放化疗损伤等)导致的MNP进行研究观察,探讨个体化的镇痛方案。
参考文献
[1]邢国刚,韩济生.神经病理性疼痛的新定义[J].中国疼痛医学杂志,2011,17(10):595-596.
[2] Piano V,Verhagen S,Schalkwijk A,et al.Treatment for neuropathic pain in patients with cancer:comparative analysis of recommendations in national clinical practice guidelines from European countries[J].Pain Pract,2014,14(1):1-7.
[3] Lema M J,Foley K M,Hausheer F H.Types and epidemiology of cancer-related neuropathic pain:the intersection of cancer pain and neuropathic pain[J].Oncologist,2010,15(Suppl 2):3-8.
[4]中華人民共和国国家卫生健康委员会.癌症疼痛诊疗规范(2018年版)[J].临床肿瘤学杂志,2018,23(10):937-944.
[5] Reis-Pina P,Lawlor P G,Barbosa A.Cancer-Related Pain Management and the Optimal Use of Opioids[J].Acta Med Port,2015,28(3):376-381.
[6] Field M J,Li Z,Schwarz J B.Ca2+ channel alpha2-delta ligands for the treatment of neuropathic pain[J].J Med Chem,2007,50(11):2569-2575.
[7] Nickel F T,Seifert F,Lanz S,et al.Mechanisms of neuropathic pain[J].Eur Neuropsychopharmacol,2012,22(2):81-91.
[8]范华何,杰文.加巴喷丁的药理作用及临床应用进展[J].海峡药学,2017,24(6):116-119.
[9]薛钧,刘晶煜,李文娟,等.加巴喷丁对癌性神经病理性疼痛病人阿片耐受指数的影响[J].中国疼痛医学杂志,2019,25(2):120-124.
[10]左蕾,杨晓秋.阿片药物联用加巴喷丁治疗中重度癌痛的系统评价[J].中国疼痛医学杂志,2019,25(7):504-512.
[11]龚军,胡美琴,李荣峰,等.羟考酮联合加巴喷丁治疗中重度癌性疼痛的Meta-分析[J].药物评价研究,2018,41(7):1323-1329.
[12]王婷,方俊,田玲,等.盐酸羟考酮缓释片联合加巴喷丁治疗老年癌性神经病理性疼痛的回顾性研究[J].重庆医科大学学报,2019,44(7):927-932.
[13]付强,陈元.癌性神经病理性疼痛概述[J].药品评价,2012,9(3):13-19.
[14]卢帆,宋莉,刘慧.癌性神经病理性疼痛的评估和诊疗现状[J].中国疼痛医学杂志,2015,21(9):692-696.
[15] Fallon M T,Wilcock A,Kelly C A,et al.Oral Ketamine vs Placebo in Patients With Cancer-Related Neuropathic Pain:A Randomized Clinical Trial[J].JAMA Oncol,2018,4(6):870-872.
[16] Hald A,Nedergaard S,Hansen R R,et al.Differential activation of spinal cord glial cells in murine models of neuropathic and cancer pain[J].Eur J Pain,2009,13(2):138-145.
[17]李小梅,董艳娟,李慧莉,等.癌性神经病理性疼痛的阿片药物治疗[J].中国疼痛医学杂志,2011,17(8):454-458.
[18]汪品嘉,李鑫,姚文秀.癌性神经病理性疼痛的辅助镇痛药物研究进展[J].中国疼痛医学杂志,2019,1(36):77-80.
[19] Bennett M I,Simpson K H.Gabapentin in the treatment of neuro-pathic pain[J].Palliat Med,2004,18(1):5-11.
[20]冯洁,李丽,耿立成.加巴喷丁治疗神经病理性疼痛的研究进展[J].医学综述,2011,17(14):2167-2169.
(收稿日期:2020-05-08) (本文编辑:田婧)

