圆支清疫苗中猪圆环病毒2型对猪肺炎支原体的免疫增强作用
车巧林, 董彦鹏,刘茂军,耿晓眉,缪芬芳
(1. 江苏南农高科技股份有限公司,江苏 江阴 214400;2. 江苏省农科院兽医研究所,江苏 南京 210014)
猪肺炎支原体(Mycoplasmahyopneumoniae,Mhyo)是引起猪支原体肺炎的主要病原,在猪呼吸道疾病综合征(PRDC)发生过程中起着重要作用。20世纪90年代后期,北美和欧洲出现了猪圆环病毒2型(porcine circovirus type 2,PCV2)[1-2]。PCV2感染后除引起仔猪多系统衰竭综合征(PMWS)外,还引起猪皮炎和肾病综合征(PDNS)、猪呼吸道疾病综合征(PRDC)、母猪繁殖障碍、新生仔猪先天性震颤(CT)、增生性坏死性肺炎(PNP)和肠炎等[3-4]。单独Mhyo或PCV2感染并不足以引起疾病的临床表现,但是并发或继发其他细菌或病毒感染时,可使死亡率大大提高。
Mhyo与PCV2之间存在协同感染,Mhyo可以增强PCV2相关性肺损伤的严重性,增加PCV2在组织中的数量和分布[5]。对4周龄的断奶仔猪进行Mhyo攻毒,6周龄时再用PCV2攻毒,结果猪表现出严重的呼吸道疾病,血清中PCV2 的拷贝数显著上升, 病毒血症持续期延长,肺组织和淋巴组织的病理损伤比单独Mhyo或PCV2感染时严重[6]。
迄今为止,对病原之间共感染的研究比较多,但是对联苗各抗原之间的相互作用研究甚少。本研究用3组相同Mhyo抗原含量、不同PCV2抗原含量的圆支二联疫苗和1组相同Mhyo抗原含量的单苗分别免疫BALB/c小鼠、新西兰大耳白兔和健康仔猪,测定血清中PCV2抗体和Mhyo抗体,并在仔猪二免后进行Mhyo强毒攻击,观察肺部病变程度,阐明PCV2与Mhyo抗原之间的免疫协同关系。
1 材料与方法
1.1 菌株、毒株和细胞
Mhyo HN0613株(代次F6)和PCV2 SH株,PK15-B1克隆细胞,均由江苏南农高科技股份有限公司鉴定并保存。
1.2 主要试剂
MEM干粉培养基购自Gibco Invitrogen公司;Friis培养基由江苏南农高科技股份有限公司自制;2-溴乙胺氢溴酸盐(BEA),购自 Sigma Aldrich 公司;无水硫代硫酸钠购自Alfa Aesar 公司;β-丙内酯购自Serva公司;猪支原体肺炎ELISA抗体检测试剂盒购自 IDEXX 公司;PCV2抗体检测试剂盒购自BioChck公司;Ezup柱式病毒DNA抽提试剂盒购自生工公司;Mhyo微量间接血凝(IHA)检测试剂盒由江苏南农高科技股份有限公司自制。
1.3 试验动物
16~18 g健康雌性BALB/c小鼠,PCV2 ELISA抗体阴性(效价<1∶50);1~1.5 kg新西兰大耳白兔,Mhyo IHA抗体阴性(效价<1∶5);21日龄健康仔猪,PCV2、猪繁殖与呼吸综合征病毒(PRRSV)抗原阴性,PCV2、Mhyo ELISA母源抗体阴性。
1.4 Mhyo菌液的制备及灭活
Mhyo HN0613株F6代冻干菌种用2 mL Friis培养基溶解,以10%比例接种于含20 mL Friis培养基的100 mL盐水瓶中,37 ℃恒温培养箱中静置培养至pH=6.7~6.8时收获。收获的菌液以5%比例接种于含400 mL Friis培养基的三角瓶中,120 r/min、37 ℃恒温振荡培养,待pH值下降到6.7~6.8时收获。收获菌液测定颜色变化单位(CCU)。
向Mhyo菌液中加入过滤除菌的0.1 mol/L的BEI溶液,使终浓度为4 mmol/L,37℃恒温振荡24 h后加入终浓度为10 mmol/L的硫代硫酸钠溶液,37 ℃恒温振荡1 h终止灭活。取1 mL灭活菌液接种50 mL Friis液体培养基进行灭活检验,37 ℃培养5 d后再取0.5 mL培养物移植到4.5 mL Friis液体培养基,37 ℃继续培养观察10 d。
1.5 PCV2病毒液的制备及灭活
从细胞库中取出冻存的PK15-B1克隆细胞复苏,加入含10%新生牛血清的MEM培养液,置37 ℃、含5% CO2培养箱中培养24~48 h。当其长成良好单层时,弃去培养液,加入EDTA-胰酶细胞分散液消化,按1∶2~1∶3比例传代增殖培养。将扩大培养的细胞接种到细胞转瓶中,转速为10~12 r/h,置36~37 ℃培养24~48 h。当转瓶细胞形成良好单层时,按1∶2~1∶3比例传代继续扩大培养1次,待转瓶细胞形成良好单层时,按5%接种PCV2 SH毒种,置37 ℃下吸附30 min,加入细胞维持液,置37 ℃下旋转培养,转速为10~12 r/h,每日观察1~2次,细胞应生长良好,37 ℃下培养4 d,置-20 ℃下反复冻融2~3次,收获细胞培养物并留样作病毒含量测定。
向PCV2病毒液中加入终浓度0.1%的β-丙内酯,4 ℃振荡灭活30 h,37 ℃恒温振荡水解2 h。取少量灭活病毒液进行灭活检验,即少量病毒液接种已长成单层的PK15-B1克隆细胞,置37 ℃下吸附1 h,弃去病毒液,加入新的细胞维持液,置37 ℃下继续培养2 d,应无细胞病变(CPE),连续盲传3代后,用免疫荧光法(IFA)检测。
1.6 PCV2病毒液的浓缩及Western blot检测
PCV2灭活抗原经300 kDa的中空纤维膜超滤柱分别进行2倍和3倍浓缩。浓缩后的抗原进行SDS-PAGE分析。电泳结束后将未染色的凝胶、裁减好的NC膜夹于滤纸之间,按照负极-滤纸-凝胶-NC膜-滤纸-正极的顺序放入装有电转液的电泳槽,200 mA恒流转印80 min。转印结束后,NC膜放入丽春红染色液中染色1~2 min,PBS洗去丽春红染液。NC膜清洗干净后,放入5%脱脂乳PBS中4 ℃过夜封闭,TBST洗涤2次。加入1∶1 000稀释的3E5单抗(PCV2单抗,南京农业大学动物医学院制备),室温孵育2 h,TBST洗涤5次,再加入1∶2 000稀释的HRP-羊抗鼠IgG,室温孵育1 h,TBST洗涤5次,化学发光试剂盒显色10 s~1 min,化学发光仪显影0.5~20 s,拍照。
1.7 灭活疫苗的制备
未经浓缩的PCV2抗原、浓缩2倍和3倍的PCV2抗原分别与Mhyo抗原以5∶4比例混匀,低速搅拌10 min,再与Gel佐剂(Seppic公司)以9∶1的比例混合,低速搅拌20 min,NaOH溶液调节pH值至6.2~6.3,分装,每瓶20 mL。
生理盐水与Mhyo抗原以5∶4比例混匀,再与Gel佐剂以9∶1比例混合,低速搅拌20 min,配制1组只含Mhyo抗原的疫苗。疫苗各组分见表1,配制的疫苗进行无菌检验。

表1 灭活疫苗组别及各组分用量
1.8 替代动物免疫及血清抗体水平检测
1.8.1 BALB/c小鼠免疫及血清抗体ELISA检测
选取16~18 g PCV2 ELISA抗体阴性(效价低于1∶50)的健康雌性BALB/c小鼠25只,随机分成5组,每组5只。第1~4组分别皮下接种猪支原体肺炎单苗,圆支二联疫苗1、2和3,每只0.2 mL,14 d后按相同途径和剂量进行二免;第5组不接种,作为空白对照。各组小鼠均隔离饲养、观察。二免后21 d采血,分离血清,用自制的小鼠血清间接ELISA试剂盒测定小鼠血清中的PCV2 ELISA抗体效价。
1.8.2 家兔免疫及血清抗体IHA测定
1~1.5 kg Mhyo IHA抗体阴性(效价低于1∶5)的健康新西兰大耳白兔25只,随机分成5组,每组5只。第1~4组每只后腿肌肉注射猪支原体肺炎单苗,圆支二联疫苗1、2和3,每只0.5 mL,第5组不免疫,作空白对照。免疫后28 d采血,分离血清,测定兔血清中Mhyo IHA抗体效价。
1.9 本体动物免疫、攻毒、血清抗体及PCV2抗原检测
1.9.1 仔猪免疫及攻毒
25头21日龄健康易感仔猪随机分成5组,每组5头。第1~4组分别颈部肌肉注射猪支原体肺炎单苗,圆支二联疫苗1、2和3,每头猪注射1头份(2 mL),第5组每头注射不含抗原成分、只由培养液和佐剂配制的安慰剂2 mL,作为攻毒对照组。疫苗接种组及攻毒对照组首免后14 d加强免疫1次,免疫剂量为2 mL/头。二免后28 d,所有试验组猪气管注射Mhyo济南系强毒10 mL(含100个最小发病剂量),连续观察28 d,剖杀取肺。
1.9.2 仔猪血清抗体检测
所有仔猪在首免当天接种前及首免后14 d(二免接种前)、28 d、42 d(攻毒前)、56 d、70 d(剖杀前)分别采血,分离血清,Mhyo血清抗体采用 IDEXX间接ELISA抗体检测试剂盒和自制的微量间接血凝检测试剂盒进行检测,PCV2血清抗体采用BioChek 间接ELISA抗体检测试剂盒进行检测。
1.9.3 仔猪攻毒后肺部病变情况
Mhyo济南系强毒攻击后28 d剖杀所有试验猪,按照28分法对试验猪的肺炎病变进行评分[7]。分别对免疫组猪和对照组猪进行打分,按照以下公式计算肺部病变减少率:
1.9.4 仔猪血清及肺组织PCV2 抗原检测
所有仔猪首免后14、28、42、56、70 d采血分离的血清,70 d剖杀时采集的肺组织按照Ezup 柱式病毒 DNA 抽提试剂盒操作步骤提取 DNA,用PCV2特异性引物进行PCR扩增。引物序列为:PCV2-F:5′-TTC GGT ACC AGC TAT GAC GTA TCC AAG-3′,PCV2-R:5′-GCC AAG CTT TCA CTT CGT AAT GGT TTT-3′。扩增条件:94 ℃预变性2 min;94 ℃变性 45 s,58 ℃退火45 s,72 ℃延伸45 s,35个循环;72 ℃延伸10 min。
2 结果与分析
2.1 Mhyo菌液的制备及灭活
收获的Mhyo菌液CCU测定结果为109CCU/mL,经终浓度4 mmol/L BEI灭活24 h后进行灭活检验,2次培养物均不变色,说明灭活彻底。
2.2 PCV2病毒液的制备及灭活
收获的PCV2病毒液含量为106.5TCID50/mL,少量灭活病毒液接种PK15-B1克隆细胞连续盲传3代,IFA法检测无绿色荧光着染的PCV2阳性细胞,说明病毒液灭活彻底。
2.3 PCV2病毒液的Western blot检测
未经浓缩的PCV2灭活抗原,经中空纤维膜浓缩2倍、3倍的灭活抗原同时进行Western blot检测,在27 kDa左右有条带,说明有明显的免疫反应性,并且条带随着浓缩倍数的增加而变粗,见图1。
2.4 小鼠血清PCV2抗体ELISA检测
5个试验组的小鼠全部采血并分离血清,用自制的小鼠血清间接ELISA试剂盒测定血清中PCV2抗体效价。同稀释度待检血清OD450 nm值/阴性血清OD450 nm值(P/N值)不低于2.1时判为阳性,以P/N值不低于2.1的血清最大稀释度作为该血清的ELISA抗体效价。小鼠血清中PCV2 ELISA抗体效价不高于1∶50,判为阴性;高于1∶50,判为阳性。小鼠血清PCV2 ELISA抗体效价结果见表2,由表2可以看出,猪支原体肺炎单苗组与空白对照组PCV2抗体均呈阴性,圆支二联疫苗1、2和3免疫小鼠产生的PCV2抗体效价随着圆环病毒含量的增加而增加。

M.预染Marker;1.浓缩3倍的PCV2抗原;2.浓缩2倍的PCV2抗原;3.不浓缩的PCV2抗原

表2 小鼠血清PCV2 ELISA抗体检测结果
2.5 兔血清Mhyo IHA抗体效价测定
5个试验组的兔子全部采血并分离血清,用IHA测定血清中Mhyo抗体效价。结果见表3,由表3可以看出,空白对照组Mhyo抗体为阴性,猪支原体肺炎单苗组平均效价为1∶88,相同Mhyo含量、不同PCV2含量的圆支二联疫苗1、2和3免疫兔子产生的Mhyo抗体效价随着PCV2含量的增加而提高,这说明PCV2全病毒可能对Mhyo的免疫有增强作用。
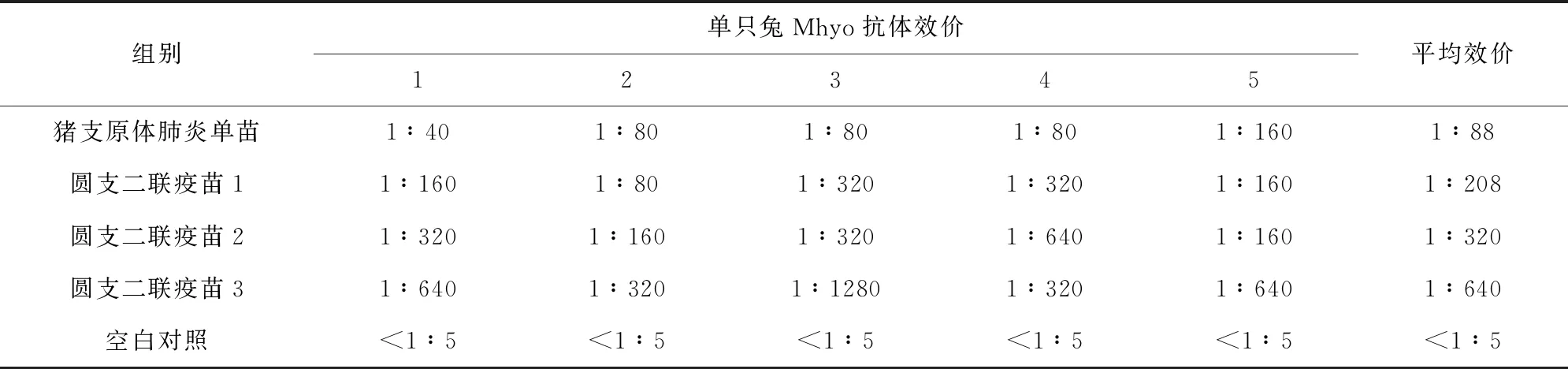
表3 兔血清Mhyo IHA抗体测定结果
2.6 仔猪血清抗体检测
仔猪血清PCV2抗体检测结果见表4,从表4可以看出圆支二联疫苗3在首免后14 d PCV2抗体转为阳性,在首免后56 d达到高峰,首免后70 d开始下降;圆支二联疫苗1和圆支二联疫苗2在首免后28 d(即二免后14 d)PCV2抗体转为阳性,在首免后42 d 至70 d PCV2抗体处于一个稳定期;猪支原体肺炎单苗组和攻毒对照组在整个检测期间PCV2抗体均呈阴性。综合各组PCV2抗体水平结果,说明疫苗中PCV2抗原含量越高,猪PCV2血清抗体越早转化成阳性,且达到的抗体水平也越高。
仔猪血清Mhyo ELISA 抗体检测结果见表5,从表中可以看出所有免疫组在首免后28 d(即二免后14 d) Mhyo抗体转为阳性,且抗体在持续上升,首免42 d采血结束后进行Mhyo强毒攻击,攻毒后所有组别Mhyo抗体水平在上升,攻毒对照组在攻毒后28 d抗体转为阳性。免疫组别中,随着疫苗中PCV2抗原含量的增加,免疫后Myho抗体水平也在提高,说明PCV2抗原对Mhyo抗体的产生有促进作用。

表4 仔猪血清PCV2 ELISA抗体检测结果(S/P值)

表5 仔猪血清Mhyo ELISA抗体检测结果(S/P值)
仔猪血清Mhyo IHA检测结果见表6,从表中可以看出IHA检测结果与ELISA检测结果基本一致,只有首免后28 d Mhyo抗体有所差别,猪支原体肺炎单苗组和圆支二联疫苗1组首免后28 d(即二免后14 d)Mhyo抗体效价>1∶5,可疑;圆支二联疫苗2组和圆支二联疫苗3组 Mhyo抗体转为阳性,大于1∶10。Mhyo IHA检测结果同样说明PCV2抗原对Myho抗体的产生有促进作用。

表6 仔猪血清Mhyo IHA抗体效价检测结果
2.7 仔猪肺部病变情况
Mhyo济南系强毒攻击后,采用28分法评分,结果如下:攻毒对照组肺部病变平均得分最高,为12.8,猪支原体肺炎单苗组、圆支二联疫苗1、2和3组肺部病变平均得分依次降低,肺部病变减少率依次升高,且圆支二联疫苗2和圆支二联疫苗3肺部病变减少率均在80%以上(结果见表7)。这说明圆支二联疫苗中PCV2抗原对Mhyo免疫有增强作用,且随着PCV2全病毒抗原含量的增加,免疫保护效果随之增强。部分猪的病变情况见图2。

表7 各组肺部病变评分及肺部病变减少率

A.猪支原体肺炎单苗组; B.圆支二联疫苗1组;C.圆支二联疫苗2组;D.圆支二联疫苗3组;E、F.攻毒对照组,其中:箭头指示有病变的地方
2.8 仔猪血清及肺组织PCV2抗原检测
所有仔猪首免后14、28、42、56和70 d采血分离的血清,70 d剖杀时采集的肺组织用PCV2特异性引物进行PCR扩增,所有血清及肺组织样品在751 bp处均没有出现特异性条带(部分血清及肺组织PCR结果见图3),这说明在仔猪的整个试验过程中未受到野毒PCV2的感染。

M.Marker;+.阳性对照;-.阴性对照;1~5.猪支原体肺炎单苗组;6~10.圆支二联疫苗1组;11~15.圆支二联疫苗2组;16~20.圆支二联疫苗3组;21~25.攻毒对照组
3 讨论
在前期研究中,用Mhyo抗原含量相同、PCV2抗原含量不同的2组圆支二联疫苗免疫新西兰大耳白兔,结果发现圆环病毒经过中空纤维浓缩后含量高的圆支二联疫苗组Mhyo抗体效价更高,且同样经过中空纤维浓缩,不含圆环病毒抗原的MEM培养基与不含Mhyo抗原的Friis培养基配制的疫苗,免疫后未检测到Mhyo抗体;Mhyo抗原含量高、圆环病毒含量低和Mhyo抗原含量低、圆环病毒含量高的2组圆支二联疫苗免疫新西兰大耳白兔,结果后者免疫后产生的Mhyo抗体效价反而比前者免疫后产生的抗体效价高。由这2个试验结果猜测PCV2全病毒可能对Mhyo免疫具有促进作用,因此设计本研究进行验证。
本研究结果进一步证实,PCV2全病毒对Mhyo的免疫具有促进作用,这可能与PCV2基因组内含有的CpG基序(CpG-寡聚脱氧核苷酸序列,简称CpG-ONG)有关。PCV2基因组中至少含有18个CpG基序,并且在猪外周血单核细胞培养物中能诱导IFN-α 的产生[8]。在体外条件下,利用与PCV2不相关的CpG-ONG序列也能诱导白细胞介素2(IL-2)、IL-10或γ干扰素(IFN-γ)的产生[9]。Opriessnig等[6]在研究Mhyo与PCV2之间的关系时,得到了类似的结果,即先后感染Mhyo和PCV2的猪产生的Mhyo血清ELISA抗体水平显著高于只感染Mhyo的猪产生的ELISA抗体水平。
另外,Yim等[10]发现支气管败血波氏杆菌抗原对Mhyo的免疫也具有促进作用,接种支气管败血波氏杆菌抗原和Mhyo抗原的小鼠产生的Mhyo特异性IgG高于只接种Mhyo抗原小鼠产生的特异性IgG。Thacker等[11-12]揭示了Mhyo与PRRSV、猪流感病毒(SIV)发生共感染时可以增加Mhyo抗体水平。这些结果提示了Mhyo联苗的免疫效果可能优于猪支原体肺炎单苗。

