检测猪瘟病毒E0抗体ELISA方法的建立与应用
吴许丹,吴月,陈艳,张锦,陈婧,胡家欢,龙云凤,姜焱*,周斌*
(1. 南京农业大学动物医学院,江苏 南京 210095;2. 南京海关动植物与食品检测中心,江苏 南京 210019)
猪瘟病毒(classical swine fever virus,CSFV)是黄病毒科(Flaviviridae)瘟病毒属(Pestivirus)的一种正链RNA病毒[1]。猪瘟一旦暴发,疫源地的养殖业及政府都苦不堪言,全球每年因猪瘟遭受的经济损失数以亿计[2]。CSFV基因组是由两端的非编码区和位于中央的开放式阅读框(open reading frame,ORF)组成[3]。该阅读框编码的多聚蛋白在蛋白酶的作用下被分解成4个结构蛋白(C、E0、E1和E2)和8个非结构蛋白(Npro、P7、NS2、NS3、NS4B、NS4A、NS5A和NS5B)[4]。E0蛋白又称为Erns蛋白,是CSFV的一种囊膜糖蛋白,由多聚蛋白上268位的Glu至494位的Ala之间的227个氨基酸构成,分子量大小为44~48 kDa[5-6]。E0蛋白存在大量的抗原表位,能在病毒感染机体后诱导产生特异的免疫应答反应。可利用E0蛋白的初级抗原表位进行鉴别诊断,特异性区分CSFV、牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)和边界病病毒(border disease virus,BDV)感染[7]。我国《国家中长期动物疫病防治规划(2012—2020)》中已经明确将猪瘟的净化列为重点任务。鉴于目前的猪瘟病毒兔化弱毒疫苗免疫猪群后不能开展血清学鉴别诊断,不少猪场已经开始采用新疆天康生物股份有限公司[8]或者武汉科前生物股份有限公司[9]生产的猪瘟病毒E2亚单位疫苗,免疫后可以引导猪群产生针对E2蛋白的抗体。但应用检测E2抗体的试剂盒无法区分猪群中是否存在野毒感染,因此可通过检测E0蛋白的抗体确定猪群中是否存在野毒感染。本研究根据石门株E0基因序列,设计1对特异性引物,通过RT-PCR扩增目的基因,插入原核表达载体pET-28a中,构建了pET-28a-E0原核表达质粒。诱导表达后获得的目的蛋白经鉴定后进行梯度稀释,包被ELISA抗原板,通过多次优化,建立了检测CSFV E0抗体的ELISA方法,并检测了临床猪血清样本,验证了此方法的临床应用效果,用于初步检测或者鉴别诊断。
1 材料与方法
1.1 毒株、载体和血清样本
大肠杆菌DH5α和BL21(DE3)购自北京庄盟生物科技有限公司;pET-28a原核表达载体由本实验室保存;原核表达的E2蛋白由本实验室保存;猪瘟病毒石门株、猪瘟标准阳性和阴性血清购自中国兽医药品监察所;猪临床血清样本来自南京晟泰沅农牧发展有限公司和新疆天康生物技术股份有限公司。猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病毒(PRV)和猪圆环病毒2型(PCV2)阳性血清由本实验室保存。
1.2 主要试剂
RNA反转录试剂盒、DNA Marker、限制性内切酶BamH Ⅰ、XhoⅠ、Primer Star及T4 Ligase购自大连宝生物科技有限公司(TaKaRa);质粒提取试剂盒购自Omega公司;预染蛋白质分子量标准购自Thermo Scientific公司;6×His标签高亲和力Ni纯化柱购自General Electric公司;BCA蛋白定量试剂盒购自南京诺唯赞生物科技有限公司;ECL化学发光检测试剂盒购自Bio-Rad生命医学产品(上海)有限公司;IDEXX猪瘟抗体ELISA检测试剂盒购自美国IDEXX公司;MEDIAN/JBT猪瘟抗体ELISA检测试剂盒购自北京金诺百泰生物技术有限公司;其他试剂均为进口或国产分析纯。
1.3 目的蛋白表达、纯化与鉴定
1.3.1 目的基因获取与表达质粒构建
根据GenBank登录的石门株(AF092448)E0全长基因序列,用DNA STAR软件设计1对E0全长基因特异性引物(F:5′-TGACGGATCCATGGAAAA-TATAACTCAATGGAACCTGAGCG-3′,R:5′-TGACCTCGAGGGCATAGGCACCAAACCAG-3′),并引入BamHⅠ和XhoⅠ两个酶切位点,交由南京金斯瑞生物科技有限公司合成。提取病毒RNA后反转录为cDNA,并经上述引物扩增获取目的基因。琼脂糖凝胶电泳鉴定后回收目的片段,双酶切处理目的基因和pET-28a原核表达载体,纯化后经T4 Ligase酶16 ℃过夜连接。连接产物转化至大肠杆菌 DH5α细胞,挑选单克隆子扩大培养后,提取质粒进行酶切和测序鉴定,序列正确的原核表达质粒命名为pET-28a-E0。
1.3.2 目的蛋白表达、纯化与鉴定
将成功构建的质粒pET-28a-E0克隆至大肠杆菌BL21细胞,挑选单克隆37 ℃摇床振荡培养至OD600值约为0.6时终止培养,4 ℃冰箱放置15 min。 再加入终浓度0.1 mmol/L的IPTG,37 ℃摇床诱导5 h。离心分离上清和沉淀,超声破碎后,进行SDS-PAGE分析;分别以His标签抗体及标准猪瘟阳性血清作为一抗进行Western blot鉴定。目的蛋白经过大量表达并超声破碎后,利用His标签镍柱纯化后用BCA蛋白定量试剂盒测定浓度,备用。
1.4 E0抗体ELISA方法的建立
1.4.1 最佳抗原包被浓度和一抗血清稀释倍数
在96孔板上用方阵滴定法确定最佳抗原包被浓度和待测样本最佳稀释倍数,利用CBS溶液对已成功制备并测定浓度的E0蛋白进行倍比稀释(0.5、1、2和4 μg/mL)包被后4 ℃静置过夜。次日用1×PBST洗涤4遍,每孔加入300 μL 1%的牛血清白蛋白(BSA),37 ℃静置封闭2 h。洗涤拍干,采用倍比稀释的方法摸索最佳一抗孵育条件,第一行每孔加入100 μL PBST作为阴性对照,第2~7行加入100 μL 稀释倍数分别为400、200、100、50、20、10和2倍的标准阳性血清,37 ℃孵育1 h。弃去板内液体,PBST洗涤4遍,拍干。每孔加入100 μL羊抗猪IgG-HRP二抗,37 ℃孵育30 min。弃去板内液体,PBST洗涤4遍,拍干。加入TMB显色液,每孔100 μL 避光室温显色5~10 min,每孔加入50 μL终止液终止显色,使用酶标仪读取OD值。按照常规方阵滴定法进行结果分析,以阳性、阴性孔OD值的比值即P/N值作为判定标准,对最佳抗原包被浓度和样本最佳稀释倍数进行比较试验,确定最佳反应条件。
1.4.2 最佳一抗血清孵育时间
按照已确定的最佳抗原包被浓度包被ELISA板,分别用标准阳性血清样本和阴性样本,以最佳稀释倍数进行稀释后每孔加入100 μL,设定20、30、45和60 min 4个时间段,每组3个重复。对4个不同一抗孵育时间的P/N结果进行分析,确定最佳一抗孵育时间。
1.4.3 二抗最佳稀释倍数
选择标准阳性血清和阴性血清,按照已确定的孵育时间和稀释倍数进行试验,将羊抗猪IgG-HRP二抗分别进行10 000、20 000、30 000、40 000和50 000倍稀释,每组3个重复。根据每个稀释倍数下3组重复的阴阳性平均OD值计算P/N值,确定二抗最佳稀释倍数。
1.4.4 阴阳性判定临界值
挑选出30个阴性样本,按照优化后的包被和反应条件进行ELISA检测。计算30份样本OD值的平均值(X)和标准方差(SD)。然后计算出X+2SD和X+3SD的值,确定阴阳性判定标准及可疑区间。
1.4.5 重复性试验
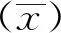
1.4.6 特异性试验
分别选取PRRSV、PRV、PCV2阳性血清和CSFV的阳性及阴性血清作为一抗血清,每个样本做3个重复,按照优化的包被和反应条件进行ELISA试验。计算每个样本3个重复孔的平均OD值,判定本研究方法的特异性是否良好。
1.4.7 符合率测定
用本研究建立的检测方法检测206份临床血清样本,得到的结果同商品化的CSFV抗体ELISA检测试剂盒(IDEXX)检测结果进行对比,比较二者阳性符合率、阴性符合率和总体符合率。
1.5 检测猪瘟病毒E0抗体ELISA方法的鉴别应用
用建立的ELISA方法和商品化的CSFV E2抗体ELISA试剂盒(MEDIAN/JBT)对江苏南京和新疆乌鲁木齐地区免疫E2亚单位疫苗的85份临床猪血清样本进行检测,对结果进行统计分析。
2 结果与分析
2.1 目的基因的PCR扩增及质粒的鉴定
以反转录获得的CSFV石门株cDNA为模板,PCR扩增产物经1%琼脂糖凝胶电泳后,从图1A中可见1条约为681 bp的明亮条带,与预期结果一致。该片段插入原核表达载体后,提取重组质粒进行双酶切鉴定,结果显示出1条约为681 bp的目的条带和1条约为5 370 bp的载体条带,目的条带与PCR结果大小一致(图1B)。将酶切鉴定成功的质粒送至南京金斯瑞生物科技有限公司进行测序,结果显示目的片段序列正确。

M.DNA分子质量标准;1. E0基因;2. pET-28a-E0双酶切鉴定
2.2 目的蛋白的诱导表达与鉴定
重组菌株BL21(pET-28a-E0) 扩大培养超声破碎后,分别收取上清和沉淀进行SDS-PAGE鉴定。结果如图2所示,pET-28a-E0蛋白在诱导后的上清和沉淀中都能表达,但包涵体表达的含量更高,条带大小约为28 kDa,与预期相符。

M.蛋白分子质量标准;1、3.诱导后的上清;2、4.未诱导的上清;5、7.诱导后的包涵体;6、8.未诱导宿主菌裂解物沉淀
IPTG诱导的重组菌沉淀经SDS-PAGE后转移到硝酸纤维素膜上,分别以His标签抗体和标准猪瘟E0阳性血清作为一抗,进行Western blot鉴定。结果表明,重组蛋白能特异性地被His标签抗体和猪瘟标准E0阳性血清识别,如图3所示,28 kDa大小处均出现明亮条带,最终证明重组蛋白E0成功表达且具有良好的免疫反应性。

A.重组蛋白与His抗体反应,其中: M.蛋白分子质量标准;1.重组E0蛋白;2.CSFV E2蛋白阳性对照;3.空载体蛋白对照;B.重组蛋白与标准E0阳性血清反应,其中: M.蛋白分子质量标准;1.重组E0蛋白;2.空载体蛋白对照
2.3 目的蛋白纯化
将鉴定成功表达的菌株大量诱导后进行超声破碎,分离上清和沉淀,通过His标签蛋白纯化柱纯化重组蛋白,用不同浓度咪唑(含有尿素)洗脱纯化柱上结合的蛋白,收集各浓度洗脱液进行SDS-PAGE鉴定。根据图4的SDS-PAGE结果显示,在28 kDa处有明显条带,与未纯化前重组蛋白条带大小一致。
2.4 最佳抗原包被浓度和一抗血清稀释倍数
从表1的结果中可以看到,当蛋白包被浓度为2 μg/mL,一抗稀释倍数为100倍时,P/N值为29.045,显著高于其他浓度试验组。由此,确定最佳包被浓度为2 μg/mL,一抗最佳稀释倍数为100倍。
M.蛋白分子质量标准;1~8. 咪唑洗涤缓冲液浓度分别为0、20、40、70、100、120、150和200 mmol/L
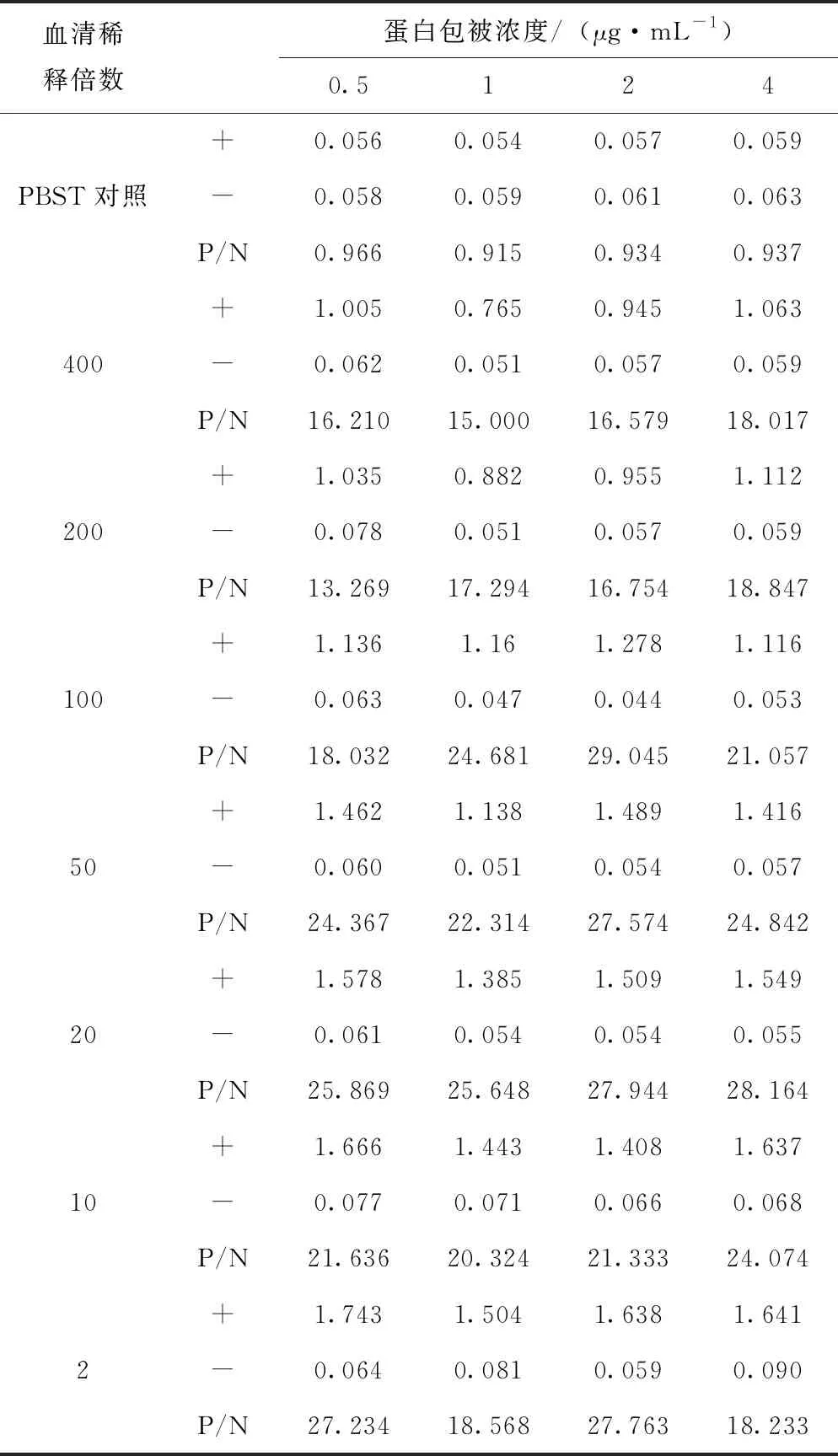
表1 重组蛋白方阵滴定结果(OD值)
2.5 最佳一抗血清孵育时间
根据表2结果显示一抗孵育时间为45 min和30 min时的P/N值较高。由于30 min时的P/N值略高于45 min时的P/N值,而且更节省试验时间,提高试验效率,因此确定最佳一抗孵育时间为30 min。
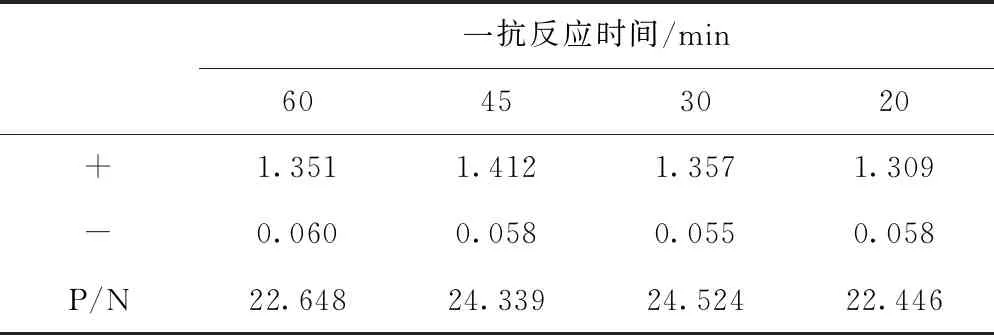
表2 不同一抗孵育时间结果(OD值)
2.6 二抗最佳稀释倍数
用标准阳性血清和阴性血清按照已确定最佳蛋白包被浓度、一抗稀释倍数和一抗反应时间进行试验,将羊抗猪IgG-HRP二抗分别进行倍比稀释后,做3个重复。从表3结果可以看出,二抗进行40 000倍稀释时,阴阳性样本平均OD值的P/N值较大,因此确定二抗最佳稀释倍数为1∶40 000。
2.7 临界值的确定
用本研究建立的ELISA检测方法对所筛选的30份阴性血清进行检测,该30份血清样本OD值平均值(X)为0.043,标准方差(SD)为0.125,因此X+2SD=0.293,X+3SD=0.418。当抗体效价<0.293时,样本判定为阴性;若0.293≤抗体效价≤0.418时,判定结果为可疑;当抗体效价>0.418时,判定结果为阳性。
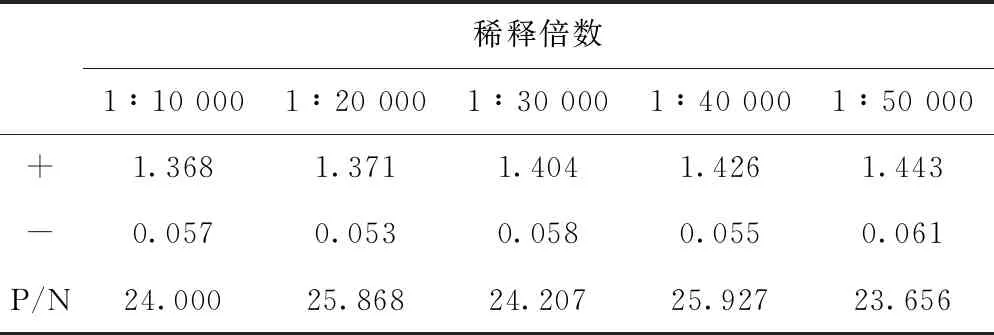
表3 不同二抗稀释倍数结果(OD值)
2.8 重复性检验
重复性试验结果从表4和表5可以看出,组内试验和组间试验结果变异系数均小于10%。符合精密度标准的要求,说明建立的CSFV E0抗体ELISA方法具有良好的重复性。

表4 组内重复性试验结果
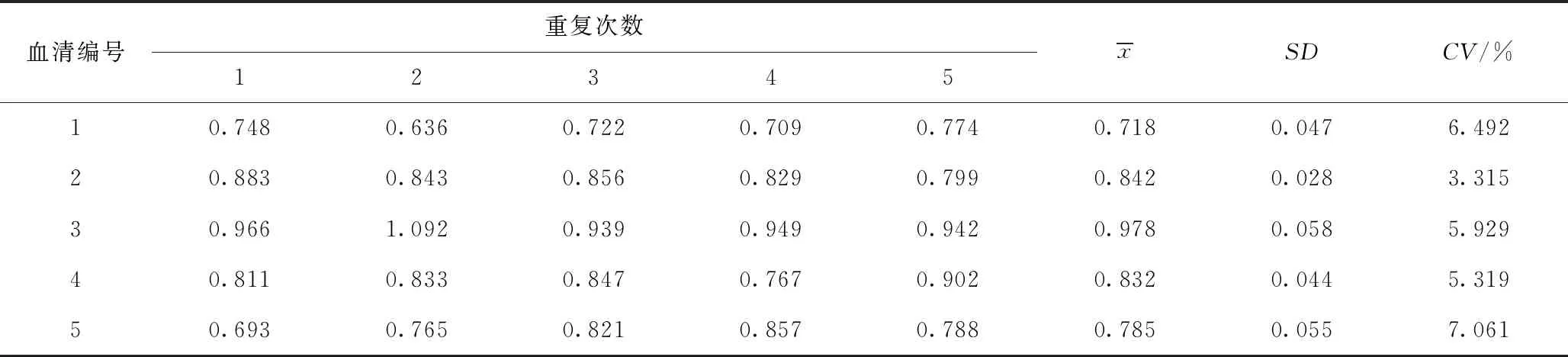
表5 组间重复性试验结果
2.9 特异性试验
根据表6结果显示,PRRSV、PRV(gE)、PCV2阳性血清和CSFV的阴性血清当作一抗孵育后的结果均为阴性,而用CSFV的阳性血清孵育结果为阳性,证明本研究建立的方法具有良好的特异性。

表6 重组蛋白特异性试验结果
2.10 符合率测定
用本研究建立的ELISA方法检测采集的206份临床猪血清,得到的结果同商品化ELISA试剂盒进行比较,结果见表7。由表7可见,商品化试剂盒的诊断结果为168份阳性样本,38份阴性样本;建立的ELISA方法检测结果为174份阳性,32份阴性。2种方法的阳性符合率为96.55%,阴性符合率为84.21%,总体符合率为94.17%。说明本研究建立的E0抗体ELISA检测方法同商品化试剂盒具有较高的符合率,在临床应用方面具有广阔的前景。
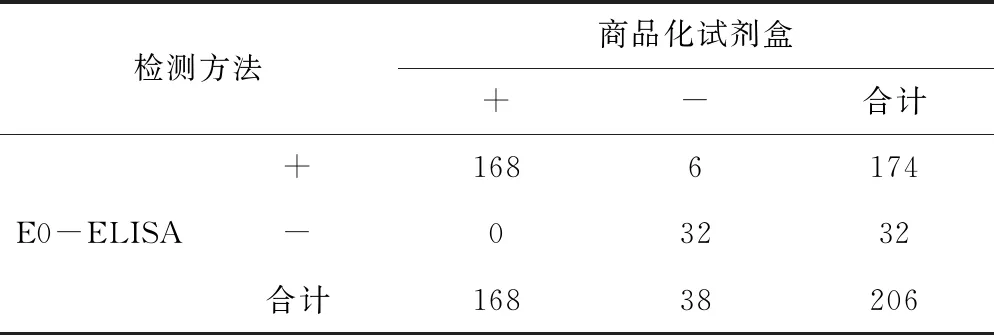
表7 CSFV E0抗体ELISA检测方法与商品化试剂盒诊断结果的比较
2.11 临床样本鉴别诊断
用本研究建立的方法及商品化CSFV E2抗体ELISA试剂盒对免疫了E2亚单位疫苗的85份血清样本进行检测,结果:商品化E2抗体试剂盒检测阳性样本为78份,阳性率为91.76%;本研究建立的方法检测阳性样本为9份,阳性率为10.59%,表明本研究建立的ELISA方法具有鉴别诊断的优点。
3 讨论
E0蛋白是CSFV的一个囊膜糖蛋白,由于其功能性作用广泛,一直是世界范围内研究的热点[10]。E0蛋白能够诱导机体产生特异性中和抗体,是建立CSFV血清学检测方法的优质选择[11]。在各毒株内,E0蛋白的氨基酸序列比编码E2蛋白的氨基酸序列要更保守,因此E0蛋白可作为防治猪瘟的一个靶蛋白[12]。另外,E0蛋白作为CSFV的主要免疫性抗原,确保了本研究所建立方法的准确性。不仅如此,基于E0和E2蛋白建立的猪瘟鉴别诊断方法也得到推广和应用,可以更好地区分CSFV疫苗毒和野毒感染,以及制定针对性的猪瘟防控措施以及免疫程序[13]。
本研究选择了pET-28a载体进行E0蛋白的原核表达,pET-28a载体是一种热表达载体,其诱导条件通常为37 ℃。因此,本研究通过在37 ℃诱导经重组质粒转化后的重组菌株,使得重组目的蛋白能够高效表达,并选择His标签抗体和猪瘟病毒标准阳性血清对表达产物进行Western blot鉴定。成功表达重组蛋白后,借助His标签蛋白纯化柱纯化重组蛋白,对纯化后的目的蛋白进行SDS-PAGE,结果显示纯化后的蛋白组分更纯,浓度更高,具备试验应用价值。本研究利用纯化后的CSFV E0蛋白建立了一种方便有效的间接ELISA方法,并对抗原包被浓度、一抗和二抗的稀释倍数与孵育时间进行了优化。对优化反应条件后的ELISA方法进行分析鉴定,重复性试验结果显示组间和组内试验的变异系数均小于10%,特异性试验结果显示本研究建立的ELISA方法只能与CSFV阳性血清反应,而与其他病毒的阳性血清不反应。因此,本研究建立的ELISA方法具有良好的重复性和特异性。与商品化试剂盒的比较,本方法具备良好的符合率。在临床血清检测方面,本方法也显示出了良好的实际应用价值。
本研究建立的CSFV E0抗体ELISA检测方法具有临床应用价值,对临床血清样本可以进行快速准确的诊断。同时,针对免疫了猪瘟E2亚单位疫苗的猪瘟猪场,用本研究建立的方法检出9份E0阳性样本,说明此猪场存在亚单位疫苗免疫猪感染野毒的情况。因此,本研究建立的ELISA方法能够及时检测出E0抗体(野毒抗体)并完善猪场的免疫程序,初步筛查猪场是否存在野毒感染。

