非体外循环主动脉缩窄根治术治疗儿童主动脉缩窄的疗效分析
章 坚 吴 春 潘征夏 李勇刚 冯 川 熊 玲 金 鑫 冉启仁
主动脉缩窄(coarctation of the aorta,CoA)是指先天性主动脉弓的局限性狭窄,发病率约为0.4‰,病变部位绝大多数位于主动脉峡部、动脉导管或动脉韧带附近[1]。该病可单独存在,也可合并其他心内畸形,如室间隔缺损、瓣膜发育异常等。未经治疗的主动脉缩窄患者自然预后差,平均寿命32~40岁,死亡原因包括充血性心力衰竭、主动脉破裂、感染性心内膜炎、脑出血等致命性并发症[2]。主动脉缩窄手术方式的选择受多种因素影响,如合并心内畸形,主动脉缩窄段的长度、直径,患者术前一般情况等。对于单纯型主动脉缩窄,大多数中心倾向于采用左后外侧入路非体外循环下行主动脉缩窄根治术[3,4];对于主动脉缩窄合并其他心内畸形且该心内畸形有自愈可能者,也可经侧开胸手术;对于低体重、术前反复肺炎、心力衰竭等原因不能耐受体外循环的患者,可一期侧开胸行主动脉缩窄根治术;必要时行肺动脉环缩,二期手术矫正心内畸形[5]。本研究总结了重庆医科大学附属儿童医院收治的69例经左后外侧入路非体外循环下行主动脉缩窄根治术患者的临床资料,现将治疗效果报道如下。
材料与方法
一、临床资料
1. 研究对象:收集重庆医科大学附属儿童医院2010年2月至2019年8月收治的经左后外侧入路非体外循环下行主动脉缩窄矫治术的69例患者作为研究对象,病例纳入标准:术前心脏彩超或心脏大血管增强CT及三维重建诊断为主动脉缩窄且手术在非体外循环下进行。主动脉缩窄诊断标准为主动脉狭窄处直径/降主动脉直径<0.5[6]。排除标准:经胸骨正中入路手术或经左后外侧入路但仅行主动脉松解未切断主动脉。收集患者术前的临床资料、手术相关临床资料及随访资料,通过门诊随访、电话随访及查询患者门诊复查心脏彩超的结果完成随访,以末次随访时的临床资料为准。69例中男38例,女31例,年龄为2天至14岁,年龄中位数和四分位间距为10.4(4.4,53.2)个月,包括新生儿5例(7.2%)。体重2.0~47.0 kg,体重中位数和四分位间距为8.0(5.0,14.5)kg。根据手术时年龄分为低龄组(≤ 1岁)39例和高龄组(1~18岁)30例。术前经心脏彩超诊断为主动脉缩窄的患者均行心脏大血管增强CT及三维重建检查确诊,多普勒超声心动图测得术前缩窄段平均收缩期压差(60.9±20.5)mmHg。导管前型主动脉缩窄36例,导管旁型18例,导管后型15例。合并的心内畸形包括房间隔缺损13例、卵圆孔未闭13例、室间隔缺损5例、主动脉瓣发育异常12例、二尖瓣发育异常6例、三尖瓣发育异常1例。合并其他畸形包括鸡胸4例、脊柱侧弯2例、膈膨升1例、膈疝1例、马蹄肾1例。22例术前胸部CT气道三维重建提示合并气道狭窄,以左主支气管为主,考虑为增大的左房及左室压迫所致。
2. 相关定义:出院后通过导管介入或外科手术方式治疗主动脉再缩窄称为再干预。高血压定义为收缩压和(或)舒张压位于同性别、年龄、身高儿童血压水平的第95百分位以上。
二、手术方法
在气管插管全身麻醉后选择右侧桡动脉和右侧股动脉监测上下肢血压。采用约80°右侧卧位,手术入路选择左后外侧第三或第四肋间。充分游离导管周围组织,游离保护左侧喉返神经。经动脉导管或导管韧带后方放置丝线,予以缝扎切断并切除导管周围组织。术中充分游离主动脉弓、无名动脉、左颈总动脉和左锁骨下动脉及降主动脉,如有迷走左锁骨下动脉则予结扎切断。控制性降温至34℃,阻断主动脉缩窄近端及远端,其间有意升压使下肢获得更好的血供。切除缩窄段主动脉,根据患者主动脉缩窄程度及张力大小选择6-0或7-0Prolene线行主动脉端端吻合术、扩大端端或端侧吻合术。若合并主动脉弓发育不良或吻合口张力过大,可用心包补片或Gore-Tex补片扩大。吻合完成后开放主动脉、复温,如非补片手术常规不予生物胶、止血纱处理吻合口。于左侧腋中线第6或第7肋间置入胸腔引流管,随后使肺复张,逐层关胸,手术结束。术后患者均送入ICU,予以呼吸机辅助通气,持续监测上下肢血压,维持水电解质及酸碱平衡,对血压过高者予硝普纳或硝酸甘油降压。对合并肺炎或长时间呼吸机辅助通气的患者使用抗生素抗感染治疗。所有患者在术后24 h内复查床旁心脏彩超,出院前复查专科心脏彩超。
三、统计学分析
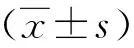
结 果
一、手术相关情况
所有患者经左后外侧入路非体外循环下进行手术,大多数采用端端吻合术(52%),或扩大端端/端侧吻合术(41%),自体心包补片及Gore-Tex人工补片扩大成形术各有2例,1例采用左锁骨下动脉翻转术。平均手术时间(141.3±37.3)min,主动脉阻断时间10~62 min,主动脉平均阻断时间(25.6±8.6)min。本组患者合并的心内畸形大多数为小型卵圆孔未闭、继发孔型房间隔缺损或肌部室间隔缺损,缺损面积较小有自愈可能,多不予同期干预,并告知患者家长有行介入封堵手术的可能。1例4岁男性患者合并膜周部室间隔缺损、重度肺动脉高压,术前右心导管检查提示肺动脉收缩压92 mmHg,且术前存在肺部感染,与家长充分沟通后决定分期手术。
二、术后早期结果
全组术后ICU平均停留时间(6.2±4.6)d,术后机械通气时间的中位数与四分位间距为16.0(6.0,37.5)h,术后胸腔引流平均时间(5.4±3.9)d。全组术后早期无死亡病例,术后并发症包括严重低心排血量综合征4例,经强心、扩容、腹膜透析等治疗后好转;术后异常出血1例,急诊行开胸探查止血;癫痫发作1例,头颅CT检查提示双侧大脑半球灰白质分界欠清、脑室丰满,考虑与缺血缺氧所致皮层功能障碍有关,予以营养神经及康复治疗后好转;术后乳糜胸6例,经低脂饮食治疗后痊愈拔管。全组患者出院前末次复查专科心脏彩超测得吻合口收缩期压差(27.9±12.0)mmHg,较术前缩窄段收缩期压差降低,差异有统计学意义(P<0.05)。与低龄组比较,高龄组患者手术时间、动脉阻断时间、术后胸腔引流时间较长(P<0.05),术后ICU停留时间、术后呼吸机辅助通气时间较短(P<0.05),见表1。
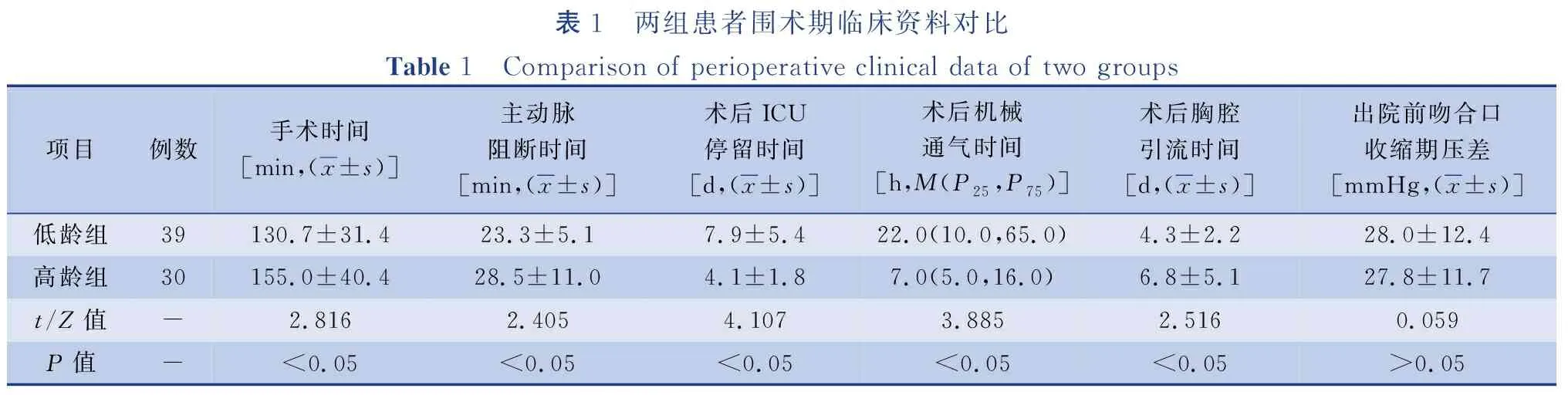
表1 两组患者围术期临床资料对比Table 1 Comparison of perioperative clinical data of two groups项目例数手术时间[min,(x±s)]主动脉阻断时间[min,(x±s)]术后ICU停留时间[d,(x±s)]术后机械通气时间[h,M(P25,P75)]术后胸腔引流时间[d,(x±s)]出院前吻合口收缩期压差[mmHg,(x±s)]低龄组39130.7±31.423.3±5.17.9±5.422.0(10.0,65.0)4.3±2.228.0±12.4高龄组30155.0±40.428.5±11.04.1±1.87.0(5.0,16.0)6.8±5.127.8±11.7t/Z值-2.8162.4054.1073.8852.5160.059P值-<0.05<0.05<0.05<0.05<0.05>0.05
三、随访结果
全组可查询到出院后门诊复查记录的患者共63例,电话随访到59例,随访时间2~118个月,平均随访(49.9±31.8)个月,随访期间无一例死亡病例。末次随访吻合口收缩期压差(21.4±10.0)mmHg。末次随访吻合口压差>20 mmHg的患者19例,其中低年龄组11例(28.2%),高年龄组8例(26.7%),差异无统计学意义(χ2=0.02,P>0.05)。有14例压差为20~40 mmHg,无明显临床症状,且左心功能未见明显异常,股动脉搏动可,建议暂不处理继续随访;5例吻合口压差>40 mmHg,其中2例有明显生长发育迟缓,行球囊扩张手术,再干预率为3.4%。其余3例无明显临床症状,门诊密切随访。随访期间有3例发生高血压且服用降压药物治疗,门诊继续随访中。
讨 论
自Crafoord 1945年首次报道主动脉缩窄手术以来,主动脉缩窄的治疗已经取得了重大进展,然而其手术入路的选择仍然存在争论[7,8]。对于单纯型主动脉缩窄,许多中心倾向于侧开胸非体外循环下进行手术。而对于主动脉缩窄合并复杂心内畸形或主动脉弓发育不良,经胸骨正中入路在体外循环下进行手术仍为首选方式[9],因为经胸骨正中入路能够很好地矫正主动脉弓发育不良及合并的其他心内畸形。然而胸骨正中手术需要在体外循环下进行,虽然手术及体外循环技术不断发展,选择性脑灌注在主动脉缩窄手术中已得到较广泛应用,但仍给患者带来神经系统损伤的风险[3]。侧开胸手术避免了体外循环和深低温停循环对患者的影响,能够减少神经系统并发症,这一点对新生儿和婴儿尤为重要[10]。Mery等[11]对343例侧开胸行主动脉缩窄根治术患者的回顾性研究显示,围术期病死率为1%,随访期间14例因再缩窄接受进一步治疗,再干预率为4%。同样,Farag等[3]对292例侧开胸治疗主动脉缩窄患者进行回顾性研究,发现围术期病死率2%,术后再干预率为9.9%。本组患者围术期无死亡病例,术后考虑再缩窄5例,再干预率3.4%,较既往研究的病死率和再干预率低。有研究表明术前合并主动脉弓发育不良可能会增加侧开胸治疗单纯型主动脉缩窄术后发生再缩窄的风险,然而适用于侧开胸治疗的主动脉缩窄合并主动脉弓发育不良的主动脉具体测量值尚无统一标准[12,13]。
本组随访期间吻合口压差>40 mmHg考虑再缩窄的5例中有1例合并远端主动脉弓发育不良,1例合并全弓发育不良,手术均采用扩大端端吻合术。对于不涉及近端主动脉弓发育不良的患者可通过侧开胸扩大端端吻合的方法来解决,对于合并全弓发育不良的患者侧开胸手术可能会因为遗留发育不良的近端主动脉弓或吻合口张力过高增加术后再缩窄的风险,因此对此类患者更倾向于胸骨正中入路手术。本中心主动脉缩窄患者手术方式的选择考虑到了伴随的心内畸形的种类、主动脉缩窄的部位、严重程度、是否合并主动脉弓发育不良以及患者术前一般情况等因素。本组仅有7例术前合并主动脉弓发育不良,且合并的心内畸形均为较小的卵圆孔未闭、房间隔缺损或较小的肌部室间隔缺损,没有引起血流动力学显著改变的复杂心内畸形,这可能是本组患者术后死亡率及再干预率较低的原因。
本组患者的主要手术方式为主动脉端端吻合术、扩大端端或端侧吻合术。主动脉端端吻合术是1944年Crafoord首次进行主动脉缩窄手术时使用的术式[7]。这种手术方式切除了狭窄段和导管组织,有利于降低术后再缩窄的发生率,且主动脉吻合过程中未使用人工合成材料完全为自体组织,具有生长潜能,但这种手术方式吻合口张力偏高,对缝合技术要求较高[14]。扩大端端或端侧吻合术在自体组织基础上进行修复,并扩充了主动脉横弓,可很好地解决主动脉弓发育不良并减轻了吻合口张力。如今主动脉缩窄首选扩大端端吻合或端侧吻合术,其再缩窄率较其他手术方式低,为4%~11%[15]。本组各有2例使用自体心包补片和Gore-Tex人工补片,这两种补片技术可以应用于较长的缩窄段,避免了环状吻合口,降低了术后再缩窄的发生率,但Gore-Tex补片为人工合成的聚四氟乙烯材料,没有生长潜能且易发生假性动脉瘤。自体心包补片则避免了使用人工材料,弹性好,具有生长潜能且不易形成假性动脉瘤,为较理想的补片材料[16]。左锁骨下动脉翻转术虽然使用自体组织,但需要牺牲左锁骨下动脉,易出现锁骨下动脉盗血现象,可能影响左上肢的正常发育和功能,且该术式没有完全切除狭窄段组织,术后再缩窄的可能性仍较大,本中心现已少用[15]。
本组患者男女比例约1.3∶1,男性患病率高于女性,与此前的研究相似[3]。组间比较显示高龄组患者手术时间、主动脉阻断时间、术后胸腔引流时间较低龄组长(P<0.05)。与低龄组患者相比,高龄组患者主动脉弹性较差,缩窄段较长,增加了主动脉吻合的难度,且随着患者体重的增加,手术视野暴露困难,主动脉游离难度更大,手术范围及创伤相应增加,因此手术时间、主动脉阻断时间、术后胸腔引流时间明显延长。由于本院1岁以下主动脉缩窄患者多为限期手术,如亚急诊手术的新生儿或主动脉缩窄引起肺动脉高压内科治疗不能改善,生后反复肺部感染入院,因此术后呼吸机辅助通气及ICU停留时间较高龄组长(P<0.05),但早期手术没有增加患者术后病死率。婴儿期主动脉缩窄患者容易发生严重的心力衰竭,有研究认为早期手术并不会增加术后发生高血压及再缩窄的风险,术前是否合并主动脉弓发育不良对术后再缩窄的发生有更大的影响,因此年龄和体重不应作为早期手术的禁忌证[17,18]。本组中1例合并膜周部室间隔缺损、重度肺动脉高压的患者术前存在肺部感染,将手术风险与家长充分沟通后选择一期侧开胸非体外循环下行主动脉缩窄根治术,出院后9个月于本院经胸骨正中切口体外循环下行室间隔缺损修补术,术后恢复良好,出院前复查心脏彩超吻合口压差及肺动脉压力较术前均明显下降。对于主动脉缩窄合并其他心内畸形,目前普遍认为一期经胸骨正中切口体外循环下处理主动脉缩窄和心内畸形可达到满意的治疗效果,分期手术需要承担两次手术的风险,增加了住院时间,加重了家庭的经济及心理负担,且两处切口对外观也会有一定影响。然而对于术前一般情况差、手术和麻醉风险较高的患者,一期手术可能会给患者带来更加严重的并发症,因此术前需要医生充分评估与沟通,选择更适宜的手术方案。主动脉缩窄手术的主要目标是降低术后再缩窄及远期高血压的发生率。缩窄部位管腔直径减少超过50%和(或)压力阶差超过20 mmHg常被作为手术和介入治疗的指征[2]。本组有14例末次随访压差在20~40 mmHg,心脏彩超显示4例出现二尖瓣轻-中度反流,3例出现室间隔及左室后壁增厚,左心功能均未见明显异常。压差>40 mmHg的5例患者均存在不同程度的左心室肥厚及瓣膜反流,其中2例进行再干预。本研究认为若无明显临床症状且左心功能正常,无明显下肢发育迟缓,即使主动脉缩窄段压差>20 mmHg可暂不处理,继续随访。本组有3例在随访期间出现高血压且服用降压药物,这3例患者手术时平均年龄11岁5个月。既往研究认为术后远期高血压的发生率与手术年龄呈正相关,但近期有研究表明即使手术年龄趋于低龄化,术后高血压的发生率也并未得到改善[19]。主动脉缩窄术后需要长期监测血压,必要时进行药物或手术干预,这对于提高患者远期生存率及生活质量具有重要意义。综上所述,经左后外侧开胸非体外循环下行主动脉缩窄根治术治疗单纯型主动脉缩窄安全有效,中远期预后较满意。
本研究具有一些局限性。首先由于部分患者依从性的原因,术后未于门诊规律复查,或由于医疗资源等原因缺少上下肢血压的标准化测量数据,高血压的发生率可能被低估。其次本研究为回顾性研究,缺少对照组,仍需要大样本随机对照研究来证实左后外侧开胸非体外循环下主动脉缩窄手术的治疗效果。

