博来霉素致小鼠肺纤维化模型的建立及生物标志物的筛选
王国辽,张 洁,饶家榕,莫睿文,远立国,2*
(1.华南农业大学兽医学院,广州 510642; 2.广东省兽医临床重大疾病综合防控重点实验室,广州 510642)
肺纤维化(pulmonary fibrosis,PF)是一类破坏性、不可逆损伤的弥漫性肺间质疾病,病因极其复杂,机制不明,可致肺功能障碍和呼吸衰竭,尚无有效的治疗方法,预后极差。严重呼吸综合征冠状病毒和新型冠状病毒感染均可引起以肺纤维化为病理特征的肺损害[1-2],在动物临床上也出现了与人PF临床症状相似的发病特征[3-4],对兽医工作者提出巨大挑战。早期诊断和治疗对改善PF的预后意义重大,研究发现,基质金属蛋白酶7(MMP-7)、涎液化糖链抗原6 (KL-6)、肺表面活性蛋白A(SP-A)、肺表面活性蛋白D(SP-D)等PF潜在的标志物[5-6],可能在疾病状态下具有辅助诊断、反映疾病严重程度、动态监测、预后评估、治疗靶点等作用[7-12],因此,以特异性的生物标志物作为PF的检测指标极具临床应用价值[13]。但目前的研究多为针对某个标志物的单独研究,存在诸多不足,其成果较少能应用于临床,联合多种标志物的研究有望克服这些缺点,从而提高检测的准确度[8],然而,相关研究较少,可重复性低,仍需进行大样本的研究和验证。且众多的研究局限于静态研究,缺乏动态追踪。活体动物成像技术能在无创条件下对活体动物进行连续的成像追踪,操作简便、成像直观,可能在肺纤维化诊断和疾病动态追踪中具有实用价值。
因此,本试验建立了BLM诱导小鼠PF模型,拟评估MMP-7、KL-6、SP-A、SP-D 4种标志物在PF小鼠的表达变化及其联合检测的意义,辅以小动物活体成像技术探讨非侵入性的靶向性近红外荧光MMP-7探针在肺纤维化模型中的应用,为动物PF的早期诊断、动态监测、预后、临床治疗及新药的开发提供科学基础。
1 材料与方法
1.1 材料
健康SPF级雄性C57BL/6小鼠6~8周龄,体质量18~20 g,由北京华阜康生物科技股份有限公司提供。博来霉素(海正辉瑞制药有限公司),ELISA检测试剂盒(上海酶联生物科技有限公司),活性近红外荧光探针(IRB-NHS)检测试剂盒(上海科远迪生物科技有限公司),MMP-7多抗、KL-6单抗(Abcam公司),GAPDH(Bioworld公司)。
1.2 方法
1.2.1 分组、建模 40只雄性C57BL/6小鼠随机分为BLM模型组和对照组(CTL组),模型组气管滴注100 μL低(2.0 mg·kg-1)、中(3.5 mg·kg-1)、高(5.0 mg·kg-1)剂量的盐酸博来霉素注射液建立肺纤维化模型,依次记为L组、M组和H组,对照组同法注入等量生理盐水。
1.2.2 肺组织病理学检查 肺组织经石蜡切片后进行HE和Masson染色,采集图像分析。按Szapiel 和Hubner[14-15]的方法进行肺泡炎和纤维化程度评分。
1.2.3 血清及肺组织MMP-7、KL-6、SP-A、SP-D的表达 1)ELISA检测:按照试剂盒说明书进行MMP-7、KL-6、SP-A、SP-D血清指标含量检测,计算样本浓度。2)RT-PCR检测:取小鼠左肺提取RNA,建立RT-PCR体系,扩增并检测目的基因表达,引物序列:MMP-7 F: -3′5′-TTGAACCTGGTACATTGGCTG-3′,R: 5′-GCATCTATCACAGCGTGTTCC-3′,KL-6 F: 5′-ATCGGGGTT-TTACCTGGAAG-3′,R: 5′-CACCACAGCTGGG-TTGGTAT-3′;SP-A F: 5′-CCAATGGGCAGTCAGTC-3′,R: 5′-CCTAAGTAGGGATAGGTG-TT-3′;SP-D F: 5′-CTCTCCTGAGCACGGGACTA-3′,R: 5′-AGCCATTCTCTCCTTTGGGT-3′;GAPDH F: 5′-TTCTGATCTCAGCTCCCCTG-3′,R: 5′-GGCAACAATCTCCACTTTGC-3′。求目的基因与对照基因的Ct平均值,利用公式(2-ΔΔct)计算结果。
1.2.4 MMP-7抗体近红外荧光活体成像靶向性研究 小鼠腹腔注射MMP-7抗体标记的近红外荧光探针后,于1.0、1.5、2.0、12.0、24.0、48.0 h应用小动物活体光学成像仪(激发波长为745 nm,曝光时间1 s,吸收光谱信号收集400~900 nm)采集图像分析。
1.2.5 MMP-7、KL-6蛋白表达及分布 1)免疫组化检测:肺组织石蜡切片常规脱蜡至水,参照说明书进行操作,采集图像分析。2)免疫蛋白印迹法:提取肺组织总蛋白并测定蛋白浓度,Western blot 检测蛋白的表达。

2 结 果
2.1 小鼠生存率及体质量变化
造模时对照组和模型组各有1只小鼠死亡,气管暴露法给药存在一定风险。造模后,对照组的生存率为100.00%,模型组的生存率分别为94.44%、79.92%、35.96%。模型组小鼠体质量造模后持续下降,第10天降到最低点,与对照组差异显著(P<0.05,图1)。

A.体质量; B.生存率A. Body weight; B. Survival rate图1 小鼠体质量及生存率Fig.1 The survival rate and body weight of mice
2.2 肺组织病理学检查
2.2.1 眼观病变 L组有白色条索状不规则纹路;M组肺组织有点状出血区域,部分肺叶有片状梗死区域;H组出现大面积淤血,呈暗红色,肺体积缩小,质地较硬(图2)。

A.对照组;B.L组;C.M组;D.H组A. Group CTL;B. Group L;C. Group M;D. Group H图2 BLM摄入28 d后肺组织眼观病变Fig.2 Pathological changes after administration at day 28
2.2.2 肺泡炎评分 HE染色对照组未见异常;模型组随剂量增高,出现不同程度的肺泡壁增厚、炎性细胞浸润、肺泡结构紊乱或破坏、弥漫性出血、淡粉色胶原纤维沉积、间质性肺炎等肺实变(图3)。BLM摄入剂量与肺泡炎程度评分相关性系数为0.992(P=0.008<0.01),表明BLM摄入剂量与肺泡炎程度显著相关。

A.CTL组;B.L组;C.M组;D.H组A. Group CTL;B. Group L;C. Group M;D. Group H图3 肺组织HE染色结果(200×)Fig.3 HE staining results of lung tissue (200×)
2.2.3 肺纤维化评分 Masson染色对照组小鼠肺组织结构清晰,肺泡壁完整,极少量纤维蓝染,主要分布于大支气管周围;模型组小鼠肺组织均有不同程度纤维化表现,可见胶原纤维沉积、有连续蓝染区域、成纤维细胞异常增生,肺泡壁结构严重破坏,肺泡间隔增厚(图4)。BLM摄入剂量与肺纤维化程度评分相关性系数为0.970(P=0.03<0.05),表明BLM摄入剂量与肺纤维化程度显著相关。

A.CTL组;B.L组;C.M组;D.H组A. Group CTL;B. Group L;C. Group M;D. Group H 图4 肺组织Masson染色结果(200×)Fig.4 Masson staining results of lung tissue (200×)
2.3 血清中MMP-7、KL-6、SP-A、SP-D含量
与对照组相比,模型组4种标志物的含量均升高,除L组和M组的SP-A外,其余各组均与对照组差异显著(表1)。
2.4 肺组织中MMP-7、KL-6、SP-A、SP-D mRNA含量
与对照组相比,模型组SP-A和SP-D mRNA表达降低,MMP-7和KL-6 mRNA表达升高(图5)。

表1 血清MMP-7、KL-6/MUC1、SP-A及SP-D的表达结果
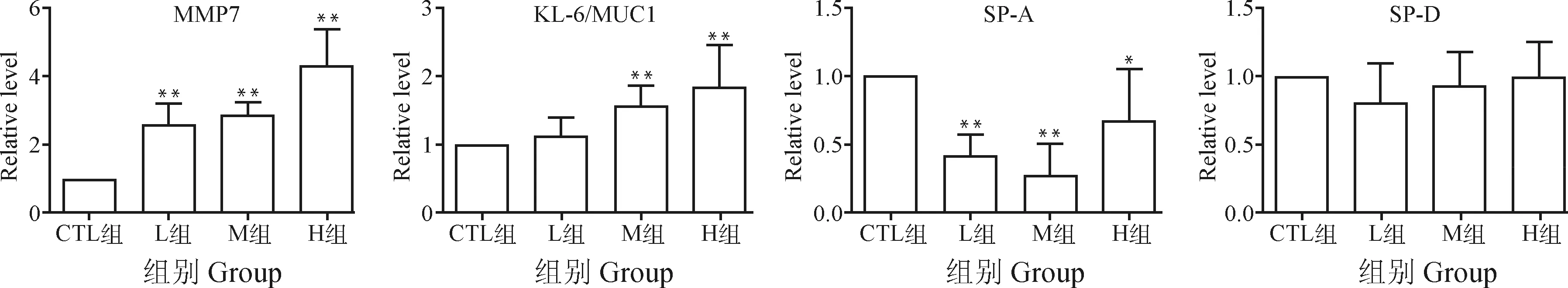
图5 MMP-7、KL-6、SP-A及SP-D mRNA表达量变化Fig.5 The mRNA expressions of MMP-7, KL-6, SP-A, SP-D in lung tissue
2.5 活体成像下MMP-7抗体的分布
注射后2.0 h荧光信号分布于腹部的肾、肝、膀胱及呼吸道,12.0 h后,模型组荧光信号以呼吸道、肺部分布为主(图6A)。48.0 h后,小鼠各器官荧光信号分析显示,对照组小鼠内脏无荧光,H组荧光信号在肺部、呼吸道蓄积,其他模型组肺部未观察到荧光信号(图6B)。H组肺部荧光信号的辐射率分析发现MMP-7抗体持续表达且随时间推移荧光信号逐渐增强(图6C)。
2.6 肺组织MMP7、KL-6蛋白表达
2.6.1 免疫组化法 模型组MMP-7和KL-6主要表达在肺泡上皮细胞、支气管上皮细胞和巨噬细胞,KL-6在H组成纤维细胞胶原纤维及细胞外基质高表达;定量分析MMP-7在对照组、L组、M组和H组的阳性表达率分别为(8.61±0.65)%、(15.48±0.44)%、(17.67±2.58)%和(20.53±4.61)%,KL-6分别为(7.88±0.88)%、(13.01±0.86)%、(26.33±5.96)%及(43.86±0.00)%,详见图7。
2.6.2 Western blot法 以GAPDH为内参蛋白,MMP-7、KL-6蛋白表达量随着摄入剂量的增加而增加(图8),MMP-7、KL-6蛋白的异常表达增多与肺纤维化程度直接相关,提示可能是肺纤维化的生物标志物。

A. 不同时间点荧光信号体内分布情况; B:注射后48.0 h荧光信号在小鼠各脏器分布情况; C. 不同时间小鼠肺部荧光信号辐射率比较A. Fluorescence images in vivo at different time; B. Fluorescence images of in vitro organs after 48.0 h; C. Comparison of the of fluorescent signals图6 近红外荧光成像MMP-7抗体分布及代谢情况Fig.6 Distribution and metabolism of MMP-7 antibody near-infrared fluorescence in vivo imaging

A. MMP-7; B. KL-6; a. CTL组; b. L组; c. M组; d. H组; C、D. 定量分析结果A. MMP-7; B. KL-6; a. Group CTL; b. Group L; c. Group M; d. Group H; C、D. Results quantitative analysis图7 肺组织免疫组化结果(IHC-P,400×)Fig.7 immunohistochemistry results of lung tissue(IHC-P,400×)

图8 MMP-7、KL-6蛋白表达量的变化Fig.8 Changes of expressions of MMP-7, KL-6
3 讨 论
肺纤维化是肺组织损伤后,上皮间充质转化等一系列相关细胞因子相互作用,导致瘢痕组织替代正常肺组织的不易逆转的病理过程,临床上以特发性肺纤维化较为多见[16]。肺纤维化早期表现为中性粒细胞、淋巴细胞及炎性因子增多的肺泡炎,后期以巨噬细胞、成纤维细胞增多,细胞外基质沉积为主。本试验通过气管滴注2.0、3.5、5.0 mg·kg-13个不同剂量的BLM建模观察肺纤维化的病变情况,综合肺泡炎和肺纤维化程度评估发现肺纤维化的严重程度与给药剂量直接相关,剂量越高,肺纤维化越明显。L组纤维化程度最轻,M组肺纤维化特征典型且死亡率低,H组虽肺纤维化特征明显但该剂量小鼠死亡率最高,因此,3.5 mg·kg-1是气管滴注法建立模型较为理想的剂量。
生物标志物由于样本易得、操作方便,具有疾病的早期诊断、病情动态监测及预后评估等临床作用而被广泛研究[17]。MMP-7、KL-6、SP-A和SP-D已被报道为肺纤维化的潜在生物标志物[18-19],具有很大的研究价值。本试验联合MMP-7、KL-6、SP-A、SP-D 4种生物标志物进行研究,应用多种检测手段进一步验证它们与肺纤维化的相关性以及联合检测在肺纤维化诊断中的意义。试验结果显示,肺组织MMP-7和KL-6 的mRNA表达升高,SP-A与SP-D mRNA表达下降;血清中模型组4种生物标志物的表达水平均显著高于对照组,与文献报道一致[10, 20],表明MMP-7、KL-6、SP-A、SP-D的异常表达与肺纤维化密切相关。此外,不同检测方法中,模型组各组不同肺纤维化程度小鼠4种标志物的表达水平与对照组相比,并不都具有显著差异性,可见4种生物标志物的联合检测对提高肺纤维化不同程度和发展时期的诊断、动态监测以及预后的准确率与敏感性至关重要。
SP-A和SP-D作为肺纤维化生物标志物已得到充分研究[17],而越来越多证据表明,MMP-7和KL-6在肺纤维化的诊断、疾病活动监测及预后上有重要价值[20-21]。试验选择mRNA表达量上升的MMP-7与KL-6,进一步验证其蛋白水平的变化,发现两种蛋白的阳性表达率随着BLM摄入剂量的增高而升高,与前述试验结果一致。免疫组化结果可见,MMP-7和 KL-6在肺泡上皮细胞、支气管上皮细胞和巨噬细胞表达,且KL-6同时在成纤维细胞、细胞质内及细胞外基质高表达。
为研究标志物在活体动物肺纤维化过程中的动态变化,探索特异性的诊断方法,对MMP-7抗体进行标记,结果显示,MMP-7探针经过体循环和血液循环最终与肺组织上相关靶点特异性结合,其中,H组48 h后仍表达荧光信号,持续观察到第6天荧光信号才完全消失,说明MMP-7具有肺组织特异性,能够连续直观地展示标志物在体内的动态分布,与体外检测相结合,可提高诊断的准确性和便捷性,为肺纤维化的动态研究提供参考。
4 结 论
本试验成功建立了BLM致小鼠肺纤维化模型,BLM摄入剂量越高肺纤维化程度越严重。MMP-7、KL-6、SP-A、SP-D在肺纤维化模型小鼠肺组织中的表达随肺泡炎或纤维化的严重程度而增高或降低,表明它们是肺纤维化的标志物。4种生物标志物的联合检测可以提高结果的准确率和敏感性,对疾病的辅助诊断、动态监测及预后具有较大的临床应用价值,非侵入性的MMP-7探针可用于小鼠肺纤维化的动态监测。

