新疆两种土地利用方式下土壤病毒的群落组成与功能特征
毕 丽,杜 帅,于丹婷,张丽梅,贺纪正,韩丽丽,*
1 中国科学院生态环境研究中心,城市与区域生态国家重点实验室, 北京 100085
2 中国科学院大学, 北京 100049
3 福建师范大学地理科学学院, 福州 350007
病毒是地球上数量最多、种类最丰富的生物实体,也是生态系统中食物链和食物网的重要组成部分。环境病毒生态学早期主要在海洋生态系统中开展研究,而陆地生态系统病毒学研究在近10年才逐渐发展。据报道每克土壤中的病毒颗粒高达107—109个[1],比细菌总数高1—2个数量级[2]。病毒在陆地生态系统中发挥着重要的生态功能[3-4],如影响宿主的死亡率和群落结构。Li等通过T4型噬菌体标记基因(g23)和细菌16S rRNA基因测序分析发现T4型噬菌体能够影响水稻土壤细菌群落组成[5]。同时,土壤病毒可能是影响微生物死亡率和周转速率的主要原因之一,它可裂解细胞释放出大量的可溶性和颗粒态有机碳,促进其他微生物的转化和利用,从而影响微生物群落结构和元素的生物地球化学循环[6-7]。此外,病毒还可通过携带辅助代谢基因(auxiliary metabolic genes,AMGs)影响宿主代谢,从而间接参与元素循环[4, 8],同时也为宿主提供新的功能基因以拓宽其生态位[8]。
由于土壤病毒具有庞大的数量体和潜在的生态功能,越来越多的研究人员开始关注土壤病毒。土壤病毒丰度和多样性的研究方法主要包括荧光显微计数法、透射电子显微观察、分离培养、特定标记基因分析、宏基因组学和宏病毒组学等[9-10]。宏病毒组和宏基因组是目前病毒生态学研究最重要的手段[3, 10],可以成功避免大量病毒不可培养和缺乏通用标记基因所带来的问题,尤其是宏病毒组学可极大地增加测序序列中病毒基因组的覆盖度。宏病毒组学研究发现在纳米布沙漠土壤中,有尾噬菌体目(Caudovirales)丰度最高,其中以长尾噬菌体科(Siphoviridae)为主[11],这与南极土壤中主要病毒类群的分布一致[12]。而在中国的农田土壤中主要以单链DNA(ssDNA)病毒为主导,其中以微小噬菌体科(Microviridae)和环状病毒科(Circoviridae)为主[13]。近期,Starr等首次通过宏转录组分析发现,植物根际与非根际土壤中的RNA病毒多样性很高,凋落物显著影响病毒和宿主的群落组成,而根系的生长不影响RNA病毒的群落组成[14]。
目前我国土壤宏病毒组仅有少量的研究,主要关注了农田[13, 15]、红树林[16],冰川[17]以及海陆交错带土壤[18]。不同土地利用方式会影响土壤理化性质,例如土壤pH和养分[19],以及微生物群落结构和功能[20]。但是我们对于不同土地利用方式下,病毒的群落结构和功能特征还缺乏认识。因此本研究从新疆阿克苏沙雅县选取两种典型土地利用方式下的土壤(棉花地和荒漠土壤),通过宏病毒组学技术探究土壤病毒群落结构和功能特征,为进一步了解农业活动对土壤病毒分布的影响提供科学依据。
1 材料与方法
1.1 研究区域与样品采集
采样点位于新疆阿克苏沙雅县(东经82.54°、北纬41.32°),该地区属于暖温带沙漠边缘气候区。本研究于2018年6月采集该地区棉花地土壤和荒漠土壤。棉花地种植时间约10a,与荒漠土壤之间间隔约200 m。使用梅花布点法(间隔大于3 m)布设采样点,每个土壤样品选取6个样点,在每个样点采集0—10 cm土壤样品。土壤样品通过冰盒运回实验室。所有土壤通过2 mm筛去除植物残体后,储存于4℃冰箱用于后期土壤理化性质测定和病毒提取。
1.2 土壤理化性质测定
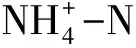
1.3 土壤病毒DNA提取及测序
分别将棉花地和荒漠土壤6个样点的土壤混合成一个样品,根据前期的实验方法提取鲜土中的病毒[13],每个样品提取1次。简述如下:称取过2 mm筛的鲜土500 g,与3 L的甘氨酸缓冲液(250 mM,pH=8.5)混合均匀,于150 rpm振荡15 min。混合液于4℃ 1500 rpm条件下低速离心2 min。收集上清液,沉淀继续添加缓冲液,重悬浮,混合均匀,并重复以上步骤两次。利用切向流过滤系统(Tangential Flow Filter System, QuixStand, GE Healthcare Life Sciences, Pittsburgh, PA, USA)对上清液进行连续过滤,依次通过1 mm,0.45 μm和0.22 μm的滤柱,并收集透过液。再将透过液通过30 kDa的超滤柱进行浓缩并收集截留液(体积不大于100 mL)。浓缩液再经过0.22 μm的无菌过滤器过滤,重复3次以去除连续过滤过程中可能带来的杂菌污染。再以4000 g的转速通过30 kDa超滤离心管(Merck Millipore Ltd., Tullagreen, Ireland)进一步浓缩至体积约为1 mL。接着将病毒浓缩液用DNase I(Thermo Fisher Scientific, Lithuania, EU)在37℃孵育1 h(10 units DNase I/500 μL),以去除土壤中游离的胞外DNA。利用细菌16S rRNA基因PCR(引物27F/1492R)[21]检测并确认没有细菌DNA污染后进行下一步实验。
使用病毒DNA提取试剂盒(Qiagen AllPrep PowerViral DNA/RNA extraction kit(Qiagen, Hilden, Germany))提取浓缩液中的病毒DNA。随后根据基因组扩增试剂盒(REPLI-g Mini Kit(Qiagen, Hilden, Germany))使用说明对提取的病毒DNA进行多重置换扩增,以得到足量的病毒DNA来构建宏病毒组文库。分别利用Nanodrop和Qubit检测DNA的纯度和浓度。再利用超声破碎仪Covaris M220(Covaris, Woburn, MA, USA)将DNA随机打断成长度约为350 bp的片段,建立宏病毒组文库后进行Ilumina HiSeq2500高通量测序。测序工作由北京新科开源基因科技有限公司完成。
1.4 宏病毒组数据分析
测序得到的原始数据通过fastp软件,选择默认参数[22]过滤接头并去除低质量序列,最后得到clean reads。利用SortMeRNA v2.1去除clean reads中的核糖体序列[23],利用bbmap比对NCBI UniVec数据库(ftp://ftp.ncbi.nlm.nih.gov/pub/UniVec, March 2017)去除可移动遗传元件。然后利用metaSPAdes[24]对clean reads进行组装拼接得到原始contigs。Clean reads与病毒数据库进行BLASTx比对和物种注释(E-Value<1e-5,score值> 50)[25],病毒数据库综合了NCBI non-redundant(NR)数据库,Refseq virus 数据库和PHAST网站上的噬菌体数据库(截至2018年8月)[26-28]。比对得到的病毒序列使用Prodigal以默认参数进行开放阅读框(ORFs)预测[29],并与NR和RefSeq病毒蛋白数据库进行比对(Diamond,BLASTp,E-Value<1e-5,identity>60%)[25],最后在MEGAN 6中利用SEED数据库对病毒进行功能分类[30]。通过Virsorter预测病毒contigs[31],contigs仅选取于具有更高可信度的categories 1,2,5。病毒基因组示意图通过Easyfig进行可视化[32]。
1.5 序列提交
本研究中的两个宏病毒组原始序列已经提交至NCBI Sequence Read Archive(SRA),获取号为PRJNA599555。
2 结果与分析
2.1 土壤理化性质
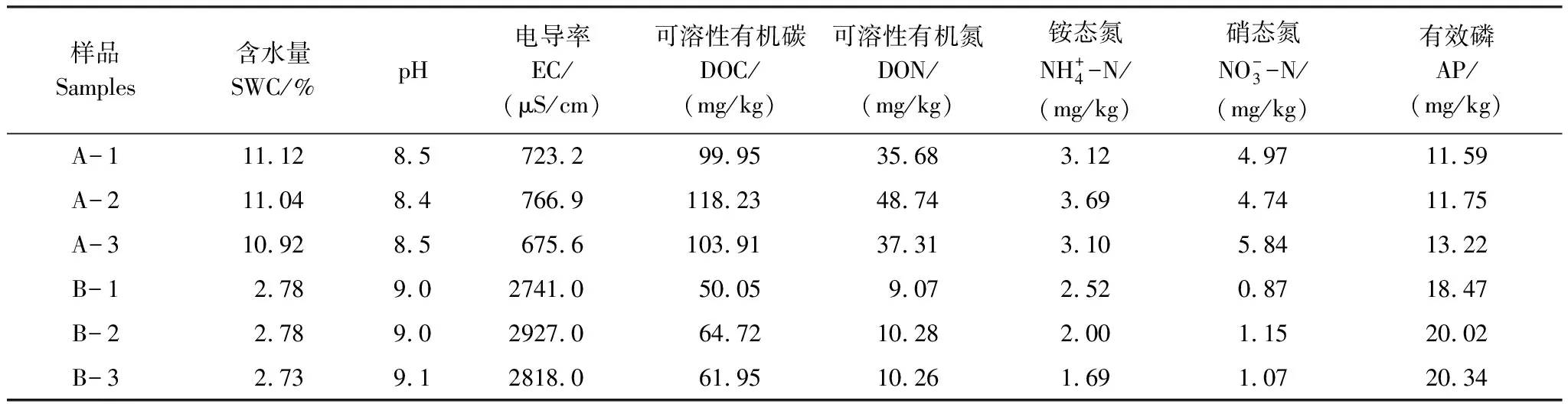
表1 土壤理化性质
2.2 土壤病毒组信息
通过宏病毒组测序,从新疆棉花地和荒漠土壤样品中分别获得78072330和80219056条clean reads,GC含量分别为53.56%和49.45%。在棉花地和荒漠土壤宏病毒组中分别有12.34%和11.57%的reads比对上病毒数据库。对clean reads进行拼接,在棉花地和荒漠土壤宏病毒组中分别获得3050和2771条contigs(>1000 bp),最长的两条contigs分别为13586 bp和17062 bp(表2)。
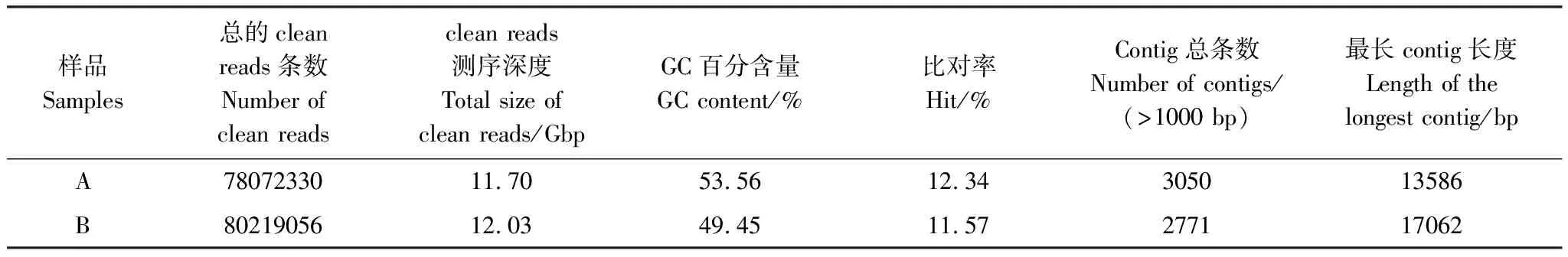
表2 病毒组信息
2.3 病毒群落结构
通过病毒数据库注释,新疆棉花地和荒漠土壤宏病毒组分别注释到20个和15个病毒科和一些未分类的病毒(图1)。在两种土壤中,均是ssDNA病毒占绝对优势,其中微小噬菌体科占比最高,分别为69%和78%。微小噬菌体科主要包括蘑菇状噬菌体亚科(Gokushovirinae),分别占据棉花地和荒漠土壤宏病毒组的35%和39%。环状病毒科在棉花地和荒漠土壤中所占比例分别为2.0%和0.7%,矮缩病毒科(Nanoviridae)在两种土壤中所占比例分别为0.4%和0.2%。两种土壤中均检测到Genomoviridae、双生病毒科(Geminiviridae)、短尾噬菌体科(Podoviridae)、肌尾噬菌体科(Myoviridae)、长尾噬菌体科、Alphasatellitidae、Smacoviridae和脱氧核糖核酸病毒科(Phycodnaviridae)等。此外在棉花地土壤中特有的病毒有花椰菜花叶病毒科(Caulimoviridae)、逆转录病毒科(Retroviridae)、裸露病毒科(Nudiviridae)、多分DNA病毒科(Polydnaviridae)、杆状病毒科(Baculoviridae)和囊泡病毒科(Ascoviridae)。而乳头瘤病毒科(Papillomaviridae)仅在荒漠土壤病毒组中检测到。
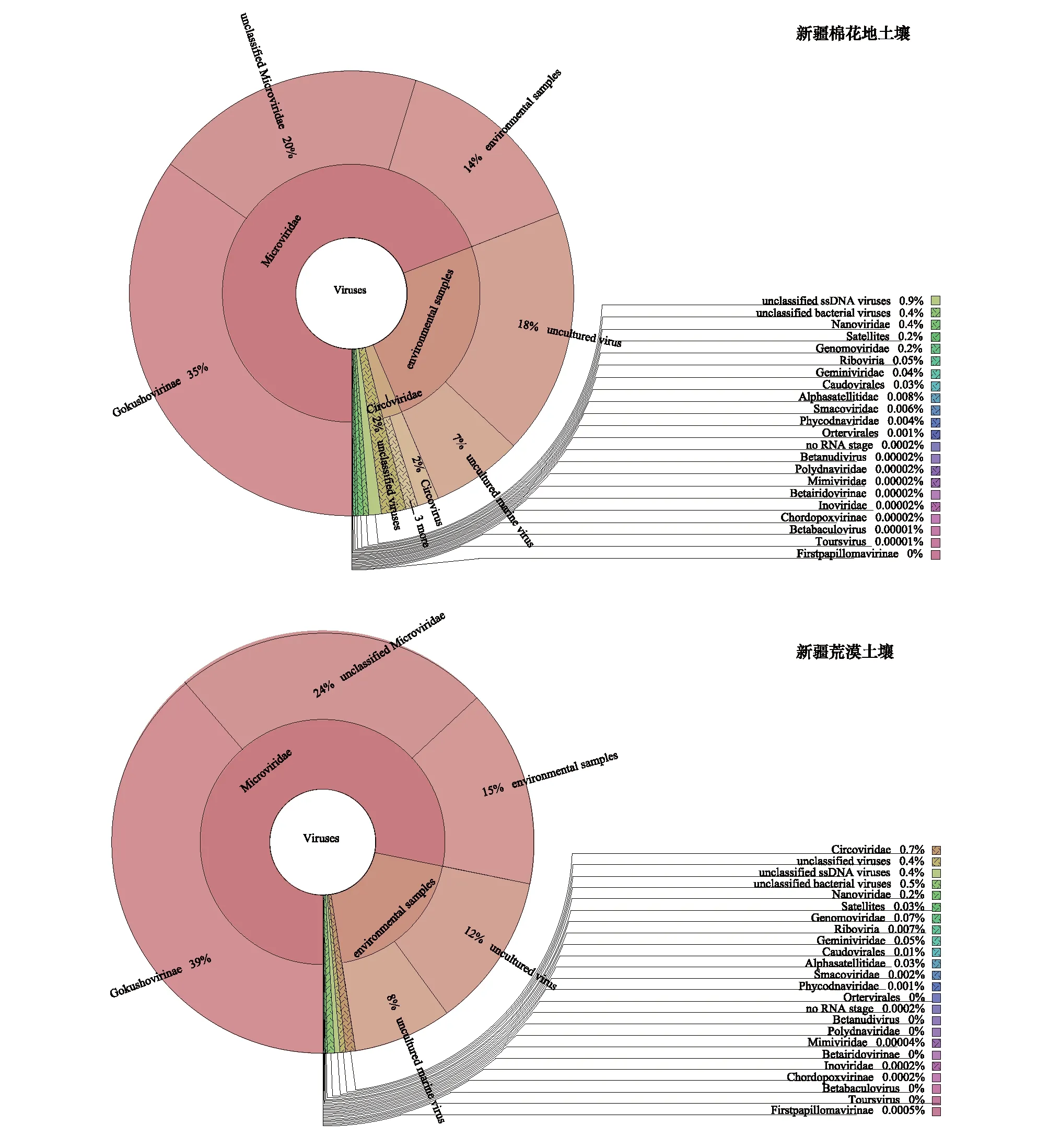
图1 两个土壤病毒组物种注释结果(基于reads注释)
2.4 病毒功能特征
利用MEGAN的SEED数据库对两种土壤的病毒功能进行分类,Level 1水平的主要病毒功能占比类似,均是“Phages, Prophages, Transposable elements”和“Phages, Prophages, Transposable elements, Plasmids”占比最高(图2)。在棉花地土壤中注释到更多的病毒功能分类单元,除以上两种功能外还注释到“Amino Acids and Derivatives”、“Carbohydrates”、“Cofactors, Vitamins, Prosthetic Groups, Pigments”和“Photosynthesis”。在level 2水平上,两个土壤一共注释到30个病毒功能分类单元,其中“Phage capsid proteins”所占比例最高,其次是“Phage packaging machinery”和“Phage head and packaging”(图2)。
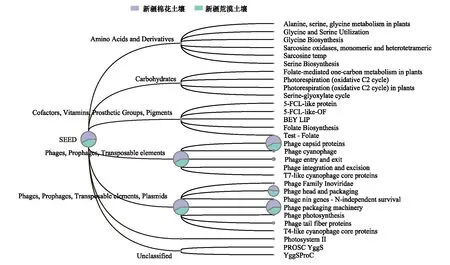
图2 病毒功能注释
2.5 病毒基因组分析
通过Virsorter预测病毒序列和功能注释,在棉花田土壤病毒组中注释到711条病毒contigs(> 1 kb),在荒漠土壤病毒组中注释到1113条病毒contigs(> 1 kb)。两个土壤中的病毒contigs均主要注释到微小噬菌体科。大于5 kb的contigs一共有147条,选择其中最长的两条contigs分析其功能基因组成(图3)。Contig 1携带14个基因,其中包括8个病毒相关功能基因(protein affiliated to virus),5个未知功能基因(unknown function)和1个假设蛋白(hypothetical protein)。Contig 2携带18个基因,其中包括9个病毒相关功能基因,1个未知功能基因和8个假设蛋白(图3)。
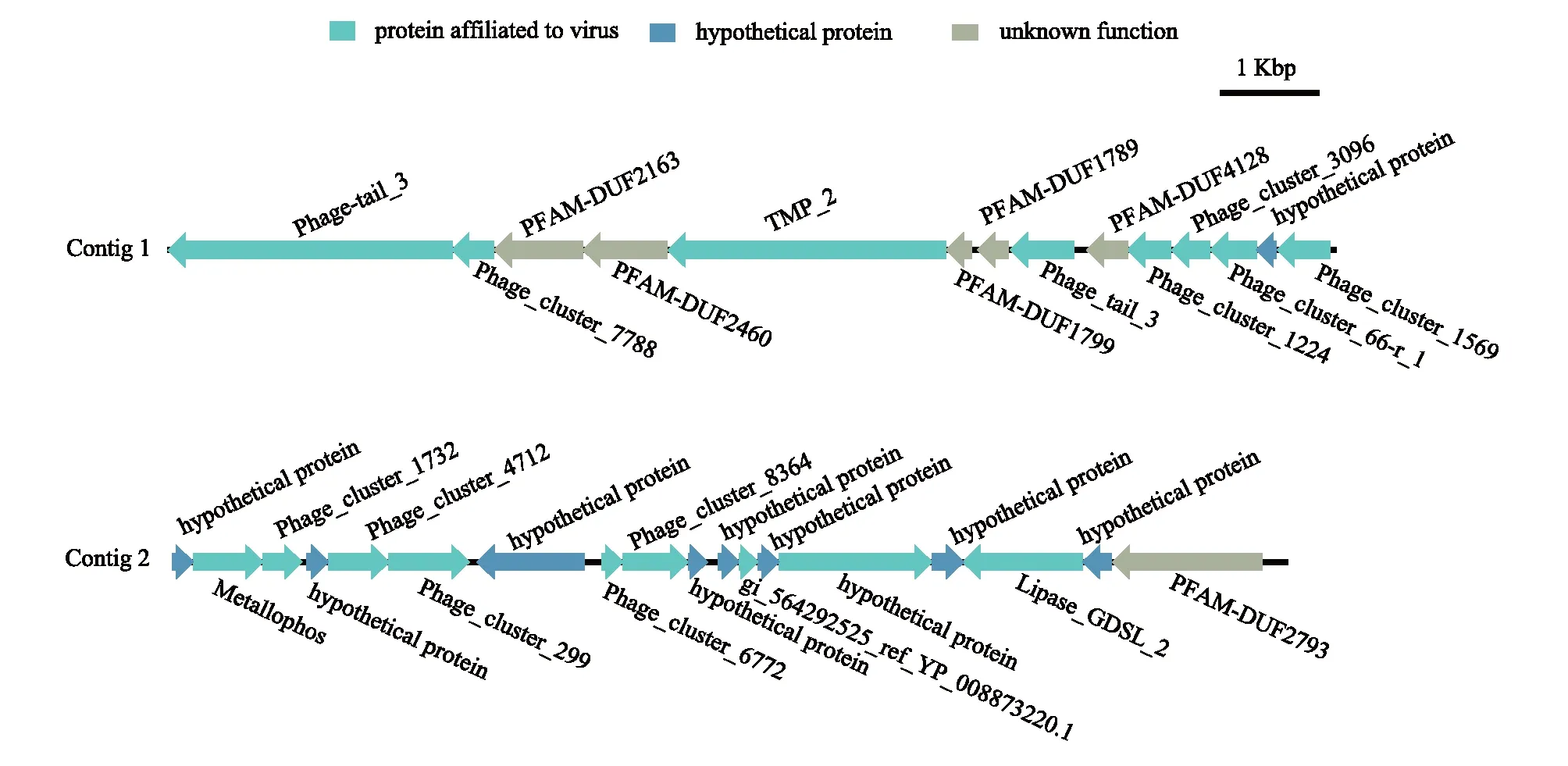
图3 基因组示意图
3 讨论
3.1 新疆两种土地利用方式下土壤病毒群落组成
土壤微生物在自然和人工生态系统中都扮演着十分重要的角色。标记基因和宏基因组学等研究方法极大地推动了我们对土壤微生物的认知和应用,例如合理利用微生物来提高土壤肥力、增加作物产量,增强了我们对陆地生态系统响应环境变化的理解[33]。病毒也在陆地生态系统中发挥着重要的作用,例如通过侵染微生物来调控宿主代谢、影响宿主死亡率等[34]。加州大学戴维斯分校Joanne B.Emerson副教授提出土壤病毒学是土壤微生物学研究的前沿热点,并指出未来可以探究土壤病毒对有机质降解、碳氮元素循环、温室气体排放以及农业生产的影响[35],从而补充土壤微生物对生态过程的贡献。
本研究通过宏病毒组学分析发现,新疆两种不同土地利用方式下的土壤均富集到大量的ssDNA病毒,其中以微小噬菌体科为主。ssDNA病毒一般包括丝状病毒科(Inoviridae)和微小噬菌体科两个噬菌体病毒科和五个真核病毒科[36]。微小噬菌体科是具有环状单链DNA基因组的二十面体的噬菌体家族,主要侵染肠杆菌、细胞内寄生菌和螺原体[37]。微小噬菌体科在感染周期中的潜伏期短、子代释放量大[38],从而广泛分布于环境中,如海洋、污水、沉积物和人体肠道等均有分布。2015年Brian Reavy等人通过宏病毒组学研究发现,苏格兰滨海土壤和农田土壤中ssDNA病毒数量占比最大,以微小噬菌体科为主(分别占84.6%和50.32%)[39]。而在红树林土壤中以动物病毒环状病毒科占主导,其次是微小噬菌体科[16]。有研究指出多重置换扩增可能会偏好性地放大ssDNA病毒[40],从而导致结果中ssDNA病毒比例偏高。在棉花地和荒漠土壤中,dsDNA病毒有尾噬菌体目(包括长尾噬菌体科、肌尾噬菌体科和短尾噬菌体科)所占比例比较低。有尾噬菌体目在部分土壤样品中也占据主导地位,例如纳米布沙漠土壤[11]、美国某些农田土壤[41]以及我国新疆冰川土壤[17]。
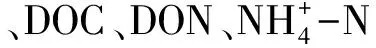
3.2 土壤病毒功能特性
棉花地和荒漠土壤宏病毒组的主要病毒功能注释结果相似,均主要注释到与病毒结构相关的功能,其中“Phage capsid proteins”和“Phage packaging machinery”占比最高(图2)。两条全长病毒基因组序列的分析也表明可注释的编码基因均以病毒结构相关功能为主,未知功能蛋白仍占较高比例(图3)。“phage capsid proteins”是病毒相关的衣壳蛋白,可作为某些特定病毒类群的标记基因,例如T4噬菌体的g23基因[44-45]和微小噬菌体科的VP1蛋白[46]。在纳米布沙漠土壤病毒功能中,“phages, prophages, transposable elements, plasmids”占比最高(49%)[11]。这也与一些美国农田土壤病毒的主要功能类似[41],而部分病毒功能分类单元在农田表层和深层土壤中的相对丰度差异较大,在深层土壤中检测到更多的噬菌体结构相关功能(如噬菌体衣壳、尾部和颈部纤维)。但在中国南方红壤中,仅有少部分病毒功能在玉米根际与非根际土壤之间存在显著差异[15]。此外,相对于其他土壤,棉花地和荒漠土壤病毒组功能类群较为单一[2, 41]。这也可能受到土样样品数量的限制,对于不同土地利用方式下土壤病毒功能特征与差异还需要进一步扩大样品进行探索。此外,由于目前我们对病毒功能基因的分析主要依赖现有数据库,而相关数据库还不完善,功能注释仍存在局限性,因此土壤病毒功能特征还有待进一步地探索和挖掘。
4 结论
本研究通过宏病毒学方法分析了新疆两种土地利用方式下土壤病毒的群落组成和功能特征。棉花地和荒漠土壤的理化性质存在显著差异,两种土壤分别注释到20个和15个病毒科,均以ssDNA病毒为优势类群,其中以微小噬菌体科占绝对优势。在棉花地土壤中检测到更高比例的植物病毒(矮缩病毒科和双生病毒科)。此外,仅在棉花地土壤中检测到与植物相关的花椰菜花叶病毒科,与昆虫相关的裸露病毒科、多分DNA病毒科、杆状病毒科和囊泡病毒科。这些结果表明土壤病毒群落组成可能受到与土地利用方式相关的人为活动、土壤理化性质和动植物的影响。在两种土壤中共获得1824条病毒contigs,主要匹配到微小噬菌体科。用SEED数据库对病毒功能进行注释,棉花地和荒漠土壤病毒组的功能注释均以病毒结构相关功能基因占比最高。本研究探索了新疆农田土壤和荒漠土壤病毒组的特征,未来研究人员还需要在更大时空尺度和基于更多样品的土地利用方式上探究土壤病毒生态学,并进一步阐明土壤病毒对陆地生态过程的贡献。

