以下肢深静脉血栓形成为首发表现的特殊系统性红斑狼疮1例报告
杨晓霞,余 汁,陈 杰,李友山
1 病例资料
患者,女,16岁,主因“右下肢肿胀2周”入院。患者入院2周前无明显诱因出现右下肢肿胀、皮肤潮红,2周来无缓解,入院1 d前于当地医院行右下肢静脉彩超检查,提示右侧股浅静脉远端、腘静脉完全栓塞,转入我院进一步就诊。入院查体:体温37.8 ℃,心肺腹未见异常,右下肢全肢肿胀,腓肠肌肌张力增高,压痛阳性,皮温升高,皮色潮红,无浅静脉曲张。入院诊断:右下肢深静脉血栓形成。实验室检验:血常规:红细胞(RBC)计数3.37×1012/L,血红蛋白(HGB)97 g/L,淋巴细胞绝对值(LY)0.8×109/L;生化:总蛋白(TP)59.6 g/L,白蛋白(ALB)28.6 g/L;凝血功能:部分凝血活酶时间(APTT)63.0 s,D-二聚体0.58 mg/L。
患者入院后予低分子肝素抗凝、马栗种子提取物消肿等对症治疗。入院当天最高体温38.3 ℃,予抗感染治疗,第2天体温下降。于入院第3天行下腔静脉滤器植入术及右下肢深静脉置管溶栓术。造影提示右下肢股浅静脉下1/4段及以下血栓形成,经溶栓导管予尿激酶50万U/d持续溶栓。溶栓3 d后复查右下肢深静脉造影,见血栓部分溶解,予继续留管溶栓。溶栓6 d后复查右下肢深静脉造影,见股浅静脉血栓基本溶解,腘静脉纤细伴侧支循环形成,见图1~3,考虑原有陈旧性血栓,予拔除溶栓导管停止溶栓。患者溶栓期间持续发热,为弛张热,最高39.5 ℃,抗感染治疗效果欠佳。复查血常规:RBC计数3.00×1012/L,HGB 89 g/L,中性粒细胞百分比(NE)78.3%,LY 0.7×109/L,血小板(PLT)97×109 /L,C-反应蛋白(CRP)16.0 mg/L;凝血功能:APTT 64.6 s,凝血酶时间(TT)19.0 s,D-二聚体0.9 mg/L;抗核抗体谱:抗核抗体(ANA)阳性,抗nRNP抗体阳性,抗Sm抗体阳性,抗SS-A抗体阳性,抗Ro52抗体阳性,抗核糖体P蛋白阳性;抗心磷脂抗体(ACA)IgA、IgG、IgM阴性。结合患者右下肢深静脉陈旧性血栓并新发血栓形成,入院时即发现贫血、蛋白尿及低蛋白血症,抗核抗体谱部分阳性,为女性青少年,考虑结缔组织疾病可能性大,遂请风湿免疫科会诊。追问病史,患者曾有一次关节痛及面部红斑,后自愈,无口腔溃疡,无雷诺征等,诊为结缔组织疾病,系统性红斑狼疮(SLE)可能性大。完善相关实验室检验,网织红细胞(RET%)2.60%;血沉(ESR)90 mm/h;24 h尿微量总蛋白227.8 mg/24h;补体C3(C3)0.37 g/L,补体C4(C4)0.03 g/L,T辅 助(CD3+/CD4+)22%,T抑制(CD3+/CD8+)52%,CD4+/CD8+0.42。结合病史及检验检查结果,明确诊断为SLE。

图1 术前右下肢静脉造影
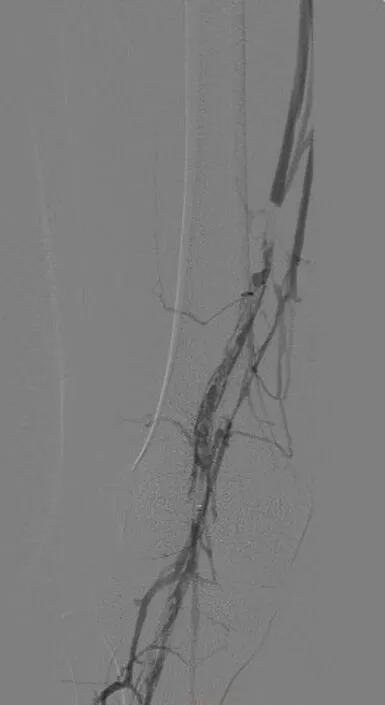
图2 置管溶栓3 d后造影
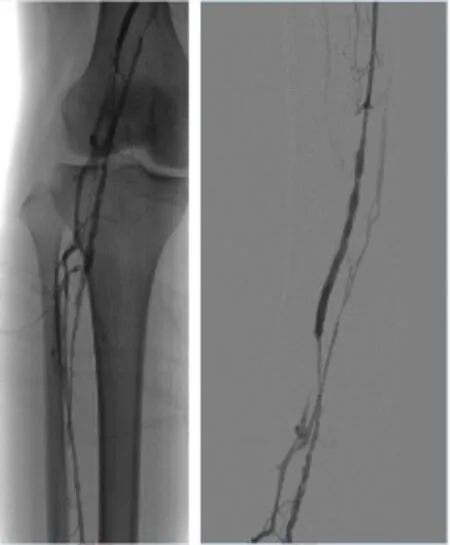
图3 置管溶栓6 d后造影
2 治疗结果
经过溶栓、抗凝等治疗后,患者右下肢肿胀基本缓解。鉴于患者右下肢深静脉血栓形成的治疗基本完成,遂转入风湿免疫科治疗。患者于风湿免疫科治疗期间予糖皮质激素联合免疫抑制治疗,并继续巩固抗凝治疗。经上述治疗后体温降至正常,未再发热,NE、CRP降至正常。2周后转回血管外科行下腔静脉滤器取出术,手术顺利,术后继续抗凝治疗3个月,风湿免疫科随诊。半年后复查右下肢静脉彩超提示深静脉血流通畅,血流充盈良好,无血栓形成(图4)。
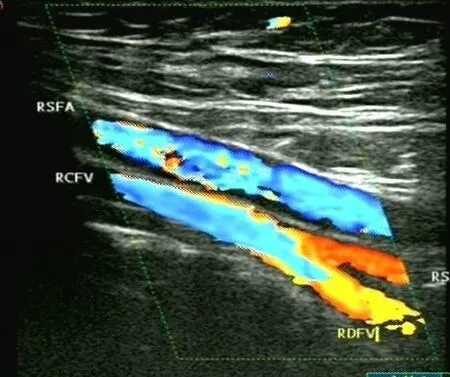
图4 术后半年右下肢静脉彩超
3 讨论
结缔组织疾病在发病过程中易合并深静脉血栓形成(DVT)近年来被逐渐认识,其中尤以SLE患者多见,相关研究报告逐渐增多。而下肢则是SLE患者合并DVT中最为常见的部位。SLE逐渐成为诱发DVT的常见危险因素之一,其机制可能如下:
3.1 血管的损伤 SLE患者血清中存在多种自身免疫性抗体,这些抗体与相应的自身抗原结合形成大量免疫复合物。免疫复合物在血管壁中沉积,或自身免疫性抗体亦可直接侵袭血管壁,同时促进炎性介质的释放,引起炎症反应,发生血管炎性改变,导致血管损伤,诱发血栓形成。炎症反应导致血管内皮功能完整性受损触发凝血级联反应[1]。抗内皮细胞抗体(AECA)可与血管内皮细胞结合,通过补体介导或细胞毒作用损伤血管内皮,与血管炎的发生关系密切。赵益明等[2]研究表明,SLE患者AECA水平明显高于对照组,阳性率高达87.8%。
3.2 血小板、补体及抗磷脂抗体的作用 SLE患者血液中的免疫复合物可介导血小板的活化以及补体在血小板表面或附近的激活[3-4]。活化的血小板可导致补体C1q、C3d和C4d在血小板表面的沉积[5-7]。补体通过经典途径激活后继续导致补体在血小板表面的沉积。同时,补体激活后产生膜攻击复合物,形成血小板微粒,是凝血酶生成的强诱导剂[8]。抗磷脂抗体(APL)是一类以带负电荷的阴离子磷脂为靶抗原的自身抗体,包括抗心磷脂抗体(ACA)、狼疮抗凝物(LA)、抗β2-糖蛋白I抗体(抗β2-GPI抗体)。其中,ACA通过阻碍凝血因子灭活、减少前列环素生成、激活血小板促进血栓形成,ACA阳性的患者血栓发生率较阴性者高[9]。Tektonidou等[10]研究表明,ACA是SLE患者血栓形成的独立危险因素,SLE患者的APL阳性率高于正常人。LA在体内能增强血液高凝状态,促进血小板聚集,抑制纤溶活动,导致患者容易形成血栓相关疾病。β2-GPI是一种血浆糖蛋白,抗β2-GPI抗体与之结合形成抗体复合物,促进血管内皮炎症和血栓形成。APL可以增加血小板表面的补体沉积[11]。通过激活血小板,介导血栓前效应[12],APL阳性的SLE患者的血液中补体C4在血小板表面沉积也会升高[13]。
3.3 蛋白C系统的影响 蛋白C系统包括蛋白C、蛋白S和血栓调节蛋白(TM),是人体内重要的抗凝系统。蛋白C是一种维生素K依赖性血浆糖蛋白,被内皮细胞的凝血酶和血栓调节蛋白复合体激活后成为活化的蛋白C(APC),可以灭活V因子和Ⅷ因子,抑制X因子与血小板结合,同时减少纤溶酶原激活物的抑制物,具有抗凝和促进纤溶的作用,并通过与内皮细胞受体结合维持血管内皮细胞稳定性[14]。蛋白S可以增加APC和血小板之间的亲和力,与APC形成的复合物可以加速凝血因子V、Ⅷ的降解[15-16]。活化的蛋白C抵抗(APCR)是较常见的易栓因素。APCR可降低APC灭活凝血因子V、Ⅷ的能力,导致内皮细胞受损。APL可通过血栓调节蛋白抑制蛋白C活化,造成APCR[17]。SLE患者由于自身免疫机制存在抗蛋白S抗体,导致蛋白S缺乏及活性降低[18],也是诱发APCR的重要因素。SLE患者中ACA和LA阳性的患者游离蛋白S缺乏的概率增加,同时游离蛋白S缺乏的SLE患者较正常水平的患者产生更多的凝血酶,促进血栓形成[19]。
3.4 抗凝血酶Ⅲ 抗凝血酶Ⅲ(AT-Ⅲ)是一种丝氨酸蛋白酶抑制剂,可通过与凝血酶及凝血因子Ⅻa、Ⅺa、Ⅸa、Ⅹa等分子活性中心的丝氨酸残基结合而抑制其活性。AT-Ⅲ具有强大的抗凝活性,是人体内最主要的抗凝因子之一,占血浆抗凝血酶活性的70%左右。SLE患者由于以上各种原因导致凝血系统亢进,导致大量凝血酶生成,消耗大量AT-Ⅲ。同时,由于血管内皮损伤,造成AT-Ⅲ生成减少。另外,ACA可抑制肝素依赖的AT-Ⅲ的激活[20]。以上因素导致患者体内抗凝血酶Ⅲ水平低下,成为诱导血栓形成的机制之一。
本例患者为本院下肢深静脉血栓形成确诊病例中最年轻的,除性别因素外,无明确的DVT危险因素,考虑自身免疫性疾病可能,并予相关实验室检验,并最终证实为SLE。部分SLE起病隐匿,其发病早期症状少、不典型,极易发生误诊、漏诊。SLE患者发生DVT的风险较正常人显著增加[21],在临床工作中,如遇到无明显诱因的DVT的患者,尤其是低龄年轻女性患者,须特别注意排查SLE等自身免疫性疾病,以免延误病情。确诊SLE的患者有必要监测凝血功能、D-二聚体、血黏度、血栓弹力图等,必要时予抗凝药物干预,预防血栓形成。对已发生DVT的SLE患者,有必要检测抗磷脂抗体、蛋白C、蛋白S及抗凝血酶水平,排查有无由SLE诱发的获得性易栓症,指导抗凝治疗。由于研究所限,SLE患者抗凝药物干预时机及周期尚无统一定论,目前临床工作中多处于三级预防即临床预防阶段,具体抗凝干预方案更待进一步研究。

