微生物种衣剂的研制及其对玉米苗期生长的影响
周茂超, 黄艳娜, 段赛菲, 束仕元, 唐雪明*
(1.上海海洋大学食品学院, 上海 201306; 2.上海农业科学院生物技术研究所, 上海 201106)
玉米是我国的主要粮食、饲料与工业原料作物,对国民经济发展具有重要作用。随着玉米地位的提升,提高玉米的品质和总产量已经成为我国农业发展的重要研究方向。影响玉米产量的重要因素之一是土传病害的侵染,因此抑制病害的发生是提高玉米产量的关键。玉米茎腐病又称茎基腐病或青枯病,是世界玉米产区普遍发生的一种土传病害,也是我国玉米产区的主要病害之一[1]。目前对于该病害的防治主要是协调运用生物防治和化学防治等措施。
种衣剂是将一种或多种活性成分与粘合剂和着色剂结合的组合物,在种子消毒、缓释药肥、防治病虫鼠害、提高作物抗逆性和降低环境污染等方面发挥着重要作用。而生物种衣剂是以生物制剂为有效成份的一种新型环保种衣剂,含有对作物有益的微生物或其分泌物,如木霉菌、根瘤菌,固氮菌等。根据生物菌类之间的拮抗原理,筛选有益的拮抗菌,以抵抗有害病菌的繁殖、侵害,从而达到防病的目的。鉴于其环境友好性和可持续发展性,目前具有较好的应用潜力和价值。Zeng等[2]研究发现,由天然多糖聚合物和其他添加剂组成的玉米种衣剂对玉米纹枯病的防治率达到93.72%,抗害虫率达81.29%,玉米增产17.75%。Wu等[3]研究发现,含有根际促生菌Klebsiellaoxtoca和Bacillussp.的生物种衣剂可以将棉花种子的发芽率提高11.3%,也提高了一些主要的植物防御酶活性。目前市场上所使用的玉米种衣剂大多数是农药型种衣剂,许多种衣剂产品存在药剂老化、性状不稳定、包衣脱落率高等问题[4],并且微生物在玉米种衣剂上的应用相对少[5]。因此,研究生物种衣剂对于玉米病害的防治具有十分重要的意义。本研究从微生物菌种资源库中筛选出既有生防作用又有促生效果的菌株,将其与其他助剂一起配制成环保的生物种衣剂,应用于盆栽玉米种植中,探究其对玉米苗期生长的影响。本研究成果可为该生物种衣剂的生产和应用提供参考和理论依据。
1 材料与方法
1.1 试验材料
1.1.1供试菌株和玉米种子玉米茎腐病病原菌为禾谷镰孢菌(Fusariumgraminearum),待筛选拮抗菌包括TXM-1贝莱斯芽孢杆菌(Bacillusvelezensis)、TXM-2解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、TXM-3解淀粉芽孢杆菌(B.amyloliquefaciens)、TXM-4短小芽孢杆菌(Bacilluspumilus)、TXM-5枯草芽孢杆菌(Bacillussubtilis)、TXM-7蜡状芽孢杆菌(Bacilluscereus)、TXMT-2里氏木霉(Trichodermareesei)、TXMT-3里氏木霉(T.reesei)、TXMT-4哈茨木霉(Trichodermaharzianum)和TXMT-5绿色木霉(Trichodermaviride)10个菌株。以上菌株均由上海市农业科学院生物技术研究所唐雪明研究团队筛选提供。供试玉米品种为‘申科糯1号’,种子由上海市农业科学院庄行基地提供。
1.1.2培养基PD液体培养基:葡萄糖20 g,马铃薯200 g,加水定容至1 L。PDA培养基:葡萄糖20 g,马铃薯200 g,琼脂粉20 g,加水定容至1 L。LB液体培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,加水定容至1 L。MKB培养基:酪蛋白氨基酸5 g,甘油15 mL,K2HPO42.5 g,MgSO4·7H2O 2.5 g,加水定容于1 L。培养基均在121 ℃灭菌后使用。
1.1.3主要试剂及溶液的制备CAS检测液:1 mmol·L-1铬天青,4 mmol·L-1十六烷基三甲基溴化铵,0.1 mmol·L-1FeCl3溶液。Salkowski试剂:0.5 mol·L-1FeCl3与浓硫酸按体积比1∶20混合,加入500 mL水混合均匀。
成膜剂助剂制备:将海藻酸钠溶液与聚乙烯醇溶液按照一定的比例混合,再加入5 g·L-1膨润土和1 g·L-1苯甲酸钠,用玻璃棒搅拌混匀。
主要试剂:葡萄糖、琼脂粉、胰蛋白胨、酵母提取物、氯化钠、酪蛋白氨基酸、甘油、K2HPO4、MgSO4·7H2O 、浓硫酸,均购自国药集团化学试剂有限公司。铬天青、十六烷基三甲基溴化铵、FeCl3,购自上海生工生物工程股份有限公司。成膜剂和助剂:聚乙烯醇(polyvinyl alcohol)、海藻酸钠(sodium alginate)、苯甲酸钠(sodium benzoate),购自上海生工生物工程股份有限公司。膨润土(bentonite)、着色珠光粉,购自深圳市航彩化工有限公司。
1.1.4主要仪器Evolution 60紫外分光光度计(美国赛默飞世尔科技公司),ZWY-240摇床(上海智城分析仪器制造有限公司),ZHJH-C1112C型超净工作台(上海智城分析仪器制造有限公司),DHP-9272型培养箱(太仓市华利达实验设备有限公司),XTL-208C型生物显微镜(上海明兹精密仪器有限公司)。
1.2 试验方法
1.2.1拮抗菌的筛选用打孔器分别在木霉和病原菌上打孔,各挑一块至平板两侧的中央,间距5~6 cm。芽孢杆菌则用移液枪头点至距离病原菌块2~3 cm处,放置于28 ℃培养箱倒置培养,以单独培养的病原菌平板为对照。培养3~5 d后,测量对照组病原菌菌落的直线生长距离DCK、对峙培养组病原菌菌落的直线生长距离DS,用以下公式计算抑菌率。
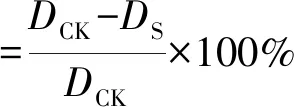
(1)
1.2.2菌株的促生效果检测菌株铁载体的测定采用CAS法[6]。菌株于MKB培养基培养24~48 h,10 000 r·min-1离心10 min,取上清液稀释10倍,加入等体积CAS检测液并混合,静置1 h后于630 nm检测吸光度A。将培养基稀释10倍后与CAS等体积混合测得吸光度Ar,用以下公式计算铁载体活性。
(2)
吲哚乙酸(indole-3-acetic acid,IAA)的测定采用Salkowski试剂比色法[7]:将培养2~3 d的菌悬液5 000 r·min-1离心10 min,上清液与检测液按1∶2比例混匀,在暗处放置30 min后测其在530 nm处吸光值,离心的空培养基作为空白对照。
1.2.3菌株对玉米种子发芽的影响试验将玉米种子浸在1%NaClO溶液10 min,进行表面消毒,然后用无菌水清洗2~3次,洗去NaClO残留液。将108cfu·mL-1的TXM-1和TXM-2菌液稀释100、200、400倍,分别标为TXM-1-100、TXM-1-200、TXM-1-400和TXM-2-100、TXM-2-200、TXM-2-400,用不同浓度菌液浸泡种子3 h后晾干,置于有两层浸湿滤纸的培养皿中培养,室温培养48 h,每个重复10粒玉米,每个处理3个重复。7 d后测量胚芽与胚根长度,计算发芽率,以浸在无菌水中的种子作为对照(CK)。
1.2.4成膜剂理化性能的测定选用海藻酸钠(SA)和聚乙烯醇(PVA)作为成膜剂,将SA和PVA分别按照90%SA+10%PVA、80%SA+20%PVA、70%SA+30%PVA、60%SA+40%PV、50%SA+50%PVA、40%SA+60%PVA、30%SA+70%PVA、20%SA+80%PVA、10%SA+90%PVA共9个体积分数配制药剂。将配置好的药剂于规格5 cm×15 cm的玻板上流延成膜,置于烘箱烘干后,用光学显微镜观察其表面。将玉米种子先用75%乙醇表面消毒10 min,再置于超净台通风口风干。按照药种质量体积比1∶10加入到烧杯中,搅拌混匀进行手动包衣。置于纱布上,至种子表面干燥不粘连,包衣后计时,测定成膜时间。包衣均匀度(uniformity rate of coating,D)和包衣脱落率(shedding rate of coating,X)的测定参考熊海蓉等[8]方法。随机取出10和100粒包衣种子,分别置于两个锥形瓶中,按照每颗种子0.4 mL加入乙醇,摇动1 min,在恒温箱中放置20 min,每隔5 min摇动一次,每次30 s。取出冷却至室温,将液体稀释相同倍数,在550 nm下测定吸光度,根据公式(3)计算包衣均匀度(D)。将包衣种子置于恒温箱内烘15 min,使衣膜固化,取出室温冷却30 min,准确称其质量,再转入250 mL锥形瓶中,在振荡器上振荡1 h。将完整的种子取出,称其质量,根据公式(4)计算包衣脱落率(X)。
(3)
式中,A1是10颗包衣种子用乙醇溶解衣膜稀释后的吸光度值,A2是100粒包衣种子用乙醇溶解衣膜稀释后的吸光度值。
(4)
式中,M1是包衣前的种子质量,M2是包衣后振荡前的种子质量,M3是振荡后包衣种子质量。
1.2.5成膜剂对玉米种子发芽和苗期生长及菌株活性的影响试验将玉米种子浸泡在75%乙醇中进行表面消毒,风干。用90%SA+10%PVA、60%SA+40%PV、30%SA+70%PVA和10%SA+90%PVA配比的成膜剂助剂对玉米种子进行包衣(比例根据成膜时间而定),最后置于两层浸湿滤纸的发芽盒内,常温培养。每个处理10颗种子,3个重复。7 d后,计算发芽率;14 d后,测量根长、茎长、叶长、叶宽,并计算种子活力指数(viability index,VI)[9]。
VI=(茎长+根长)×发芽率
(5)
将4个配比的成膜剂助剂溶液与稀释100倍的发酵液按照体积比1∶1混合均匀,密封放于37 ℃培养箱中5 d,以无菌水与稀释10倍的发酵液1∶1混合液为对照,通过稀释平板计数法计算活菌数,以活菌下降率判断成膜剂助剂对菌株活性的影响。
活菌下降率=
(6)
1.2.6生物种衣剂的制备及其对玉米种子及苗期的影响将90%SA+10%PVA配比的成膜剂助剂溶液中,加入TXM-1和TXM-2菌液,配制BSCA-1和BSCA-2生物种衣剂。具体如下:称取各原料,先将成膜剂和增稠剂放入容器中,加入一定量无菌水,沸水浴直至溶解成粘稠状,冷却至40~50 ℃;再加入除菌剂外的其他原料,混合搅拌均匀;最后加入107cfu·mL-1的TXM-1、TXM-2菌液,充分混合搅拌均匀。将玉米种子表面消毒10 min,置于超净台中风干。按照药种比1:10称取种衣剂和种子,倒入烧杯中,摇动烧杯手动包衣,至种子表面颜色均匀,晾干。
将包衣种子播种于花盆中,每盆10粒,每个处理3次重复,以未包衣种子为对照。分别在第3、7 d,计算发芽势、发芽率和种子活力指数,14 d测定根长、根数、茎长、地上株高、植株鲜重和干重。
1.3 数据分析
采用SPSS 23.0 对测定数据进行差异显著性分析,用Origin 8.5 进行数据处理和绘图。
2 结果与分析
2.1 不同拮抗菌株对病原菌的影响
研究发现,6株菌种有明显抑菌效果,分别为芽孢杆菌TXM-1、TXM-3、TXM-4、TXM-5、TXM-2和木霉TXMT-3(表1),效果最好的是TXM-2,抑菌率达到23.11%,6个菌株对病原菌的抑制作用表现为 TXM-2>TXM-3>TXMT-3>TXM-5>TXM-4>TXM-1。

表1 不同菌株对病原菌的抑制结果Table 1 Inhibitory effect of different strains on pathogenic bacteria
2.2 菌株的促生效果
有研究显示菌株的促生特性与其产IAA能力有关[10],铁载体具有生物防治作用[6],筛选结果(图1)发现,有抑菌效果的TXM-1、TXM-2、TXM-3、TXM-4、TXM-5、TXM-7共6个菌株均有产铁载体和IAA能力,TXM-2的铁载体活性最高,达到15.8个活性单位。TXM-1的IAA含量最高,为9.3 μg·mL-1。综合菌株的抑菌作用和促生效果,选择TXM-2解淀粉芽孢杆菌和TXM-1贝莱斯芽孢杆菌进行进下一步研究。
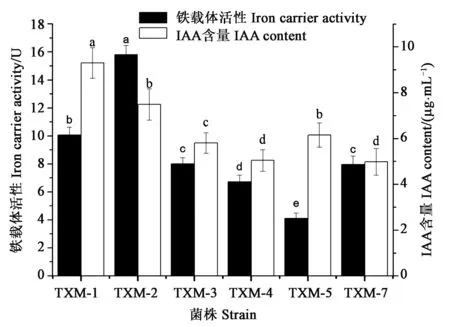
注:图中不同小写字母表示差异在P<0.05水平显著。Note: Different lowercase letters in the figure indicate significant differences between different treatments at P<0.05 level.图1 不同菌株的促生生理特性Fig.1 Physiological activities of different strains
2.3 菌株浓度对玉米种子发芽的影响
由表2可知,不同浓度TXM-2和TXM-1菌液浸泡的玉米种子发芽率均显著高于对照。稀释100倍TXM-2处理的玉米种子发芽率较CK显著提高了29%,200倍和400倍处理均显著提高了40%;稀释100、200和400倍TXM-1处理的玉米种子发芽率分别较CK显著提高了60%、50%和64%。
TXM-2和TXM-1菌液处理的种子胚芽和胚根长度均较对照长。稀释100、200倍TXM-2的胚芽长度分别较CK显著提高了46%和25%,而稀释400倍TXM-2处理的胚芽长度与CK无显著差异。稀释100、200和400倍TXM-2处理的玉米胚根长度分别较CK显著提高了25%、61%、28%。稀释100、200和400倍TXM-1处理的玉米种子胚芽分别较CK显著提高了59%、38%、18%,胚根长度分别较CK显著提高了30%、72%、64%。综合来看,TXM-2和TXM-1的最佳稀释浓度均为200倍,对玉米种子发芽有显著的促生作用。
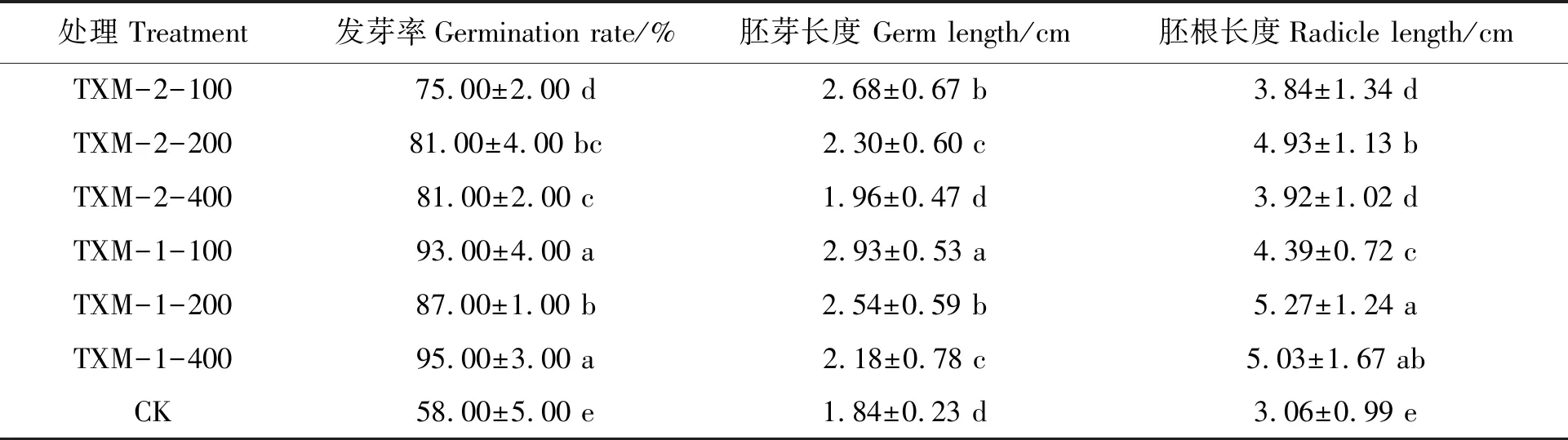
表2 不同浓度菌液处理的玉米种子发芽性状Table 2 Germination indexes of maize treated with different concentrations of bacterial strains
2.4 成膜剂比例的确定
2.4.1不同配比成膜剂的理化性质从玻板的表面看出,海藻酸钠与聚乙烯醇不同比例制作的成膜剂中,10%SA+90%PVA处理的气泡较少,光学显微镜观察也发现,其表面较平滑,没有凹陷(图略)。由表3看出,不同成膜剂的成膜时间均在10 min以内,包衣均匀度均在90%以上,包衣脱落率均在7%以内,成膜性能较好。通过三种性能的综合评价,挑选了90%SA+10%PVA、60%SA+40%PVA、30%SA+70%PVA、10%SA+90%PVA四种配比用于进一步研究。
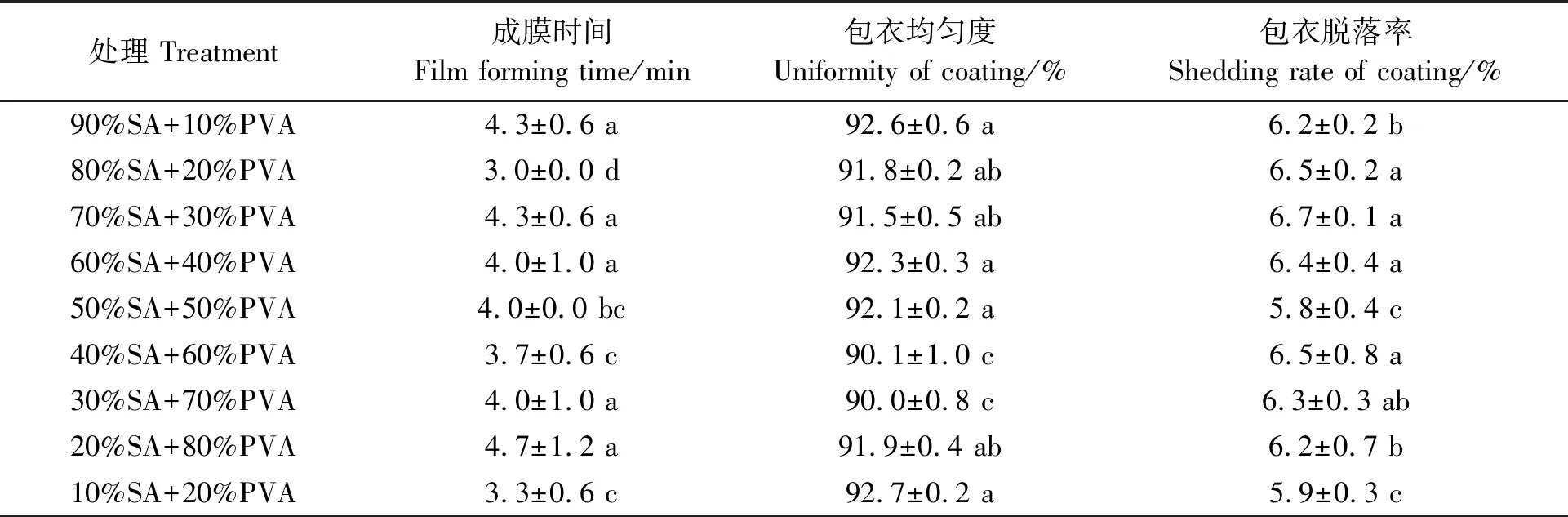
表3 不同比例成膜剂的理化性能Table 3 Physical and chemical properties of film forming agents with different proportions
2.4.2不同配比成膜剂包衣对玉米种子发芽及苗期生长的影响90%SA+10%PVA、60%SA+40%PVA、30%SA+70%PVA、10%SA+90%PVA及CK的成膜剂的包衣种子发芽率和活力指数结果(图2)显示,成膜剂包衣对于玉米种子的发芽率和活力指数没有不利影响,60%SA+40%PVA、30%SA+70%PVA和10%SA+90%PVA成膜剂显著提高了玉米种子的发芽率和种子活力指数,其中10%SA+90%PVA处理效果最佳,其发芽率较CK显著增加19%,种子活力指数显著提高79%。成膜剂包衣对玉米苗期生长有一定的促生作用(表4)。90%SA+10%PVA、30%SA+70%PVA和10%SA+90%PVA 处理的玉米根长较CK显著增加;30%SA+70%PVA 处理的玉米茎长较CK显著提高;60%SA+40%PVA和10%SA+90%PVA 处理的玉米叶长较CK显著增加;不同处理的叶宽没有显著差异。可见,不同处理中,10%SA+90%PVA处理的根长和叶长均最高,分别较CK提高了32%、20%。
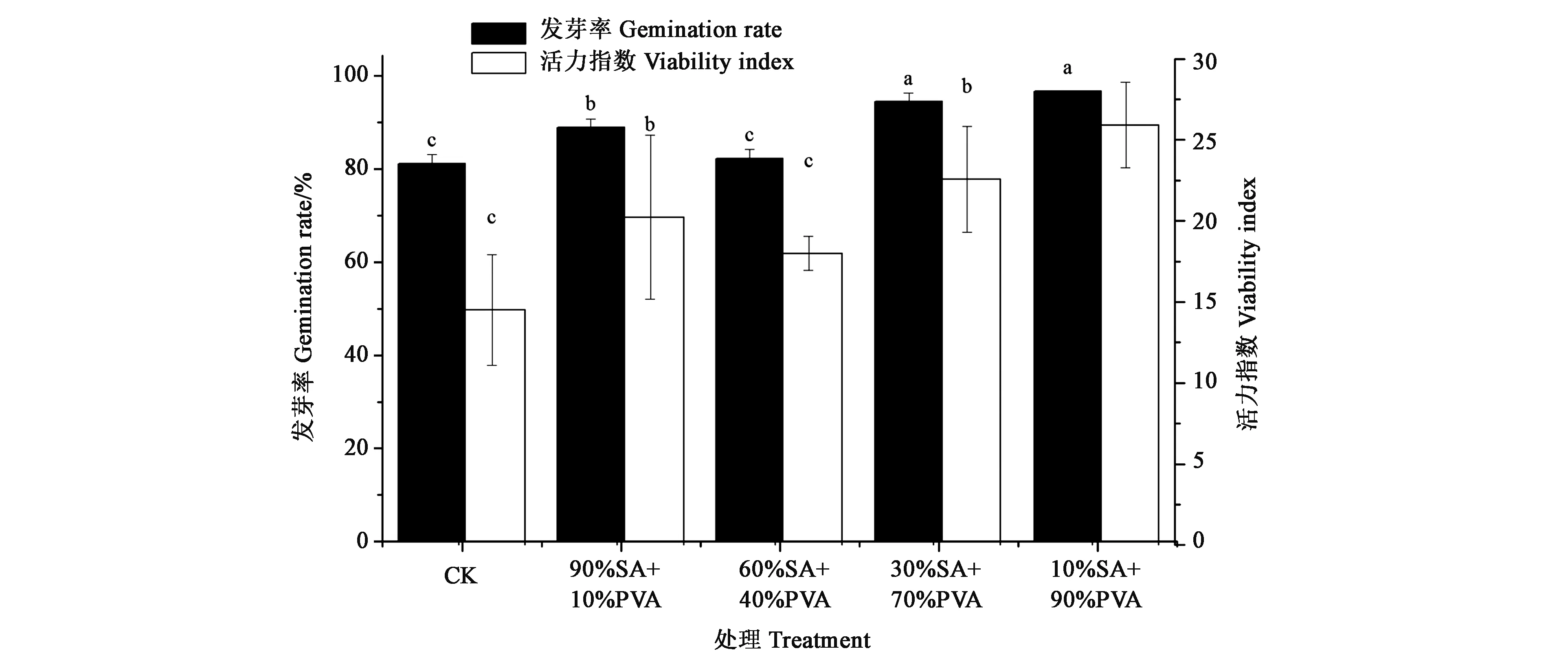
注:不同小写字母表示同一指标不同处理间差异在P<0.05水平显著。Note: Different lowercase letters of the same index indicate significant differences between different treatments at P<0.05 level.图2 不同比例成膜剂包衣的玉米发芽率和种子活力指数Fig.2 Germination rate and seed vigor index of maize coated with different proportions of film forming agents
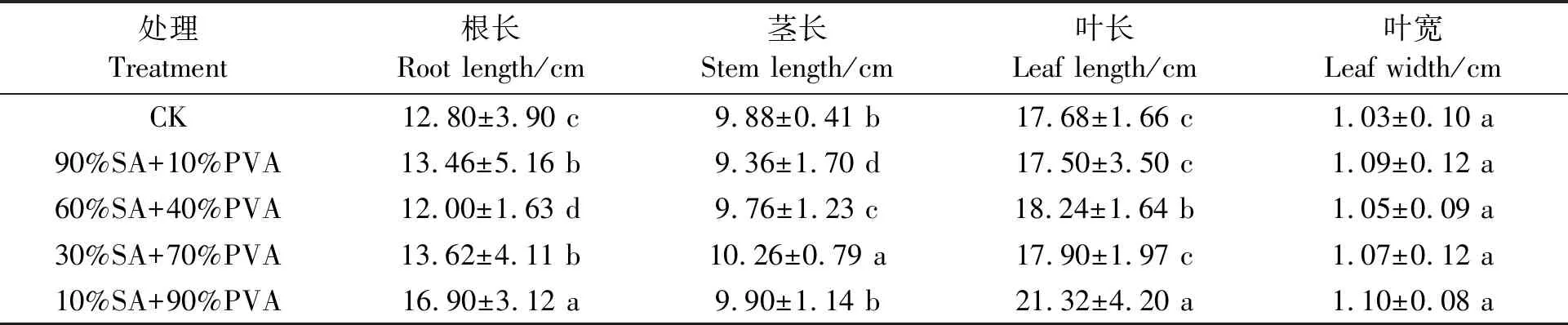
表4 不同比例成膜剂对玉米苗期生长的影响Table 4 Effects of different proportions of film forming agents on the growth of maize seedlings
2.4.3不同配比成膜剂对菌株活性的影响由表5可以看出,成膜剂的添加均引起TXM-1和TXM-2的活菌下降,且随着成膜剂中PVA比例的增加,活菌下降率逐渐下降。其中10%SA+90%PVA成膜剂的活菌下降率最低,表明该比例可以较好地维持菌株活性,从而有利于种衣剂的贮藏。
2.5 BSCA-1和BSCA-2种衣剂对玉米种子及苗期的影响
由表6可知,BSCA-1和BSCA-2种衣剂处理的玉米种子发芽率、发芽势、活力指数均较CK显著提高,发芽率分别提高17%和13%。从苗期生长来看,与裸种相比,经BSCA-1种衣剂处理的玉米苗的根长、茎长、地上株高、鲜重和干重分别较CK显著提高了43%、27%、19%、79%和78%;经种衣剂BSCA-2处理的玉米苗的根长、茎长、地上株高、鲜重和干重分别显著提高了41%、27%、19%、73%和61%。未包衣的种子根系稀疏,包衣后的种子根系粗壮且茂密,表明包衣后对玉米种子有明显的促生作用。
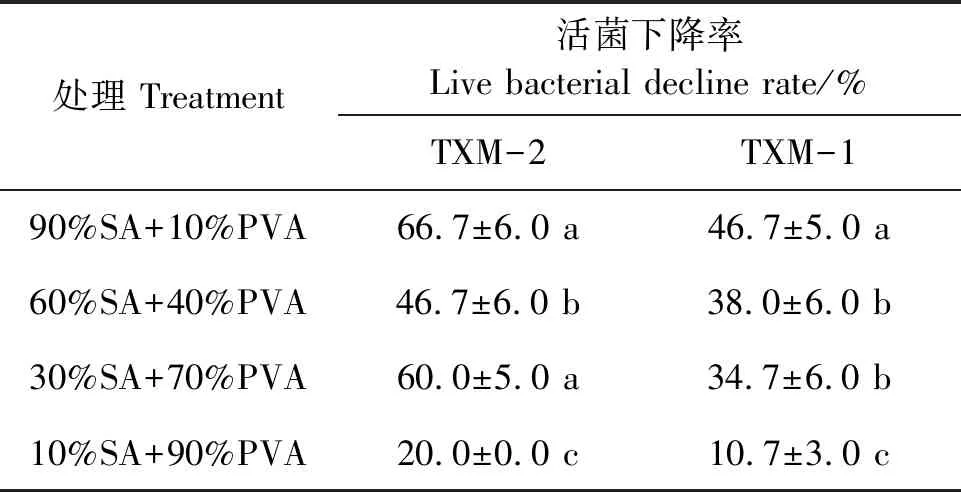
表5 不同比例成膜剂对活菌下降率的影响Table 5 Effects of different proportions of film forming agents on live bacterial decline rate of strains
3 讨论
对玉米土传病害的综合防治一般分为化学防治和生物防治。使用化学农药简单高效,但是会对环境造成一定的影响。利用微生物防治病害成本低、无残毒。而且这些有益微生物不仅能阻止病原菌的生长和侵入,还能在植物根际形成优势菌群,促进植物生长。微生物作为生物种衣剂的有效成分,也是种衣剂制备的关键方向。本研究通过平板对峙试验筛选到6株对玉米茎腐病病原菌均有较强抑制作用的菌株,分别为解淀粉芽孢杆菌TXM-2、解淀粉芽孢杆菌TXM-3、枯草芽孢杆菌TXM-5、短小芽孢杆菌TXM-4、贝莱斯芽孢杆菌TXM-1和里氏木霉TXMT-3,其中解淀粉芽孢杆菌TXM-2的抑菌效果最好。大多数生防菌是从土壤或者植株根际中分离,且对茎腐病病原菌有拮抗作用的细菌以芽孢杆菌为主,Li等[11]从玉米根际分离到一株能减少秸秆腐烂的芽孢杆菌BV23,其在禾本科植物上的抑菌作用最强,抑制66.2%菌丝生长,抑制86.7%孢子产生。真菌以木霉的效果较明显,吴晓儒等[12]通过木霉菌不同颗粒剂配方来计算对玉米茎腐病的防效,并同时进行多个基地的田间试验,结果表明木霉颗粒剂具有良好的生物防治效果及增产作用。这些生物菌剂的应用可以减少或者代替化学农药的使用。
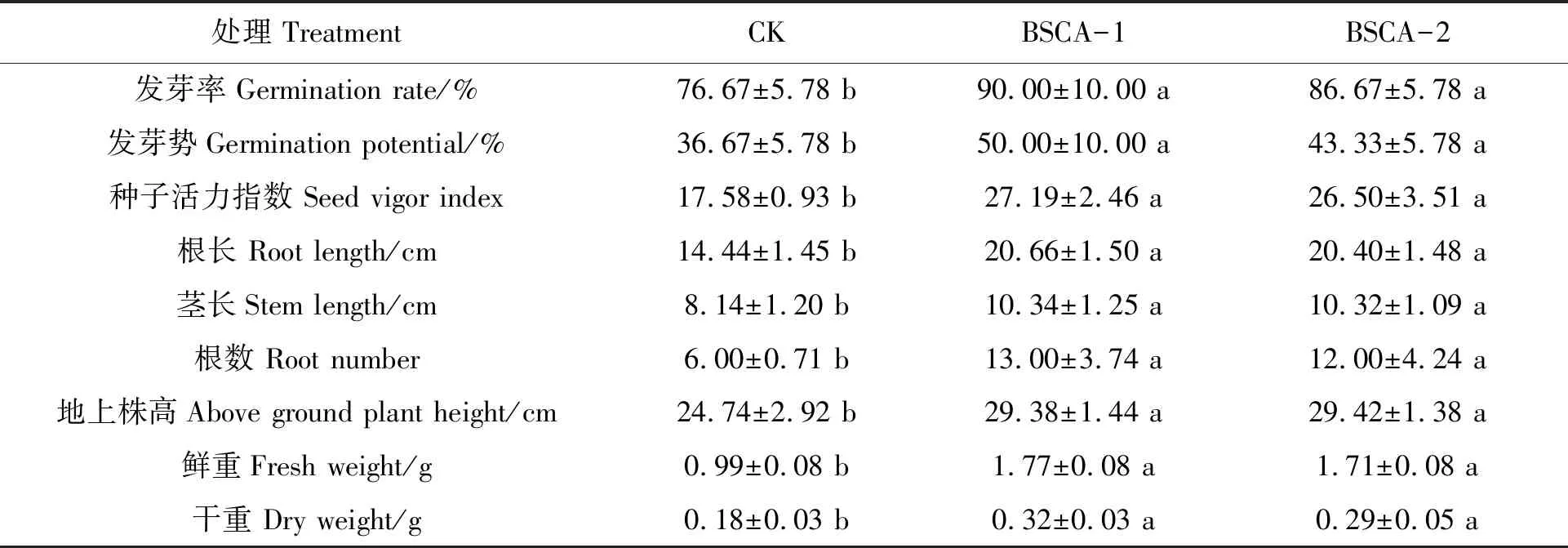
表6 生物种衣剂包衣对玉米种子发芽和苗期生长的影响Table 6 Effects of biological seed coating agents on seed germination and seedling the growth of maize
植物根际与其营养的吸收利用直接相关,产生植物激素(IAA)和铁载体等生理活性物质与植物的根际营养密切相关[13]。有研究表明铁载体和吲哚乙酸可以修复被重金属[14]和多环芳烃[15]污染的土壤,因而它们也具有修复土壤的潜力,是有较好应用前景的生物制剂。本研究通过促生生理指标的测定筛选到6株具有产铁载体和IAA能力的菌株,其中TXM-2和TXM-1两株菌的含量均较高,并且通过种子发芽试验,验证了其对种子发芽及幼苗生长的促进作用。结合抑菌作用和促生生理活性的比较,选择具有抑菌和促生功能的TXM-2和TXM-1菌株。
成膜剂是种衣剂的重要部分,其决定了种衣剂产品的包衣性能[16]。聚乙烯醇能形成表面光滑、强韧的膜。海藻酸钠中大量的羟基和羧基可与聚乙烯醇的羟基形成氢键,从而形成性能较好的混合膜,并且还具有促进种子萌发的作用[17]。膨润土作为种衣剂的助剂,本身表面含有大量的羟基,与海藻酸钠也会形成氢键作用[18]。本研究发现,作为种衣成膜剂成分,90%SA+10%PVA处理的玉米种子发芽和苗期生长最佳,菌株TXM-1和TXM-2的活性下降率最低。因此,成膜剂90%SA+10%PVA具有协同促生和减缓菌株活性下降的作用。从目前玉米的生物种衣剂研究现状来看,芽孢杆菌、木霉菌、黄曲霉等菌株均可作为活性成分。张婷[19]将以木霉菌为活性成分的种衣剂应用于玉米种子中,对于玉米出苗和生长有明显的促进作用,并且对根腐病有较好的防治效果。Cesare 等[20]研究的玉米种衣剂活性成分由不产黄曲霉毒素的黄曲霉菌株和两种传统农药复合而成,发现该种衣剂能够降低玉米粒中黄曲霉毒素的含量。本研究结合菌株的抑菌和促生特性,确定以贝莱斯芽孢杆菌TXM-1和解淀粉芽孢杆菌TXM-2分别为活性成分配制而成的两种生物种衣剂BSCA-1和BSCA-2,具有良好的促进玉米种子发芽能力;结合盆栽试验发现,这两种生物种衣剂在保证拮抗病原菌生长的同时,还可促进玉米的苗期生长,然而还有待大田试验进一步验证。基于微囊剂能更好地保护生防菌免受环境影响[21],将微囊剂添加到玉米生物种衣剂中从而延长生防菌活性维持时间,值得进一步研究。

