溶瘤病毒治疗恶性肿瘤临床应用上海专家共识(2021年版)
溶瘤病毒是一类能选择性地感染并杀死肿瘤细胞而不损伤正常细胞的天然或重组病毒[1]。与传统免疫治疗相比,溶瘤病毒治疗具有靶向性好、不良反应小、杀伤肿瘤途径多、不易产生耐药性等优势。多项临床研究[2-3]显示,溶瘤病毒可为不同类型、不同进展阶段,甚至转移性和无法治愈的肿瘤患者带来临床获益。更重要的是,其与化疗、放疗、免疫治疗等联合应用时,具有协同增效的作用,可使原先对免疫检查点抑制剂等免疫治疗药物反应欠佳的瘤种变得敏感[2,4]。
自2005年国家药品监督管理局批准第一个溶瘤腺病毒药物H101(重组人5型腺病毒,安柯瑞®)联合化疗用于治疗晚期鼻咽癌患者以来[5],溶瘤病毒的研究数量不断增加,截至目前,全球在ClinicalTrials上注册的溶瘤病毒相关临床研究已超过100项。2015年美国食品药品管理局(Food and Drug Administration,FDA)和欧洲药品管理局相继批准Ⅰ型单纯疱疹病毒(herpes simplex virus type 1,HSV-1)T-VEC(talimogene laherparepvec,Imlygic®)[3]治疗晚期黑色素瘤,进一步促进了溶瘤病毒疗法的发展和成熟。目前,溶瘤病毒正在成为癌症免疫治疗的重要手段之一。
但在实际临床工作中,多数医师对溶瘤病毒类药物的作用机制及循证医学证据缺乏足够的了解,临床应用缺乏统一规范,且目前国内外尚未见溶瘤病毒在抗肿瘤治疗方面的专家共识。有鉴于此,由上海市抗癌协会肿瘤免疫治疗专业委员会牵头,组织上海数十位肿瘤生物免疫治疗基础与临床研究领域的专家,参考近年来溶瘤病毒在抗肿瘤治疗领域的基础与临床研究结果,结合专家们的实际临床工作经验,从溶瘤病毒的分类、抗肿瘤机制、临床应用的循证医学证据、使用方法、不良反应管理及疗效评估等方面编写本共识,以期为临床医师规范使用溶瘤病毒类药物提供参考。
1 溶瘤病毒类药物的分类与作用机制
1.1 溶瘤病毒类药物分类
目前开发用于肿瘤治疗的溶瘤病毒类药物已有数十种,包括腺病毒(adenovirus)、HSV-1、牛痘病毒(vaccinia virus)、呼肠孤病毒(reovirus)、新城疫病毒(newcastle disease virus)等[6]。在2000—2020年发表的临床试验中,最常用的5种溶瘤病毒分别为腺病毒、HSV-1、呼肠孤病毒、牛痘病毒和新城疫病毒[7]。本共识主要介绍已完成Ⅲ期临床研究并获批上市的两种溶瘤病毒类药物:H101(重组人5型腺病毒)和T-VEC(HSV-1)(表1)。

表1 目前已获批上市的溶瘤病毒类药物
腺病毒是一种无包膜的双链DNA病毒,其通过柯萨奇-腺病毒受体进入细胞后,在细胞核中表达病毒复制所必需的基因(编码产生E1A和E1B蛋白),E1A和E1B蛋白可分别调节视网膜母细胞瘤相关蛋白(retinoblastoma-associated protein,pRb)和p53信号转导通路,促进宿主细胞的分裂增殖,从而实现在细胞内大量复制繁殖的目的[8]。因此,去除E1A和E1B基因的溶瘤腺病毒仅能在pRb和p53信号通路异常的肿瘤细胞中复制增殖,而在pRb和p53信号通路正常的宿主细胞内无法增殖。H101是以5型腺病毒载体为主链构建的一种删除E1B-55 kD和E3区基因片段(78.3~85.8 mu)的溶瘤病毒。早期临床研究[9]表明,H101单药治疗恶性肿瘤具有一定的疗效,患者耐受性良好,未观察到剂量限制性毒性,主要不良反应为注射部位疼痛和发热,无严重不良反应,也未发现H101向体外播散的证据。且H101与化疗药物联合有助于提高化疗效果[2]。H101治疗头颈部鳞状细胞癌患者的安全性和有效性已在Ⅰ、Ⅱ、Ⅲ期临床试验中得到验证[2]。这直接促使2005年国家药品监督管理局批准H101联合化疗药物用于治疗晚期鼻咽癌患者。此外,多项临床试验[10-11]显示,H101还可为其他肿瘤(如肝细胞癌、胰腺癌、非小细胞肺癌等)患者带来一定的临床获益。
HSV-1是一种双链DNA病毒,可感染多种类型的细胞,包括上皮细胞、免疫细胞和神经细胞。T-VEC是经过基因改造的一种HSV-1,该病毒被敲除了神经毒力基因ICP34.5和抗原递呈抑制剂ICP47,并插入人粒细胞-巨噬细胞集落刺激因子(human granulocyte-macrophage colony stimulating factor,hGM-CSF)基因,其目的是在降低T-VEC神经毒性的同时提高其对肿瘤细胞的选择性,并诱导抗肿瘤免疫反应[12-13]。T-VEC的抗肿瘤作用已在黑色素瘤、胰腺癌、头颈部鳞状细胞癌、乳腺癌等患者中进行了评估[3-14]。2015年,美国FDA批准T-VEC用于手术切除后复发的黑色素瘤患者的局部治疗。
1.2 溶瘤病毒类药物的抗肿瘤机制
目前认为,溶瘤病毒主要可通过以下4种作用机制发挥抗肿瘤活性[1]。
1.2.1 溶瘤作用
溶瘤病毒可在肿瘤细胞内进行特异性复制,这主要是由于肿瘤的特异性畸变导致细胞信号转导通路不能感知和阻断病毒复制,肿瘤干扰素缺陷不能调控病毒防御新系统,从而提高病毒感染的敏感性[15]。通过基因改造可减弱或删除溶瘤病毒的毒性因子,使溶瘤病毒不能在正常组织中复制,但仍保留在肿瘤细胞内复制并杀死肿瘤细胞的能力[15],如删除了E1B-55 kD和E3区基因片段(78.3~85.8 mu)的H101腺病毒不能在p53正常的细胞中复制,因此不能感染p53正常细胞[2]。
1.2.2 激发抗肿瘤免疫反应
溶瘤病毒通过诱导趋化因子使“冷”肿瘤变成“热”肿瘤,从而激发局部和系统的抗肿瘤免疫反应。肿瘤微环境中的免疫抑制性因素,如调节T淋巴细胞、白细胞介素-10(interleukin-10,IL-10)和程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)等,可以保护肿瘤逃逸机体免疫。而溶瘤病毒不仅可以打破肿瘤微环境既有的解剖结构,还能破坏肿瘤抑制性微环境,使其状态由免疫抑制变成免疫激活[16]。溶瘤病毒感染肿瘤细胞后,细胞裂解死亡并释放肿瘤相关抗原,进而激活树突状细胞,增加细胞毒性T淋巴细胞的浸润以及其他免疫相关分子的募集,肿瘤特异性免疫反应增加,导致远处和未感染的肿瘤细胞被清除[17]。有研究[18-20]显示,溶瘤病毒可通过诱导肿瘤细胞表达或释放钙网蛋白、热激蛋白70/90等激起细胞免疫原性的损伤相关分子模式,进而诱导肿瘤细胞发生免疫原性死亡。
1.2.3 抗血管生成
溶瘤病毒可感染和破坏肿瘤血管系统,诱导中性粒细胞内流,导致血管塌陷和肿瘤细胞死亡[21]。
1.2.4 通过基因改造增强溶瘤作用
应用于临床试验的溶瘤病毒多经过基因改造,GM-CSF是最常用的插入基因[7]。
2 溶瘤病毒类药物临床应用的循证医学证据(已获批适应证)
2.1 鼻咽癌
中国一项多中心的Ⅲ期临床研究[2]比较了瘤内注射H101联合化疗与单纯化疗的治疗效果及不良反应,研究共纳入160例头颈、食管鳞癌患者,其中91例为鼻咽癌,所有入选患者均接受化疗,根据患者过去的化疗史,分别选择不同的化疗方案:A化疗方案为顺铂(20 mg/m2,静脉滴注,第1~5天)+5-FU(500 mg/m2,静脉滴注,第1~5天);B化疗方案为多柔比星(50 mg/m2,静脉滴注,第1天)+5-FU(500 mg/m2,静脉滴注,第1~5天)。对于既往未用过A方案或用过A方案有效者则采用A方案化疗,已用过A方案无效者则采用B方案。联合组每人每天瘤内注射5×1011vp的H101,连续注射5 d,观察16 d,共21 d为1个周期,同时按照上述化疗的给药原则分别给予A方案或B方案化疗。所有患者至少接受2个周期的治疗,但不宜超过5个周期。结果显示,从目标病灶看,在符合试验方案并完成试验的123例患者中,H101联合化疗的完全缓解(complete response,CR)率和部分缓解(partial response,PR)率(CR+PR为有效)显著高于单纯化疗组(72.7%vs40.4%),从受试者全身疗效看,联合组的有效率同样显著高于单纯化疗组(71.2%vs35.1%)。试验期间发生的不良反应主要包括发热、注射部位局部反应、流感样症状、白细胞下降、血小板下降、肝肾功能异常、脱发和恶心呕吐等,其中发热、注射部位局部反应和流感样症状的发生与使用H101有关,白细胞下降与H101使用可能相关[2]。
因此,对于常规化疗药物治疗无效的晚期鼻咽癌患者,推荐瘤内注射H101联合顺铂和5-FU化疗方案。
2005年,国家药品监督管理局批准溶瘤腺病毒药物H101联合化疗药物用于治疗晚期鼻咽癌,这也是全球第一个获批具有临床应用适应证的肿瘤溶瘤病毒治疗方案。
2.2 黑色素瘤
一项Ⅲ期临床试验[3]将436例不能通过手术切除的ⅢB~Ⅳ期黑色素瘤患者以2∶1的比例随机分配至瘤灶内注射T-VEC组(n=295)和皮下注射GM-CSF组(n=141),T-VEC初始给药剂量为106pfu/mL,3周后为108pfu/mL,每次注射T-VEC的总体积为4 mL,3周后每2周注射1次;GM-CSF的给药剂量为125 μg/m2,每天1次,连续2周,4周为1个周期;结果显示,病灶内注射T-VEC组患者的持续缓解率(durable response rate,DRR)(16.3%vs2.1%,P<0.001)、客观缓解率(objective response rate,ORR)(26.4%vs5.7%)和中位总生存期(overall survival,OS)(23.3个月vs18.9个月,P=0.051)均高于GM-CSF皮下注射对照组;且T-VEC的疗效在ⅢB期、ⅢC期或Ⅳ期(M1a期)患者和既往未接受过治疗的患者中最为显著;与T-VEC使用相关的常见不良反应为疲劳、寒颤和发热,发生率≥2%的3或4级不良反应为蜂窝织炎(2.1%),无治疗相关致死性不良反应发生。基于上述研究,Harrington等[22]在249例ⅢB期、ⅢC期或Ⅳ期(M1a期)黑色素瘤患者中进行了详细的亚组分析,结果显示,两组不良事件的发生率相似,与GM-CSF组相比,T-VEC组患者的DRR(25.2%vs1.2%,P<0.000 1)和ORR(40.5%vs2.3%;P<0.000 1)更高,T-VEC组中有27例患者出现CR,而GM-CSF组无1例出现CR。
2017 年发表在Cell杂志上的一项Ⅰ期临床试验[23]提出了一种新的联合用药方案,即溶瘤病毒联合程序性死亡[蛋白]-1(programmed death-1,PD-1)抗体派姆单抗(pembrolizumab)治疗晚期黑色素瘤患者,该研究共纳入了21例不能通过手术切除的晚期(ⅢB~Ⅳ期)黑色素瘤患者,在试验的第1天病灶内注射106pfu/mL的T-VEC,在第4周的第1天注射108pfu/mL的T-VEC,随后每2周注射1次,每次注射T-VEC的总体积为4 mL,从第6周的第1天开始,每2周静脉注射200 mg派姆单抗。结果表明,T-VEC联合派姆单抗治疗的耐受性良好,常见不良反应为疲劳、发热和寒颤,未出现剂量限制性毒性,ORR为62%,CR率为33%;患者经联合治疗后CD8+T细胞增加,PD-L1蛋白和IFN-γ表达量升高,提示溶瘤病毒治疗可通过改变肿瘤微环境来提高PD-1抗体的疗效。
一项Ⅱ期临床试验[24]评估了T-VEC联合CTLA-4抑制剂治疗晚期黑色素瘤的安全性和有效性,该研究共纳入198例不能通过手术切除的晚期(ⅢB~Ⅳ期)黑色素瘤患者,随机分配至联合治疗组(T-VEC+伊匹单抗)与伊匹单抗单药治疗组中,联合组第1周开始病灶内注射T-VEC(初始剂量为106pfu/mL,总体积≤4 mL),3周后调整剂量(108pfu/mL,总体积≤4 mL),随后每2周注射1次,第6周开始静脉注射伊匹单抗(3 mg/kg,3周1次),共给药4次;单药治疗组在第1周开始静脉注射伊匹单抗(3 mg/kg,3周1次),给药4次。结果显示,T-VEC和伊匹单抗联合治疗组的ORR高于伊匹单抗单药治疗组(39%vs18%,P=0.002);联合组的反应并不局限于注射病灶;联合组脏器病变减少了52%,单药组减少了23%;常见不良反应包括疲劳(联合组为59%,单药组为42%)、寒颤(联合组为53%,单药组为3%)和腹泻(联合组为42%,单药组为35%);≥3级不良反应的发生率分别为45%和35%,无治疗相关致死性不良反应发生。
因此,对于手术不可切除的晚期黑色素瘤患者,可考虑使用T-VEC进行局部治疗。此外,T-VEC的应用可以增加免疫检查点抑制剂的抗肿瘤活性,在局部治疗的同时,推荐溶瘤病毒联合免疫检查点抑制剂治疗用于晚期恶性黑色素瘤。
2015年美国FDA批准T-VEC用于手术切除后复发的黑色素瘤患者的局部治疗,这也是美国首次批准的肿瘤溶瘤病毒治疗方案。
3 溶瘤病毒类药物其他临床应用的循证医学证据(目前尚未获批适应证的临床研究)
3.1 头颈部鳞状细胞癌
近期一项多中心的Ⅰb期临床试验[4]对T-VEC与派姆单抗联合治疗复发或转移性头颈部鳞状细胞癌(n=36)的有效性及安全性进行研究;T-VEC的初始给药剂量为106pfu/mL,之后每3周给药1次,每次剂量为108pfu/mL,每次病灶内注射T-VEC的总体积为8 mL;派姆单抗在T-VEC之后给药,每3周静脉给药1次,给药剂量为200 mg。结果显示,36例患者中有20例(55.6%)出现了与T-VEC相关的不良反应,常见不良反应有发热、流感样症状、无力、注射部位疼痛等,2例患者(5.6%)分别因T-VEC相关的黏膜出血和肿瘤溃疡而停用T-VEC,1例患者出现剂量限制毒性(致命性动脉出血),除此之外,未发生T-VEC相关致死性不良反应,5例(13.9%)患者确认为CR,10例患者因早期死亡无法评估药物疗效,中位无进展生存期(progression-free survival,PFS)和中位OS分别为3.0和5.8个月,T-VEC与派姆单抗的联合治疗在头颈部鳞状细胞癌中显示出可耐受的安全性,但相比既往的头颈部鳞状细胞癌研究,联合用药的疗效与派姆单抗单药治疗相似。
一项纳入17例头颈部鳞状细胞癌的Ⅰ/Ⅱ期临床试验[14]在试验的第1、22、43和64天瘤内注射T-VEC,并在试验的第1、22和43天接受放化疗(70 Gy/35次+100 mg/m2顺铂),第6~10周后行颈廓清手术。结果显示,患者对T-VEC与放化疗的联合治疗方案耐受性良好,所有患者均实现局部控制,无复发率达76.5%。在为期19~40个月的随访中(中位随访期为29个月),肿瘤特异性生存率为82.4%。此外,在注射和邻近未注射肿瘤中均检测到T-VEC,且T-VEC水平高于其注射剂量,表明T-VEC在局部机体内已有复制,同时提示局部复制与疗效呈正相关。
3.2 肝细胞癌
经动脉化疗栓塞术(transarterial chemoembolization,TACE)是最常用于中晚期肝细胞癌患者的治疗方法。有研究[10]回顾并分析了TACE单用或联合腺病毒H101治疗肝细胞癌的疗效,共纳入175例不能通过手术切除的肝细胞癌患者。TACE操作参考Seldinger方法[25],常规化疗栓塞为给予300 mg卡铂、50 mg表阿霉素和6 mg丝裂霉素,将这些化疗药物与5 mL碘油混合后注入到目标肿瘤所在的肝动脉中。对于接受TACE联合H101治疗的患者,在注射化疗剂之前,将含有1.0×1012vp H101的0.9%NaCl溶液(10 mL)通过导管全部注入供应肿瘤的肝动脉。结果显示,相比单用TACE(n=88),TACE联合H101的治疗方案(n=87)可显著延长患者的OS(12.8个月vs11.6个月,P=0.046)和PFS(10.49个月vs9.72个月,P=0.044),提高患者的CR率(14.8%vs28.7%,P=0.017)并降低疾病进展(progressive disease,PD)率(25.0%vs12.6%,P=0.011),TACE联合H101组发热的患者比例高于TACE组(P=0.023),两组均未出现4级临床毒性或因肝衰竭导致的手术相关死亡(30 d),治疗后1个月内未出现严重并发症或3~4级肝脏毒性。两组治疗相关不良反应的发生率差异无统计学意义(P>0.05)。
4 溶瘤病毒类药物在临床研究中的使用方法
结合各大临床研究的纳入和排除标准[2-3],本共识对溶瘤病毒在临床研究中治疗的适用、慎用或禁用人群归纳如下。
4.1 溶瘤病毒在临床研究中治疗的适用、慎用或禁用人群
4.1.1 适用人群
⑴经影像学、细胞学或病理组织学检查确诊的肿瘤患者。
⑵年龄18~75岁。
⑶当采用瘤内注射时,应有易于通过临床和(或)影像学方法测量的体表转移病灶。
⑷无严重的心、脑、肝、肾、肺等脏器功能损伤。
⑸体力状况0~2级[世界卫生组织(World Health Organization,WHO)分级]或卡氏评分≥70分,且预计生存期>6个月。
⑹无明显的骨髓抑制。
4.1.2 慎用或禁用人群
⑴有同类药物过敏史者。
⑵有恶性血液系统疾病、中枢神经系统恶性肿瘤或合并其他恶性肿瘤者。
⑶哺乳、妊娠期妇女。
⑷有未经控制的活动性感染。
⑸人类免疫缺陷病毒(human immunodeficiency virus,HIV)抗体阳性、患有获得性免疫缺陷病[3]。
⑹重要脏器功能受损或有器官移植史。
⑺4周内接受过抗肿瘤治疗或使用过免疫抑制剂和正在使用抗病毒药物者。
4.2 溶瘤病毒的给药途径和使用剂量
4.2.1 给药途径
溶瘤病毒的给药途径通常因病毒类型、肿瘤部位和治疗目的不同而有所差异,主要包括瘤内注射和静脉内注射[7]。瘤内注射是最常用的给药方式,已有多项Ⅲ期临床试验的安全性证据[2-3],但该方法操作较为复杂,且仅限于通过临床触诊或直接显像可达的肿瘤[8]。静脉内注射溶瘤病毒相对少见,对于转移性肿瘤患者[26]或对血清中的抗体有抵抗力的溶瘤病毒[27],静脉注射是一种有潜力的给药方式,但该方法的不足之处在于,溶瘤病毒经过血液稀释和血清中抗体中和杀伤,其在肿瘤组织中较难达到有效浓度,静脉内注射还可能引起全身扩散,引发严重感染。一项分析溶瘤病毒有效性和安全性的meta分析[28]发现,瘤内注射的给药方式对疗效有显著改善(P=0.000 2),而静脉注射无显著改善(P=0.99)。因此,对于临床触诊或直接显像可触及的肿瘤,本共识建议采用瘤内注射。
4.2.2 使用剂量
目前,关于溶瘤病毒使用剂量与体内复制潜能及治疗效果的相关性资料很少。与常规的治疗药物不同,溶瘤病毒可以在肿瘤组织内复制,在没有被免疫系统迅速清除的前提下,即使是小剂量也可能引起显著的临床活性[3]。本共识建议根据肿瘤体积大小及病灶数量,参考相关产品的说明书和临床证据决定使用剂量(表2)。
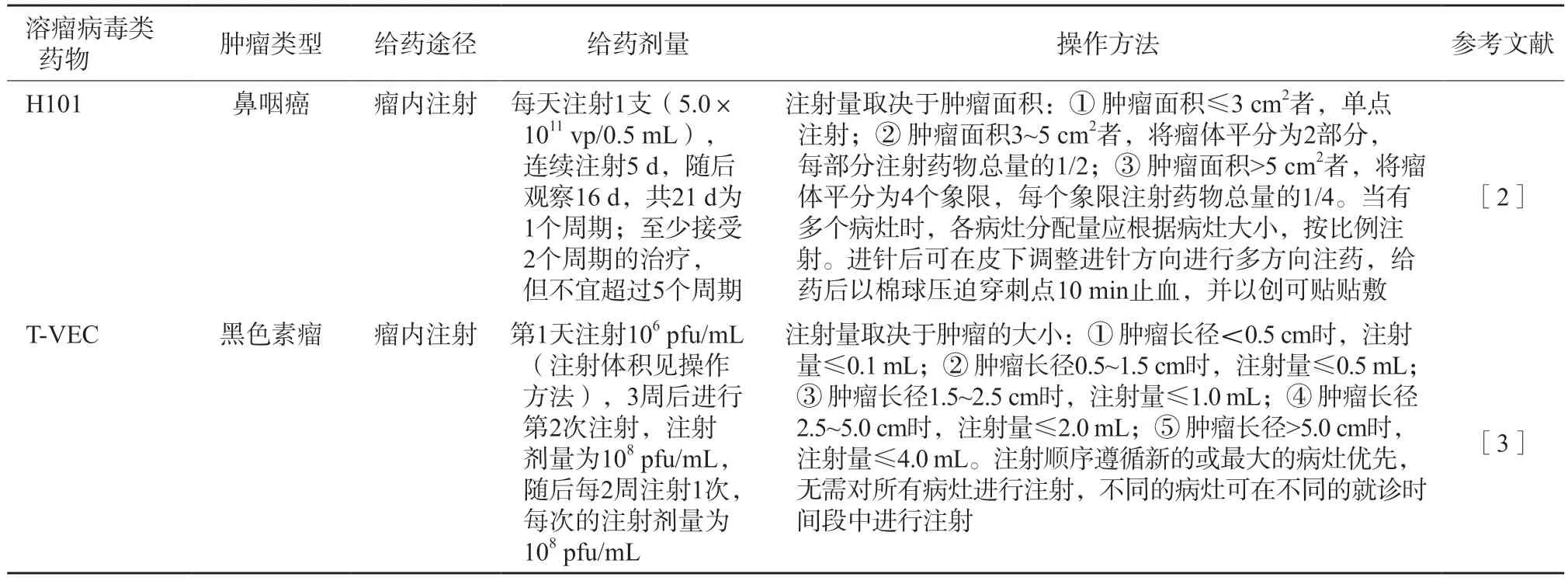
表2 H101和T-VEC的使用方法
4.3 不良反应的管理
溶瘤病毒局部给药一般耐受性良好,常见不良反应是流感样症状和注射部位局部反应[7]。其中流感样症状常表现为体温升高、肌痛、疲劳、恶心、腹泻、呕吐、头痛等,一般在停药一段时间后无需任何处理即可缓解,个别因无法耐受或体温升高较明显的患者在接受对症处理后,体温可恢复正常[3,29]。局部反应常表现为疼痛、皮疹、红斑、外周水肿等,多数患者可自愈[16,30]。此外,在使用呼肠孤病毒、HSV-1和腺病毒等溶瘤病毒治疗的试验中有出现贫血、白细胞减少、淋巴细胞减少、中性粒细胞减少、血小板减少、肝功能障碍和血液学异常等不良反应[31-33]。
在使用溶瘤病毒类药物进行治疗前,采取一些预防措施可防止患者发生严重不良事件,如治疗前患者大量饮水或灌注0.9%NaCl溶液可成功预防低血压[34-35]。在治疗前给予醋氨酚可减少流感样症状的发生[35]。如果患者出现持续的流感样症状或注射部位延迟愈合或其他严重不良反应,临床医师应对治疗的风险和益处进行充分权衡后考虑是否继续使用溶瘤病毒类药物。
4.4 储存、运输和防护方法
目前关于溶瘤病毒的生物安全性还没有普遍接受的统一标准。因此,在使用溶瘤病毒的过程中,需要注意溶瘤病毒的安全储存、运输以及患者和医护人员的防护教育和不良反应的管理[8]。
溶瘤病毒应低温冷藏,H101储存温度为-20 ℃,T-VEC储存温度为-70 ℃,其中T-VEC应避光保存。在给药前5 min,应先将溶瘤病毒类药物置于室温下解冻,使用过程中避免反复冻融或室温下放置过久而导致药效下降。
免疫功能不全、哺乳期或妊娠期妇女、未经控制的活动性感染者应避免使用或接触溶瘤病毒[8],有生育意愿的女性患者在使用溶瘤病毒治疗时应采用有效的避孕方法。
医师应提醒医护人员和密切接触者避免直接接触患者的注射性病灶、敷料和体液,在准备和注射时,医护人员应穿戴必要的个人防护装备(如工作服、安全眼镜、口罩和手套)。如果发生意外接触,如不慎溅到眼睛或黏膜,应立即使用清水反复冲洗。如果接触皮肤,应立即用清水和(或)75%乙醇溶液彻底清洗污染区域。所有使用过的注射器等废弃物需经消毒处理后才可废弃。此外,应提醒患者不要接触或抓挠注射部位,每次注射后需用敷料覆盖注射部位,如果注射部位有液体渗出,则需延长覆盖时间。如果敷料脱落,需及时更换新的敷料。
5 溶瘤病毒类药物的疗效评估
目前临床常用的抗肿瘤药物疗效评价标准包括传统的WHO标准、实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)和在此基础上发展出的改良的RECIST(modified RECIST,mRECIST)(表3)。其中WHO标准通过比较治疗前后肿瘤的双径乘积来判断疗效[36],该标准虽然简单易行,但难以准确评价一些数目较多且直径较小的肿瘤病灶,且随着螺旋CT、磁共振成像(magnetic resonance imaging,MRI)及正电子发射计算机体层显像(positron emission tomography and computed tomography,PET/CT)等影像学技术的出现,WHO标准已逐渐被新的诊断标准所取代[37]。RECIST 1.1是国际公认的恶性肿瘤疗效评估准则,它以肿瘤最大径作为肿瘤测量指标,与WHO标准相比,RECIST对肿瘤疗效的评估更为全面准确。但RECIST未考虑肿瘤坏死现象,不能准确地反映患者在生存期和生活质量方面的获益情况。mRECIST提出测量增强CT或MRI动脉期强化的活性肿瘤最长径来评估疗效,这一改进为引起肿瘤坏死而非肿瘤缩小的治疗方法提供了更为客观真实的评价方法。有研究[38]通过使用化疗栓塞的治疗方法,比较WHO标准、RECIST、欧洲肝病学会标准和mRECIST对肝细胞癌疗效的评价效果,结果显示,相比于WHO标准和RECIST,mRECIST对患者生存方面的预测结果更佳。
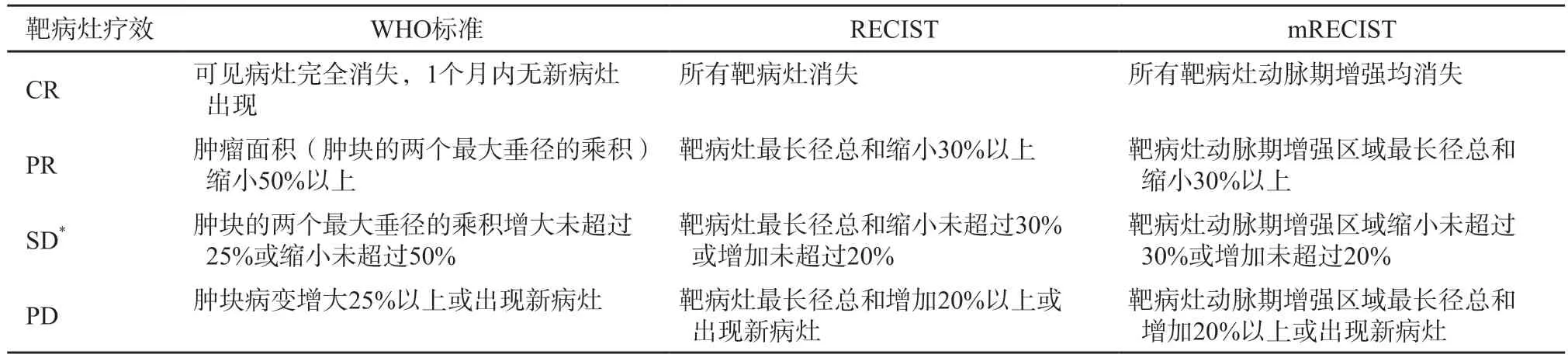
表3 WHO标准、RECIST和mRECIST
此外,溶瘤病毒在靶病灶中的复制和传播能力是其发挥疗效的基础,考虑到溶瘤病毒特殊的药理学特点,为确保安全性并验证其是否引起机体免疫反应,建议在具备条件的医疗机构收集患者的肿瘤活检样本以及患者的血液、唾液和尿液等对目标组织和非目标组织中的病毒滴度、免疫相关因子等进行检测,以提供溶瘤病毒类药物在目标细胞中复制且未感染非目标组织、并能引起机体免疫反应和在体液中脱落的证据[8]。
6 展望与总结
作为一种新兴的肿瘤生物免疫治疗方法,溶瘤病毒已被中国及多个欧美国家的监管机构批准使用。溶瘤病毒通过多种机制杀死癌细胞。已有的大量临床研究证实其具有良好的临床安全用药记录,其对肿瘤细胞的感染增强了机体抗肿瘤免疫反应,并可产生较为持久的反应,溶瘤病毒与化疗、放疗、靶向治疗特别是免疫治疗相结合,可以提高原有药物的疗效。但肿瘤微环境中的系统和物理屏障目前仍然是影响溶瘤病毒临床疗效的主要障碍,这也是其未来基础与临床研究的焦点。相信随着未来研究的进展,会有更多的肿瘤患者从溶瘤病毒类药物治疗中获益。

