湖南省某专科医院非结核分枝杆菌临床分离株菌种鉴定及药敏结果
陈振华,胡培磊,易松林,张小萍,段 洁,刘昭国,谭云洪
(湖南省胸科医院检验科,湖南 长沙 410013)
非结核分枝杆菌(non-tuberculous mycobacteria,NTM)是一种条件致病菌,对人的致病程度较结核分枝杆菌(Mycobacteriumtuberculosis,MTB)弱,但能引起多种疾病[1-2]。近年来,世界范围内 NTM 感染并致病呈上升趋势,既有医源性NTM感染的暴发流行,也有散发性NTM病,如NTM肺病(NTMPD)、NTM皮肤感染和可播散性NTM疾病,许多国家均有报道[1-4]。NTMPD的发病率逐年上升,其临床症状、X线表现与肺结核相似,但治疗方案差别明显,临床上多造成误诊、误治,使得患者病程迁延。人们对NTMPD的认识不断加深,NTMPD诊治上的困难及其带来的危害已引起临床医生的高度重视[2,5-7]。本研究对2017—2019年湖南省胸科医院培养分离的分枝杆菌临床株进行菌种鉴定,并对其中部分脓肿分枝杆菌进行药敏试验测试,分析NTM菌种分布及耐药性,旨在为临床诊治NTMPD提供依据。
1 对象与方法
1.1 菌株来源 2017—2019年湖南省胸科医院经BACTEC MGIT 960 System(简称MGIT 960)培养阳性的10 443株非重复分枝杆菌临床分离菌株。
1.2 主要试剂与仪器 罗氏(L-J)培养基 、对硝基苯甲酸(PNB)培养基及噻吩-2-羧酸肼(TCH)培养基购于珠海贝索生物技术公司,MPB64抗原检测试剂盒(胶体金法)购自杭州创新生物检控技术公司。lab-aid 824核酸提取仪及其配套试剂购于厦门致善生物科技公司。PCR反应试剂购于北京全式金生物技术公司,引物由北京睿博兴科生物技术有限公司合成。PCR扩增仪购自杭州博日科技公司。快速生长分枝杆菌(rapidly growing mycobacteria,RGM)药敏板购于赛默飞世尔科技公司。
1.3 标准质控菌株 MTB对照标准菌株H37RV由国家结核病参比实验室提供,药敏质控菌株金黄色葡萄球菌ATCC 29213、铜绿假单胞菌 ATCC 27853 购于卫生部临床检验中心。
1.4 研究方法
1.4.1 分枝杆菌鉴定 MGIT 960培养报阳性菌株经抗酸染色涂片、结核分枝杆菌抗原MPB64检测、PNB培养基生长试验、TCH培养基生长试验,鉴定出结核分枝杆菌复合群(Mycobacteriumtuberculosiscomplex, MTBC)和NTM,试验操作及判读标准均参照《结核病实验室检验规程》[8]进行。见表1。
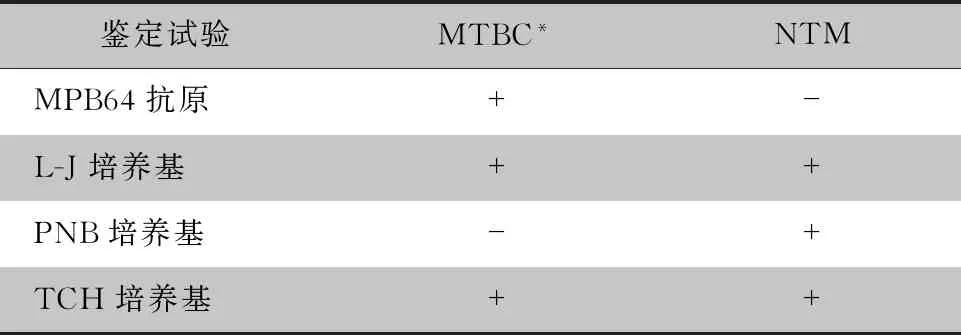
表1 分枝杆菌鉴定试验 MTBC和NTM判断标准Table 1 Judgement criteria of MTBC and NTM in Mycobacterium identification testing
1.4.2 NTM菌种鉴定
1.4.2.1 DNA提取 初步鉴定为NTM后,从L-J固体培养基斜面上刮取2接种环菌落重悬于生理盐水中,使用lab-aid 824仪器提取DNA,上清用作基因测序模板液,-20℃保存备用。
1.4.2.2 聚合酶链反应(PCR) 采用16S rRNA、Hsp65、内转录间隔区(internal transcribed spacer, ITS)三对引物扩增,16S rRNA上游引物为5’-AGAGTTTGATCCTGGCTCAG-3’,下游引物为:5’-TACGGCTACCTTGTTACGACTT-3’;Hsp65上游引物为5’-ACCAACGATGGTGTGTCCAT’,下游引物为5’-CTTGTCGAACCGCATACCCT-3’;ITS上游引物为5’-AAGTCGTAACAAGGTARCCG-3’,下游引物为5’- TCGCCAAGGCATCCACC-3’。16S rRNA产物1 500 bp,Hsp65产物400 bp,ITS产物380 bp。PCR反应体系30 μL:上下游引物各1 μL,2×Tag PCR Master Mix 15 μL,ddH2O 12 μL,DNA模板1 μL,同时取两管PCR反应管分别加入结核分枝杆菌阳性质控品和结核分枝杆菌阴性质控品。按如下程序扩增:94℃预变性5 min;94℃变性30 s,57℃退火30 s,72℃延伸90 s,共25个循环;72℃终延伸7 min。取5 μL扩增产物在1%琼脂糖(含GelRed核酸染料)凝胶中电泳,观察结果。
1.4.2.3 测序及同源性比对 PCR扩增产物送北京睿博兴科生物技术有限公司进行测序,利用BLAST软件将测序得到的基因序列与美国国立生物技术信息中心(NCBI)网站(https://blast. ncbi.nlm.nih.gov/Blast.cgi)作同源性比较,相似度≥97%即可确定菌种。
1.4.3 药敏试验 参照美国临床实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)《M24-A2指南》标准[9],采用RGM药敏板检测脓肿分枝杆菌10种抗菌药物的MIC值,操作和结果判断参照《M24-A2指南》和试剂盒说明书进行。
1.5 统计学分析 应用Excle 2016软件对资料进行统计分析。
2 结果
2.1 分枝杆菌鉴定结果 2017—2019年,MGIT 960培养报阳性的菌株数分别为3 342、3 535、3 566株,从中分别分离出NTM 371、403、453株,各年度检出率分别为11.1%、11.4%、12.7%;共分离NTM 1 227株,总检出率为11.7%。
2.2 NTM菌种鉴定结果 1 227株NTM中,经测序进行菌种鉴定,剔除测序失败的菌株,最终有1 189株确定菌种,居前四位的菌种分别是胞内分枝杆菌(27.8%)、脓肿分枝杆菌(25.3%)、戈登分枝杆菌(16.5%)、鸟分枝杆菌(16.1%)。见表2。
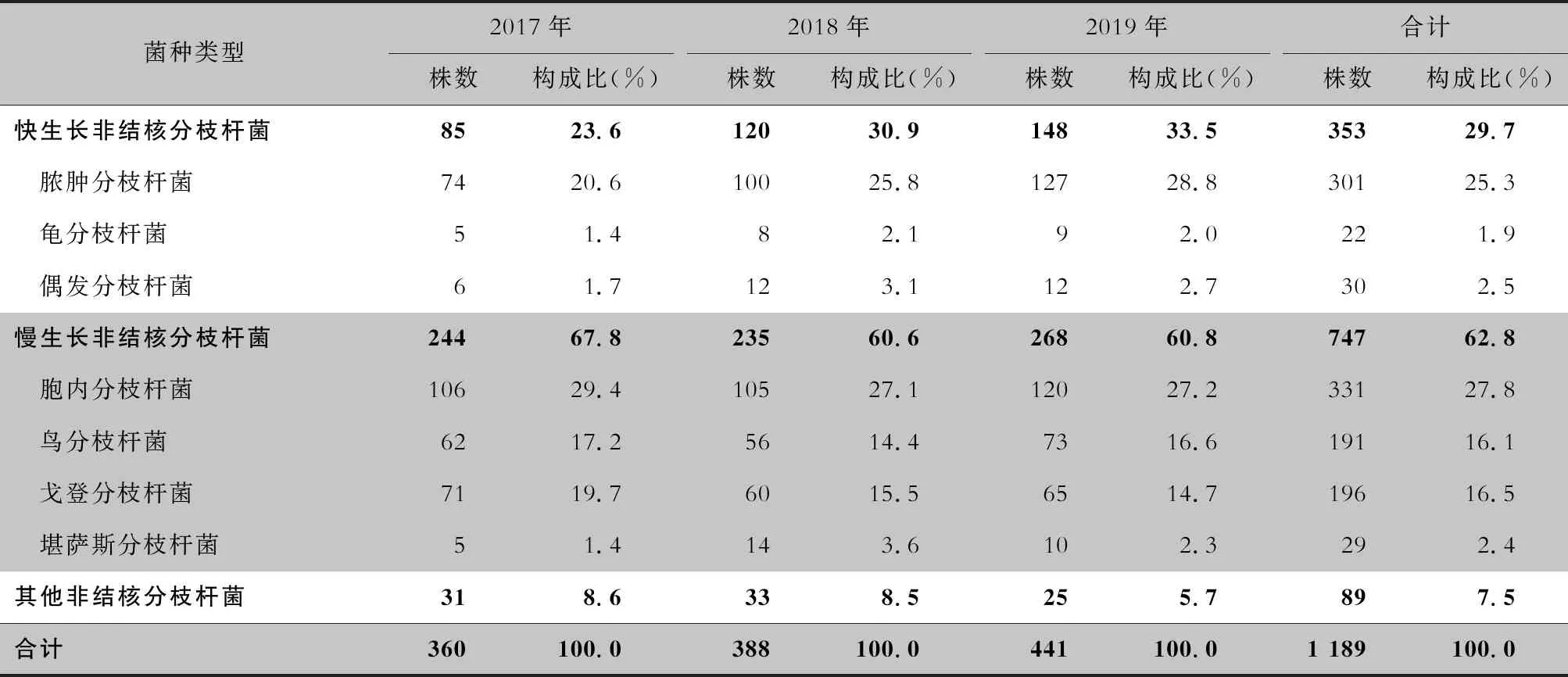
表2 2017—2019年湖南省胸科医院NTM菌种分布情况Table 2 Distribution of NTM species in Hunan Chest Hospital from 2017 to 2019
2.3 NTM药敏试验结果 因条件限制,只对临床诊断为NTMPD且病原菌为脓肿分枝杆菌的部分菌株的进行了药敏试验。结果显示,56株脓肿分枝杆菌对阿米卡星、克拉霉素和利奈唑胺的敏感性较高,敏感率分别为94.6%、87.5%、82.1%,对其他药物的敏感率均低于50%。见表3。
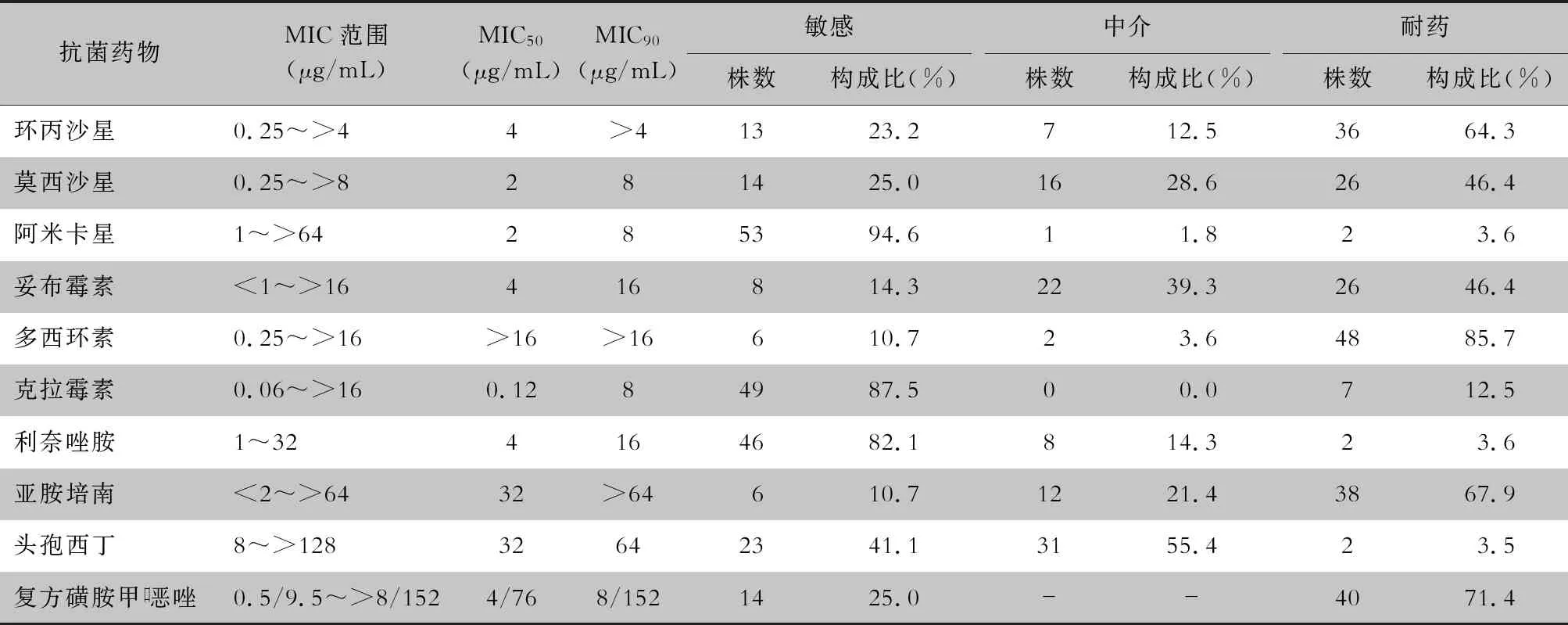
表3 56株脓肿分枝杆菌对10种抗菌药物的药敏结果Table 3 Antimicrobial susceptibility testing result of 56 strains of Mycobacterium abscessus to 10 kinds of antimicrobial agents
3 讨论
我国历次全国结核病流行病学调查[10]结果显示,NTM的检出率持续增高。本研究结果显示,2017—2019年该院NTM检出率为11.7%,检出率有逐年上升趋势,与其他国家报道[4,11]结果一致。可能原因是临床实验室检验能力不断提升,尤其是免疫和分子生物技术的发展使更多的NTM被分离、鉴定出来;随着老年人、慢性阻塞性肺疾病、恶性肿瘤、免疫抑制剂使用增多等导致NTM感染的人数越来越多[12]。
由于NTM病与结核病有相似的临床症状,鉴别诊断困难[7,13]。NTM致病菌菌种繁多,不同菌种与疾病的相关性不同,不同菌种对抗菌药物的敏感性也不同,增加了治疗的难度[2,5,7],准确地菌种鉴定是临床正确诊断、有效治疗的前提。本研究通过联合分析16SrRNA、Hsp65、ITS同源序列组成差异,将NTM鉴定至种水平,结果显示临床分离的RGM主要是脓肿分枝杆菌,慢生长分枝杆菌(slowly growing mycobacteria, SGM)主要是胞内分枝杆菌和鸟分枝杆菌。不同类型的临床标本虽然都可分离获得NTM,但以痰、支气管肺泡灌洗液、肺活检组织获得NTM培养阳性的可能性最大[14-15]。肺部NTM感染最常见的菌种是鸟-胞内分枝杆菌复合体(Mycobacterium avium-intracellulare complex,MAC)、脓肿分枝杆菌、堪萨斯分枝杆菌和蟾蜍分枝杆菌。该院为结核病专科医院,大部分患者有肺部疾病,且送检标本以痰居多,因此,该院分离的NTM也是以MAC和脓肿分枝杆菌为主,分布情况与国内外报道结果基本相符,但在NTM菌种组成、构成比上仍存在差异[4,16-18],进一步证实NTM种属分布常具有地域特点,不同国家及不同地区菌种构成不同。2017—2019年该院检出的NTM中,RGM检出率逐年上升,尤其是脓肿分枝杆菌上升较快,可能与该院大部分就诊患者有肺部疾病,而脓肿分枝杆菌主要侵犯人体肺有关[1]。一般认为,临床标本分离出戈登分枝杆菌很可能是标本被污染且不致病[2],本研究分离的戈登分枝杆菌占比较高,是标本污染菌还是病原菌,需进一步深入研究确定。

本研究存在一定的局限性:目前赛默飞世尔科技公司生产的药敏板只适于RGM药敏检测,所以,本研究未获得湖南省SGM的药敏结果;另外,RGM药敏板2018年10月才获得国家药品监督管理局批准,本实验室2019年开展RGM药敏检测,本研究的脓肿分枝杆菌数量少,药敏结果可能存在偏倚,后续研究应增加菌株数,检测其对10种抗菌药物药敏情况。

