消化道肿瘤手术患者术中低体温影响因素分析
罗梦佳, 戴艳然, 郎红娟, 丰 帆
(1. 中国人民解放军空军军医大学第一附属医院 胃肠外科, 陕西 西安, 710032;2. 中国人民解放军空军军医大学 护理系, 陕西 西安, 710032)
目前,体温监测已成为患者围术期生命体征监测的重要部分,并于2015年被世界卫生组织(WH0)列入手术安全核查表中[1]。围术期非计划性低体温(IPH)是指围术期由各种原因导致的机体核心体温低于36.0 ℃[2]。IPH可以诱发不良心血管事件,导致术中出血量增加,增大手术风险,此外还会延长术后苏醒时间及药物代谢时间,诱发寒战等不良反应,严重影响手术效果[3]。围术期低体温的发生率较高, 2015年北京地区报道的发生率为39.9%, 2017年全国部分地区横断面调查报道的发生率为44.5%[4]。消化道肿瘤患者由于平均年龄较大,长期营养不良,术前禁食、水,以及手术时间长、创伤大、使用麻醉药物等,术中极易发生低体温。本研究分析了消化道肿瘤手术患者术中发生低体温的影响因素,旨在提前做好针对性预防措施,从而减少术中及术后并发症的发生。
1 资料与方法
1.1 一般资料
回顾性分析2019年6—9月空军军医大学第一附属医院胃肠外科收治的500例消化道肿瘤根治术患者的临床资料。500例患者中,男344例,女156例; 年龄20~85岁,平均(59.6±11.3)岁; 体质量指数(BMI)14.6~35.0 kg/m2, 平均(23.1±3.1) kg/m2; 肿瘤类型为食管癌17例、胃癌274例、结肠癌107例、直肠癌102例; 手术方式为开腹手术280例(56.0%)、腹腔镜手术220例(44.0%); 术前体温35.4~37.6 ℃, 平均(36.5±0.3) ℃。纳入标准: ① 确诊消化道肿瘤患者; ② 全身麻醉下完成手术,相关资料完整者; ③ 手术预计时间>1 h者; ④ 术中需留置导尿管者。排除标准: ① 存在严重并发症(如出血、穿孔)者; ② 行肿瘤姑息性切除者; ③ 术前体温>38.0 ℃或<35.0 ℃者。
1.2 方法
手术室护士提前将手术室温度调至22.0~25.0 ℃, 湿度调至40.0%~60.0%, 待患者入室后,予以常规保温措施,加盖棉被,放置护肩棉垫,静脉输入等体温的液体。待患者全身麻醉后,插入14号测温导尿管,利用导尿管内置体温传感探头术中连续监测患者膀胱温度并作为中心体温[5]。巡回护士记录手术切皮前、手术1 h时以及手术结束时的3次体温,并收集患者年龄、性别、BMI、吸烟史、美国麻醉医师协会(ASA)评分、血红蛋白水平、白蛋白水平、血糖水平、手术时间、肿瘤类型、是否使用腹腔镜等基本资料。将患者术中膀胱温度<36 ℃定义为术中低体温。手术结束后将数据录入电脑,并双人核对。
1.3 统计学分析
采用SPSS 25.0统计学软件进行数据分析,计数资料以[n(%)]描述,比较行χ2检验,对术中低体温的影响因素进行单因素分析和多因素分析,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 消化道肿瘤患者术中低体温的单因素分析
将术中发生低体温的160例患者(32.0%)纳入低体温组,将术中未发生低体温的340例患者(68.0%)纳入非低体温组。2组性别、血红蛋白、白蛋白、血糖、吸烟史及ASA评分比较,差异无统计学意义(P>0.05); 2组在年龄、BMI、手术时间、肿瘤类型、手术方式及术前体温方面比较,差异均有统计学意义(P<0.05或P<0.01)。见表1。
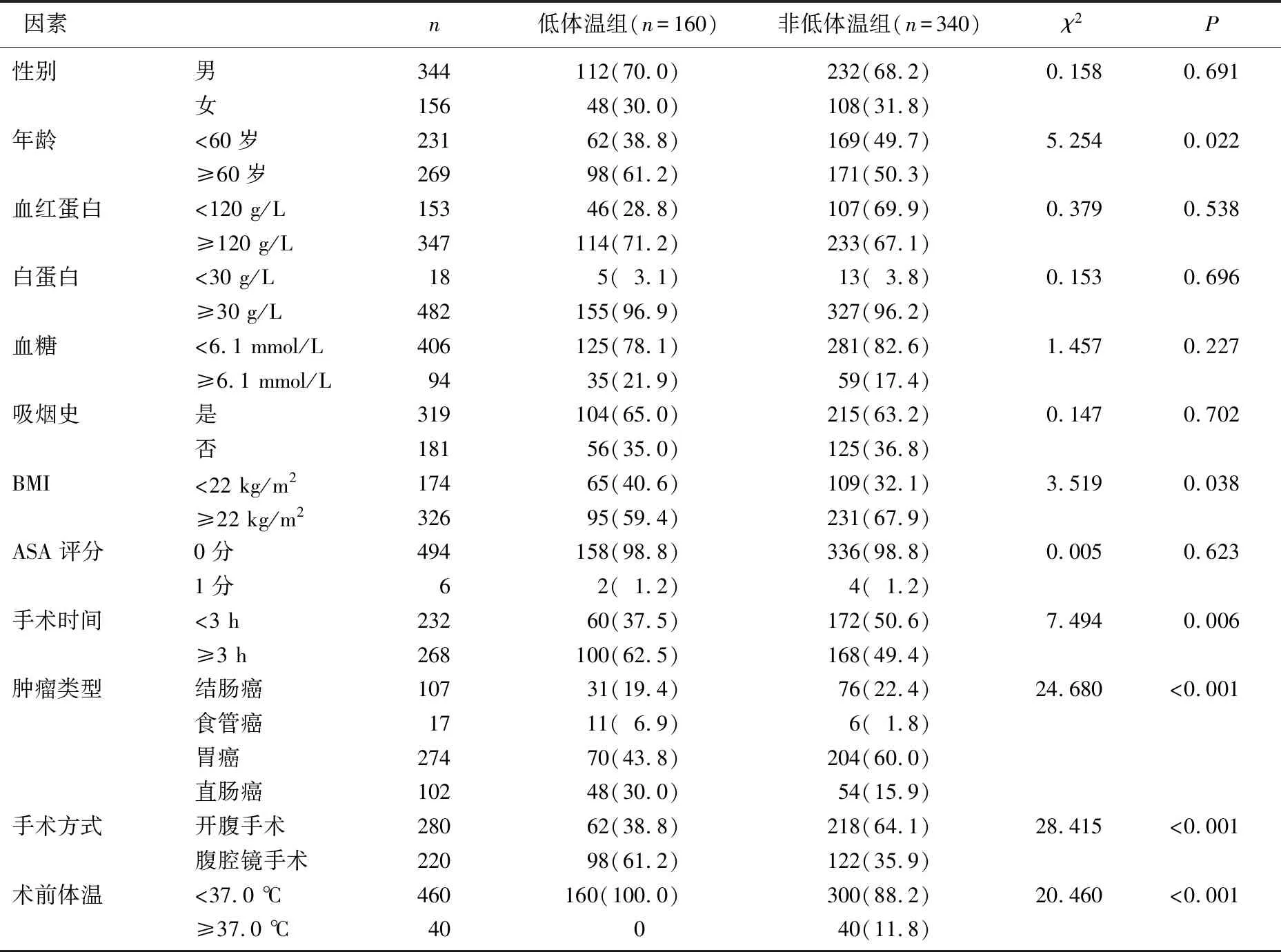
表1 消化道肿瘤患者术中低体温的单因素分析[n(%)]
2.2 消化道肿瘤患者术中低体温的多因素分析
以是否发生术中低体温为因变量,以单因素分析结果中差异有统计学意义的变量作为自变量,进行二元Logistic回归分析,变量进入水平α=0.05, 剔除水平β=0.10。多因素分析结果显示,年龄≥60岁、BMI<22 kg/m2和采用腹腔镜手术方式均是患者发生术中低体温的独立危险因素(P<0.05或P<0.01), 见表2。

表2 消化道肿瘤手术患者术中低体温的多因素Logistic回归分析
3 讨 论
人体核心温度指人体胸腔、腹腔和中枢神经的温度,来源于物质代谢过程释放出来的能量[6]。低体温可导致围术期患者血小板功能和凝血物质活性降低,抑制凝血机制,增加术中输血量,导致患者术后出现多种并发症,还可降低机体对药物的代谢速度,延长排泄时间和麻醉恢复期,抑制免疫系统,增加术后切口感染的发生[7]。消化道肿瘤手术患者均接受全身麻醉,为了确保胃排空来预防麻醉插管时反流误吸,传统择期手术均要求患者术前8~12 h禁食禁饮。为了避免患者因饥饿发生低血糖以及术后胰岛素抵抗,加速康复外科理念推荐患者术前6 h摄入非油炸、淀粉类固体食物,术前2 h摄入非酒精类饮料[8]。但肿瘤患者由于长期慢性消耗、进食障碍等原因而营养不良,故术中低体温的发生率并未显著下降。本研究结果显示, 500例患者术中共发生低体温160例,发生率为32.0%, 低于YI J等[9]的横断面调查结果(44.5%)。分析原因,可能是由地域差异和手术类型、麻醉方式、测温方式不同等造成的。相关报道[10]显示,目前测温探头的插入方法尚无统一标准,很多患者的测温探头并未放置到位,且多中心调查中因操作者不同也会导致放置标准不一致。YI J等[9]研究发现,5.7%的患者采用全身麻醉复合区域神经阻滞,可引起血管扩张,抑制体温调节反射,从而增大低体温发生风险[11], 本研究中患者麻醉方式均采用全身麻醉。
本研究结果显示,年龄≥60岁是术中发生低体温的独立危险因素,与谢言虎等[11]、沈新花等[12]研究结果一致。首先,这可能是由于老年患者机体各项功能下降,术中发生低体温后中枢神经系统反应较慢,无法第一时间得到有效反馈,难以及时完成自身温度调节,最终导致低体温的发生[3]。其次,老年患者自身代谢产热减少,低温时血管收缩阈值下降,导致体表散热增加[13]。此外,老年患者体温调节能力降低,皮下脂肪减少,基础代谢率降低,在手术创伤、麻醉药物和相对低的环境温度等因素作用下,更容易丢失体热造成低体温,且随着年龄的增长,术中低体温患者将需要更长的时间恢复至正常体温[14]。
本研究结果显示, BMI<22 kg/m2是发生术中低体温的独立危险因素,这与陈璋等[15]研究结果一致。陈冬梅等[16]研究发现,低BMI患者复温时间、麻醉清醒时间、自主呼吸恢复时间长,高BMI患者所需时间则短。人体核心温度的变化与机体脂肪作用有关[17],低BMI可反映出患者的肌肉和脂肪组织较少,骨骼肌是人体活动时产能的动力,而脂肪不仅是机体静止时的能量产生组织,还可构成机体隔离层,具有保暖作用[18]。
相较于传统开腹手术腹腔暴露面积大、时间长的特点,腹腔镜手术具有创伤小、恢复快等优点,已被越来越广泛地应用于胃肠道手术中。虽然与开腹手术相比,腹腔镜手术患者的腹腔处于相对封闭状态,但持续的CO2气腹也会带走腹腔部分热量,容易导致术中低体温[19]。本研究结果显示,腹腔镜手术是患者发生术中低体温的独立危险因素,分析原因可能与腹腔镜手术中大量且长期使用CO2气体有关。普鹰等[20]研究结果显示, CO2总量是腹腔镜胃肠道手术患者发生术中低体温的独立影响因素。DEAN M等[21]也指出,在腹腔镜手术中,与注入寒冷、干燥的CO2相比,使用加温、加湿的CO2可显著升高患者术中核心温度(平均温度变化0.3 ℃)。
综上所述,消化道肿瘤手术患者术中低体温的发生率较高,年龄≥60岁、BMI<22 kg/m2以及采用腹腔镜手术方式是消化道肿瘤手术患者发生术中低体温的独立危险因素。对于此类患者,医护人员应增强术中保温意识并给予必要的保温措施,在被动保温的基础上增加主动保温措施,从而避免术中低体温的发生。

