miR-377-5p 通过下调VEGF-C 对结肠癌的血管和淋巴管生成的影响研究
孙 强宋维亮王俊伟程 康
(天津市第三中心医院普外科,天津 300170)
结肠癌是一种高发性的消化道恶性肿瘤,该病主要发生在直肠与乙状结肠交界位置[1]。在全球的恶性肿瘤中,发病率已上升到第三位,死亡率排名第一位,发病人群主要集中在 40 ~50 岁[2]。结肠癌的发生涉及到多种原癌基因和抑癌基因等多个阶段,是多种癌基因相互作用的结果。当原癌基因和抑癌基因的平衡被打破,原癌基因过度表达,而抑癌基因失去活性时,免疫机制无法控制癌细胞的发展而形成癌变[3]。miRNAs 可以通过直接靶向mRNAs 来调节基因的表达,导致其翻译抑制或不稳定性。miR-377 是miRNAs 家族中的重要成员,在多种肿瘤中起着重要的作用。miR-377-5p 属于miR-377 的成熟体,相关研究报道,miR-377-5p 可能具有抑制肝细胞癌的作用,可以降低HepG2 细胞的增殖水平和侵袭能力,进而抑制血管内皮细胞生长因子通路的激活[4]。但miR-377-5p 在结肠癌生长发育中的确切作用尚不清楚。在肿瘤生长过程中,VEGFs 是淋巴管生成和血管生成的关键调节因子,VEGFs 及其受体(VEGFRs)也是淋巴管生成和血管生成信号的病理治疗的主要靶点[5]。VEGF-A 主要调控血管生成,而VEGF-C 调节血管生成和淋巴管生成,VEGF-C 是一种很有前途的调控肿瘤转移和发展的靶点[6],但在结肠癌中的作用和机制尚不清楚。因此,本研究探讨miR-377-5p 通过下调VEGFC 对结肠癌的血管和淋巴管生成的影响。
1 材料和方法
1.1 实验材料
结肠癌细胞株SW620 和人脐静脉内皮细胞HUVECs(中国典型培养物保藏中心);收集2018年5 月到2019 年12 月行手术切除的结肠癌组织标本49 例,所有患者的病例资料完整,术中标本迅速切取癌组织和正常组织,正常组织距离肿瘤边缘10 cm。所有标本放于液态氮中,快速转入实验室,-80℃的冰箱中保存。患者术后病理诊断为原发性结肠癌患者,术前未经过化疗和放疗等治疗,本研究通过天津市第三中心医院医学伦理委员会的批准(20200116),经过患者知情确认。
1.2 主要试剂与仪器
RPMI-1640 和胎牛血清(长沙艾佳生物技术有限公司);TRIzol 试剂(上海吉凯生物公司);反转录试剂盒、RIPA 裂解液、磷酸盐缓冲液(江苏碧云天生物科技研究所);DAB 试剂盒、胎牛血清、羊抗兔二抗(浙江天杭生物科技股份有限公司);离心机(德国Sigma 公司);高速冷冻离心机(日本日立公司);JY200C 电泳仪(北京君意东方电泳设备有限公司);倒置相差显微镜(日本Olympus 公司)L-420低速离心机(湘仪实验仪器开发有限公司)。
1.3 实验方法
1.3.1 细胞培养和转染
结肠癌细胞株SW620 放于添加100 U/mL 的青霉素和100 mg/mL 链霉素的10%胎牛血清RPMI-1640 培养基培养,条件为37℃,含5%的CO2的培养箱中培养,当细胞处于对数生长期时用胰酶消化后进行实验。该实验分为3 组,miR-377-5p 干扰组、miR-377-5p 阴性对照组和 miR-377-5p 过表达组。miR-377-5p 干扰组转染miR-377-5p siRNA 干扰表达病毒载体和脂质体,miR-377-5p 阴性对照组加入脂质体,miR-377-5p 过表达组转染miR-377-5p 病毒载体和脂质体,转染成功后,继续培养48 h,进行后续实验检测。
1.3.2 实时荧光 RT-PCR 检测 miR-377-5p mRNA的表达
处理各组的结肠癌细胞株SW620 持续48 h后,进行收集,采用TRIzol 法从细胞中提取总RNA,利用反转录试剂盒从上述RNA 逆转录cDNA,最后利用miR-377-5p 引物和GAPDH 引物在应用生物系统7500 实时PCR 系统上进行了实时qPCR,反应条件90℃ 预变性 6 min;85℃变性 30 s,50℃ 退火15 s,45℃ 延伸20 s,共设置50 个循环。PDL1 引物序列为:5′-GTGCTCGCTTCGGCAGCACAT-3′(上游)和 5′-TACCTTGCGAAGTGCTTAAAC-3′ ( 下 游 )。GAPDH 引物序列为:5′-TCCAGCTGGGUCACACU-3′(上游) 和 5′-GTCGGCAATTCAGTTGAGTTG-3′(下游)。
1.3.3 Western blot 检测miR-377-5p 的蛋白表达
处理各组的结肠癌细胞株SW620 持续48 h后,进行收集,通过加入RIPA 裂解缓冲液进行裂解,用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,然后转移到聚偏二氟乙烯(PVDF)膜上。PVDF 膜被特定的初级抗体孵育miR-377-5p、VEGF-A、VEGF-C、 P-Akt、VEGFR-3 和GADPH 在4°C,在放入5%脱脂牛奶在室温下孵育1.5 h。24 h 后的孵化一抗,使用 PBS 膜清洗 3 次,二抗孵育 miR-377-5p、VEGF-A、VEGF-C、 P-Akt、VEGFR-3 和 GADPH 室温 2 h,用 BCA 蛋白检测试剂盒测定蛋白浓度。
1.3.4 CCK-8 法检测细胞增殖
取各组对数生长期的结肠癌细胞株SW620 接种在 96 孔板中,在 24 h、48 h、72 h 替换原培养基一次,加入CCK-8 溶液之前以每孔200 μL 不含药物的无血清培养基取代原培养液,再加入浓度为5 g/L的 CCK-8 溶液 20 μL,孵育 4 h。酶标仪参数设置为450 nm,检测各孔的光密度值。
1.3.5 流式细胞法检测细胞凋亡
取各组对数生长期的结肠癌细胞株SW620,用胰酶消化,接种于6 孔培养板中,放在37℃的CO2培养箱中培养,24 h 后收集细胞,调整细胞浓度,PBS 洗涤,离心处理,4℃,2000 r/min 离心 20 min,弃上清。加入 5 μL Annexin V-FITC,摇匀,避光孵育10 min,1 h 后检查细胞的凋亡率。应用计算机WinMDI 软件分析,得出细胞的凋亡情况。
1.3.6 细胞划痕实验检测细胞迁移
取各组对数生长期的结肠癌细胞株SW620 接种6 孔板中,用200 μL 黄枪头的枪尖在6 孔板中间位置,划出一条贯穿培养孔的划痕,需要各孔的划痕一致,去培养液,PBS 漂洗3 次,在培养48 h,弃悬浮细胞,对各孔进行拍照,观察划痕附近的细胞迁移情况。
1.3.7 Transwell 法检测细胞侵袭
将transwell 小室取出,弃液体,PBS 漂洗5 min,再用4%多聚甲醛固定15 min,在胎牛血清的RPMI-1640 培养基中培养 24 h,将 100 μL 细胞 (1×105/mL) 的接种24 孔板中,然后放入600 μL 含有20%FBS 的RPMI-1640,在37℃的 浓度为5%的 CO2培养箱中孵育,用棉签轻轻擦去上室未迁移的细胞或未侵袭的细胞,迁移的细胞或入侵细胞用70%甲醛溶液固定30 min, 并使用0.1%的结晶紫染色20 min,使用显微镜捕获每个孔中迁移或侵袭的细胞的图像。
1.3.8 血管生成实验检测血管和淋巴管生成
通过血管生成实验检测HUVECs 在基质凝胶上形成毛细血管的能力,转染的HUVECs 克隆细胞放入0.2%的BSA 补充的内皮基培养基中孵育24 h。随后,收集 8×104HUVECs,接种 12 孔基底膜基质水凝胶基质板上。孵育8 h 后,用显微镜观察血管生成。用Leica LAS 软件在10 个随机选择的视场(放大倍率×100)中拍摄毛细血管的形态学图像,并在3 个摄影视场中计数毛细血管。
1.4 统计学方法
采用SPSS 21.0 对计数资料进行统计分析,结果以平均数±标准差(±s)表示,多组间采用单因素方差分析,组间的两两比较采用t检验,组间多重比较采用LSD-t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 miR-377-5p 在结肠癌组织中的表达
与正常结肠组织对比,结肠癌组织中miR-377-5p mRNA 和miR-377-5p 蛋白的表达明显低于正常结肠组织,差异具有统计学意义(均P<0.05)(表1,图1)。
2.2 组间miR-377-5p mRNA 及蛋白的表达
与miR-377-5p 干扰组相比,miR-377-5p 阴性对照组和miR-377-5p 过表达组中的mRNA 及蛋白显著升高(均P<0.05),与miR-377-5p 阴性对照组相比,miR-377-5p 过表达组的mRNA 及蛋白明显增加(P<0.05)(表2,图2)。
2.3 过表达miR-377-5p 对结肠癌细胞增殖和凋亡的影响
与miR-377-5p 干扰组相比,miR-377-5p 阴性对照组和miR-377-5p 过表达组的结肠癌细胞增殖能力明显降低(P<0.05),与miR-377-5p 阴性对照组相比,miR-377-5p 过表达组的结肠癌细胞增殖能力显著降低(P<0.05)(图3A);与miR-377-5p 干扰组相比,miR-377-5p 阴性对照组和miR-377-5p 过表达组的结肠癌细胞增殖凋亡明显升高(P<0.05),与miR-377-5p 阴性对照组相比,miR-377-5p 过表达组的结肠癌细胞凋亡能力显著升高(P<0.05)(图3B)。
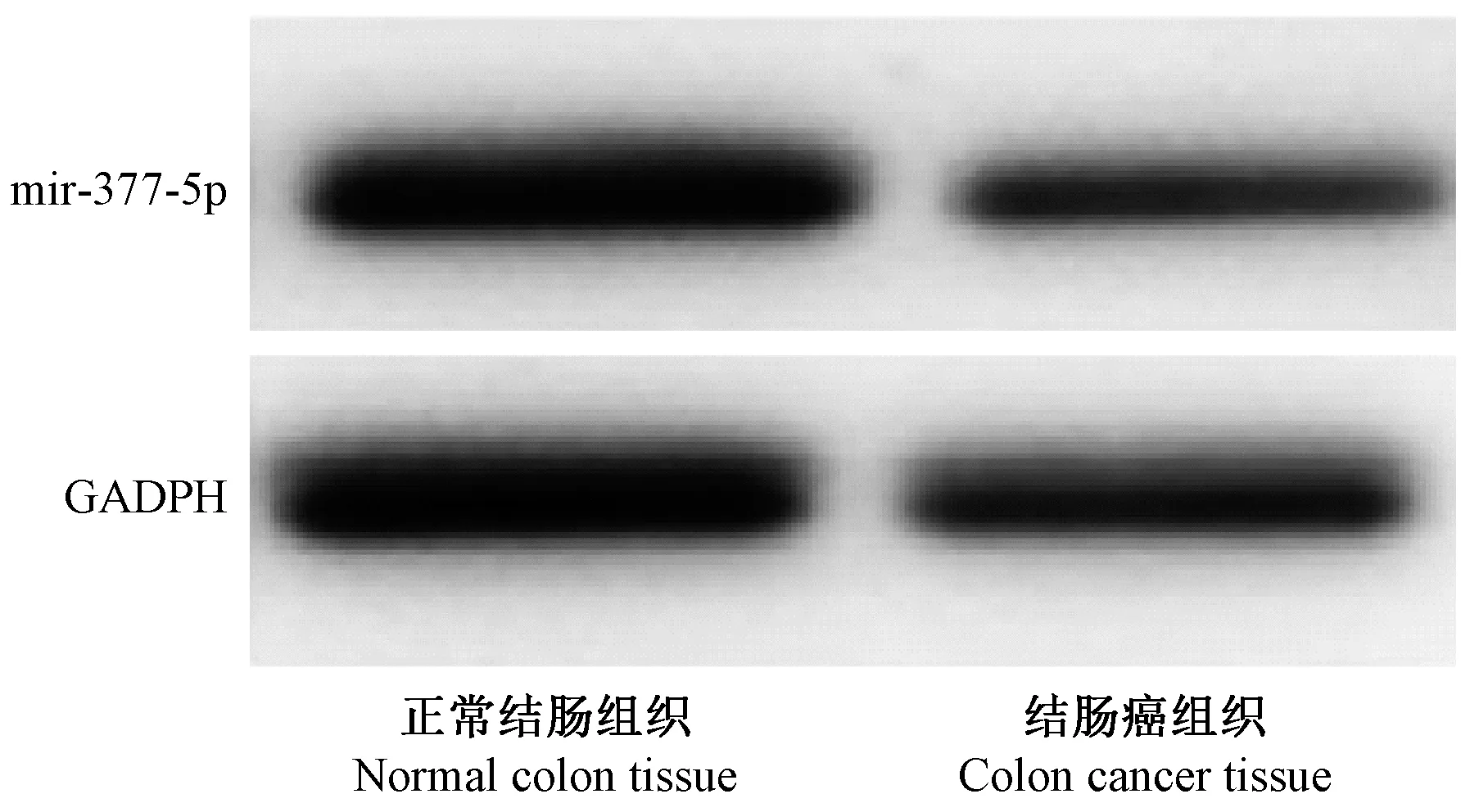
图1 结肠癌组织和正常结肠组织中miR-377-5p蛋白的表达Figure 1 Expression of miR-377-5p in colon cancer and normal colon
2.4 过表达miR-377-5p 对结肠癌细胞迁移和侵袭能力的影响
与miR-377-5p 干扰组和miR-377-5p 阴性对照组相比,miR-377-5p 过表达组的结肠癌细胞的迁移能力和侵袭能力显著降低(P<0.05)(图4A、4B)。
2.5 过表达miR-377-5p 对VEGF-C 和巴管生成的影响
与miR-377-5p 干扰组和miR-377-5p 阴性对照组相比,miR-377-5p 过表达组的 VEGF-A、VEGF-C和P-Akt、VEGFR-3 蛋白水平显著低降低(P<0.05)(图5)。
表1 结肠癌组织和正常结肠组织中miR-377-5p mRNA 及蛋白的表达(±s)Table 1 Expression of mir-377-5p mRNA and protein in colon cancer and normal colon
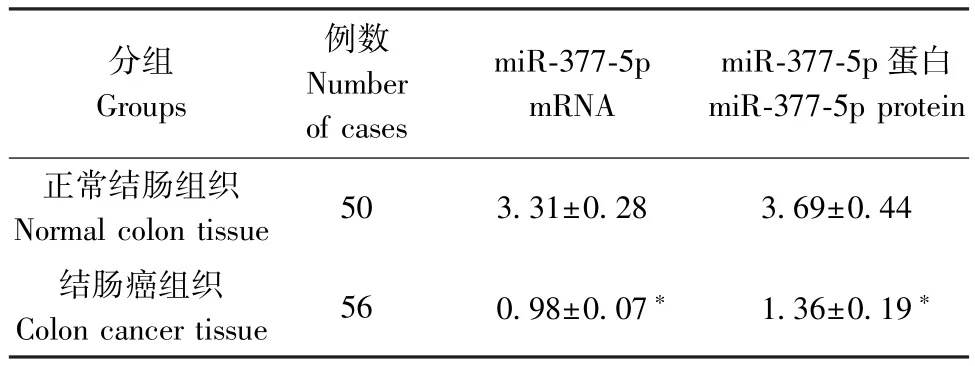
表1 结肠癌组织和正常结肠组织中miR-377-5p mRNA 及蛋白的表达(±s)Table 1 Expression of mir-377-5p mRNA and protein in colon cancer and normal colon
注: 与正常结肠组织相比,∗P<0.05。Note.Compared with normal colon tissue,aP<0.05.
分组Groups例数Number of cases miR-377-5p mRNA miR-377-5p 蛋白miR-377-5p protein正常结肠组织Normal colon tissue 50 3.31±0.28 3.69±0.44结肠癌组织Colon cancer tissue 56 0.98±0.07∗ 1.36±0.19∗
表2 组间miR-377-5p mRNA 及蛋白的表达(±s)Table 2 Expression of mir-377-5p mRNA and protein between groups

表2 组间miR-377-5p mRNA 及蛋白的表达(±s)Table 2 Expression of mir-377-5p mRNA and protein between groups
注: 与miR-377-5p 干扰组相比,∗P<0.05;与 miR-377-5p 阴性对照组相比,#P<0.05。Note.Compared with normal colon tissue,a P<0.05,Compared with mir-377-5p negative control group, #P<0.05.
分组Groups miR-377-5p mRNA miR-377-5p 蛋白miR-377-5p protein miR-377-5p 干扰组miR-377-5p interference group 0.43±0.05 0.52±0.12 miR-377-5p 阴性对照组miR-377-5p negative control group 1.00±0.03∗ 1.29±0.37∗miR-377-5p 过表达组miR-377-5p overexpression group 23.57±8.69∗# 25.78±10.38∗#
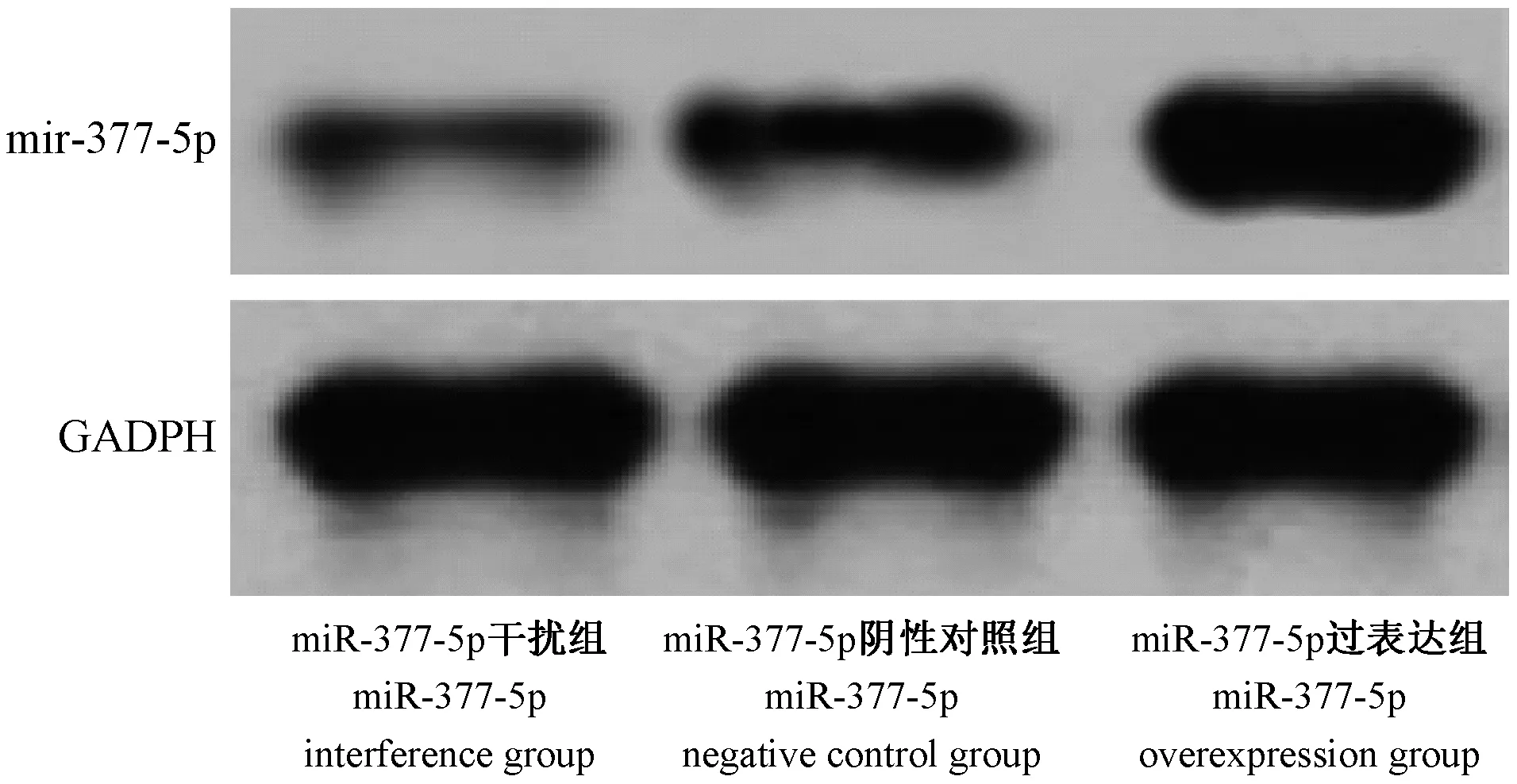
图2 组间miR-377-5p 蛋白的表达Figure 2 Expression of miR-377-5p protein between groups
2.6 过表达miR-377-5p 对血管和淋巴管生成的影响
与miR-377-5p 干扰组和miR-377-5p 阴性对照组相比,miR-377-5p 过表达组的 MVD(微血管密度)和 LMVD(淋巴微血管密度)显著降低(P<0.05)(图6)。

图3 miR-377-5p 过表达对结肠癌细胞增殖和凋亡的影响Figure 3 Effect of miR-377-5p overexpression on proliferation and apoptosis of colon cancer cells
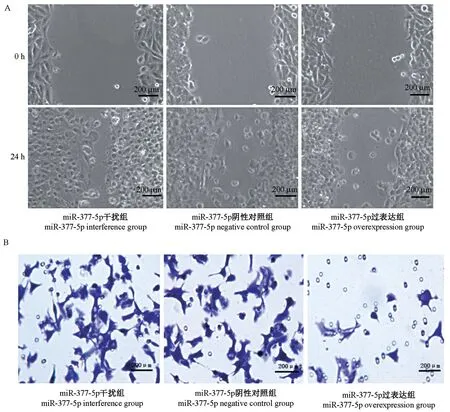
图4 miR-377-5p 过表达对结肠癌细胞迁移和侵袭能力的影响Figure 4 Effect of miR-377-5p overexpression on colon cancer cell migration and invasion ability
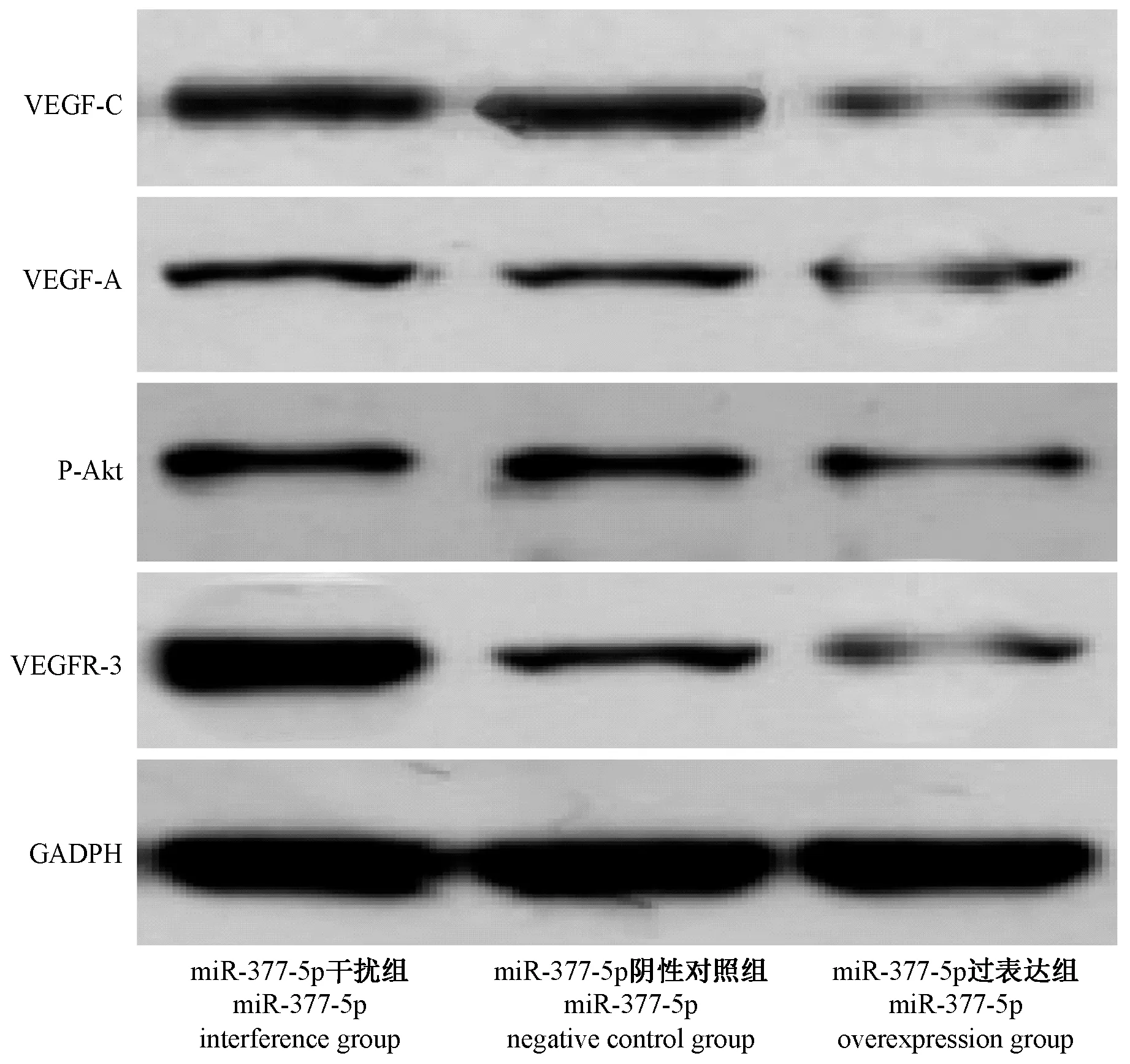
图5 miR-377-5p 过表达对血管内皮生长因子VEGF-C 的影响Figure 5 Effect of miR-377-5p overexpression on vascular endothelial growth factor VEGF-C
3 讨论
结肠癌的发生涉及到多基因和多步骤的复杂过程,大约35%的结肠癌患者与遗传易感性有关[7]。miRNA 通过抑制翻译和诱导mRNA 降解达到抑制靶基因的作用,到目前为止,在人类基因组织中已经发现700 多种miRNAs,miRNA 又能调控30%以上的人类靶基因[8]。多项研究结果表明,miRNA 是调节肿瘤的发生和恶性进展的关键基因和信号通路表达,从而调节肿瘤的表型[9]。miRNA可以调控肿瘤的生长、增殖、迁移和侵袭,在恶性肿瘤的发生和发展过程中发挥着重要的作用。
本研究结果表明,与正常结肠组织对比,结肠癌组织中miR-377-5p mRNA 和miR-377-5p 蛋白的表达明显低于正常结肠组织;与miR-377-5p 干扰组相比,miR-377-5p 阴性对照组和miR-377-5p 过表达组中的mRNA 及蛋白显著升高,与miR-377-5p 阴性对照组相比,miR-377-5p 过表达组的mRNA 及蛋白明显增加。从而说明miR-377-5p 可能是一种有效的结肠癌生物标志物。相关研究表明,miR-377-5p参与调控胃癌细胞的增值和凋亡,在胃癌发生发展过程中发挥重要作用[10]。为了表明miR-377-5p 的作用,本研究在分析中发现miR-377-5p 能够明显抑制结肠癌细胞的增殖、迁移和侵袭,同时也促进细胞凋亡。这些发现表明miR-377-5p 可以抑制结肠癌的发生,可被视为结肠癌的重要诊断生物标志物和有用的治疗靶点。然而,miR-377-5p 的活性也可能影响肿瘤中的其他细胞,如内皮细胞,这需要进一步研究。
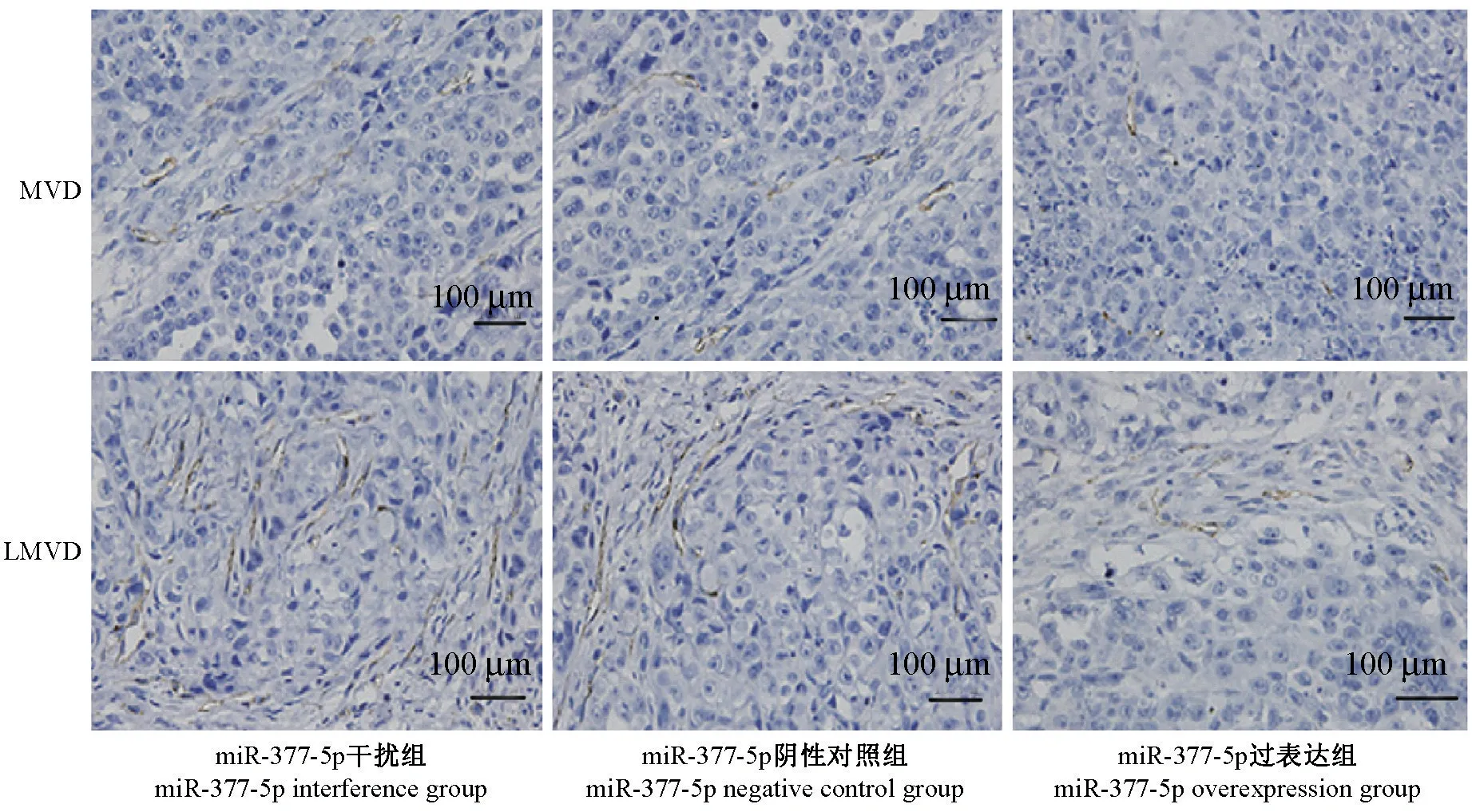
图6 miR-377-5p 过表达对血管和淋巴管生成的影响Figure 6 Effect of miR-377-5p overexpression on angiogenesis and lymphangiogenesis
最近的研究表明,miRNAs 参与不同方面的血管生成的调节[11]。实质上我们对miRNAs 在结肠癌血管生成和淋巴管生成中的作用知之甚少。本研究发现,在结肠癌细胞中,VEGF-C 通过miR-377-5p 与其mRNA 3′-UTR 的结合而发生转录后逆转录调控。此外,在结肠癌细胞中过表达miR-377-5p 可降低肿瘤血管生成和淋巴管生成的关键调控因子VEGF-C、VEGF-A 和 VEGFR-3 的表达,从而降低 p-AKT 的磷酸化水平,抑制了血管生成和淋巴管生成。这些发现表明,miR-377-5p 可能通过直接靶向与淋巴管生成和血管生成相关的因子VEGF-C 抑制结肠癌的生长。
在很多病理和生理的过程中,比如血管和淋巴管生成,血管和淋巴管通透性的改变,VEGF 的家族都发挥着不可或缺的重要作用[12]。在这些生长因子中VEGF-C 在肿瘤血管和淋巴管生成过程中发挥着主要作用,是近年来发现的VEGF 家族新成员,也是VEGF 的重要成员[13]。VEGF-C 在肿瘤和内皮细胞中都有表达[14]。血管内皮生长因子3(VEGFR-3)是淋巴内皮细胞特异性标记物,属于VEGF-C 的特异性受体,在肿瘤的淋巴管生成中起着重要作用[15]。在各种恶性肿瘤中,过表达 VEGF-C 以及VEGFR-3 都与不良的预后具有明显的相关性[16]。VEGF-A 调节活性最强,促进新生血管的生成,为机体提供所需的氧。在本研究中发现,miR-377-5p 过表达组的 VEGF-A、VEGF-C、 VEGFR-3 蛋白水平显著低于miR-377-5p 干扰组和miR-377-5p 阴性对照组,且miR-377-5p 过表达组的 MVD 和 LMVD 显著低于miR-377-5p 干扰组和miR-377-5p 阴性对照组。相关研究表明,在血管新生过程中,VEGF-A、VEGFC、VEGFR-3 诱导内皮细胞向促血管发生因子移动和增殖[17]。也有研究表明,在成鼠的淋巴管再生模型中再次证实了VEGF-C 和VEGFR-3 信号通路在淋巴管萌发过程中的重要性[18]。
本研究结果证实的关键功能是miR-377-5p 在调节VEGF-C 和VEGF-A 表达上奠定了一定基础,开发新的治疗结肠癌的方法, 特别是针对肿瘤血管和淋巴管生成方面。大量研究表明miRNA 能够调节几个致癌基因[19],所以miRNA 的表达在肿瘤治疗中具有巨大的潜力。因此,本研究关于结肠癌的数据清楚的表明,过表达miR-377-5p 在结肠癌治疗中可能具有很高的价值。
综合上述,miR-377-5p 在结肠癌中低表达,抑制了结肠癌细胞的增殖、细胞迁移和侵袭,促进了结肠癌细胞的凋亡能力,并通过直接靶向VEGF-C抑制肿瘤的血管和淋巴管生成。但在miR-377-5p表达可阻断肿瘤进展以及p-AKT 信号通路的作用机制方面有待进一步研究。

