POCD 小鼠海马组织中差异表达miRNA 的筛选、靶基因预测和生物信息学分析及其调控机制探讨
张英立,刘乘麟,于明懂,王莹,胡南,卢悦淳,吕国义
1 天津医科大学第二医院,天津300211;2 天津市天津医院;3 天津医科大学肿瘤医院
围手术期神经认知障碍(PND)是由麻醉学、神经病学、老年病学、精神病学、神经心理学、外科学以及心理学等多个学科专家共同命名的,通常指术前和术后12 个月之内发生的,包含术后谵妄(POD)以及术后认知功能障碍(POCD)在内的所有围手术期认知功能改变[1-2]。POCD 是老年患者术后常见的并发症,表现为记忆力、注意力以及判断力的下降,目前临床上缺乏有效的防治措施。尽管目前对于POCD 的研究层出不穷,研究者提出各种假说试图揭示POCD 的发病机制,如神经系统炎症、氧化应激、自噬障碍、突触功能受损等[4],其潜在的发病机制仍无定论。miRNA 是一类能够调节基因表达的短单链内源性非编码RNA,长度约为22 nt,通过与互补的mRNA 选择性的结合,可抑制相关蛋白的产生。大脑中含有丰富的miRNA,可特异性表达于特定的细胞、组织甚至发育的不同阶段[5]。目前研究表明,miRNA 在与神经系统相关的发育、学习、记忆中起着重要的作用,其异常表达可以导致许多神经系统的疾病[6-7]。本研究基于基因公共表达数据库(GEO 数据库),通过分析GEO 数据库中miRNA 表达谱数据,利用生物信息学方法,比较POCD 和正常小鼠海马组织中miRNA 的差异性表达,预测其靶基因,以期构建POCD 小鼠海马组织中差异表达的miRNA-mRNA 调控网络,为POCD 分子机制的进一步研究提供基础。
1 资料与方法
1.1 POCD 小鼠海马组织与正常小鼠海马组织基因表达谱数据的获取 以“POCD”、“Mus muscu⁃lus”、“miRNA”为关键字,在GEO 数据库中搜索下载符合条件的芯片数据GSE95070,包括5 个POCD 小鼠海马组织样本和5个正常小鼠海马组织样本,检测平台为 GPL19117(Affymatrix Multispecies miRNA-4 Array)。
1.2 POCD 小鼠海马组织与正常小鼠海马组织中差异表达miRNA(DEMs)的筛选 将芯片数据进行处理和矫正后,基于R 软件(版本3.6.2)的limma 函数包筛选出差异表达的miRNA,即DEMs。DEMs 的筛选阈值为P<0.05和|log2FC|≥2。
1.3 DEMs 靶基因(DEGs)的预测 将DEMs 分别输 入 到 miRTarBase(http://mirtarbase. mbc. nctu.edu. tw/php/index. php)、TargetScan(http://www.targetscan. org/)、miRDB(http://www. mirdb. org/)数据库中,预测其靶基因,选择三个数据库中皆存在的靶基因,认定为差异表达的DEMs 靶基因,即DEGs。
1.4 DEGs 的基因本体(GO)功能富集分析和KEGG 信号通路分析 GO 功能富集分析是一个描述基因功能的生物学模型框架,它从分子功能、细胞组分和生物学过程三个方面对基因功能进行描述和分类[8]。KEGG(http://www.genome.jp/kegg/)是一个数据库的集合,收集了大量基因组数据、信号通路、药物、疾病的相关信息[9]。使用 R 软件中的 gg⁃plot2、enrichplot 函数包对 DEGs 进行了 GO 功能富集分析和KEGG 信号通路分析,认定P<0.05 为差异具有统计学意义,达到显著富集。
1.5 DEGs 蛋白互作网络(PPI)的构建及小鼠POCD 发生发展枢纽基因的筛选 STRING(http://string-db.org/)是用于评估蛋白质-蛋白质之间相互作用的在线数据库。为了明确DEGs 之间的相互作用关系,我们将DEGs 输入到STRING 数据库,构建PPI 网络。将蛋白间相互作用得分>0.4 的节点输入到可视化工具Cytoscape 软件中,利用cytoHubba 插件,根据Degree 算法计算基因的节点度,筛选出节点度值排名前10 的节点,即为可能参与小鼠POCD发生发展的枢纽基因。
1.6 POCD 小鼠海马组织中差异表达miRNA-mRNA 调控网络图的构建 选取10个小鼠POCD 发生发展的枢纽基因,并找出其相应的DEMs,利用Cytoscape 软件构建POCD 小鼠海马组织中差异表达miRNA-mRNA调控网络图。
2 结果
2.1 POCD 小鼠海马组织与正常小鼠海马组织中DEMs 的筛选结果 GSE95070 中有 2 821 个 miR⁃NA,共筛选出19 个显著差异表达的DEMs,其中11个miRNA 表达上调,8 个miRNA 表达下调。表达上调的 miRNA 为 mmu-miR-28a-3p、mmu-miR-674-3p、mmu-miR-344d-3p、 mmu-miR-1839-3p、 mmu-miR-1983、mmu-miR-299b-5p、mmu-miR-125b-1、mmumiR-1934-3p、mmu-miR-3065-5p、mmu-miR-411-3p、mmu-miR-384-5p,表达下调的 miRNA 为 mmu-miR-592-3p、mmu-miR-362-3p、mmu-miR-455-3p、mmumiR-490-5p、mmu-miR-7072-5p、mmu-miR-181c-5p、mmu-miR-6981-5p、mmu-miR-107-3p。
2.2 DEGs 的预测结果 最终得到448 个DEGs,其中表达上调的DEGs包括Gsk3β、Cd34、Smad2、Smar⁃ca4、Grb2、Sin3a、Fam160b2、Trim2、Stk32a、Ap1g1、Gpd1l、Fam122b、Stat1、E2f3、Antxr2 等基因,表达下调 的 DEGs 包 括 Igf1、Ubxn7、Ncam1、Arf6、Celf2、Nr3c2、Tcerg1、Srsf1、Sytl4、Ywhah等基因。
2.3 DEGs 的GO 功能富集分析和KEGG 信号通路分析结果 GO 功能富集分析结果显示,DEGs 主要与分子功能密切相关,在DNA 结合的转录因子激活活性、特异性RNA 聚合酶Ⅱ、微小GTP 酶结合等分子功能中显著富集;生物学过程分析结果显示,DEGs主要在树突的形成以及调节、促进神经胶质细胞的增殖等生物学过程中显著富集;细胞组分分析结果显示,DEGs 主要富集于突触膜的有机组成成分、细胞边缘以及囊泡运输等细胞组分中。KEGG信号通路分析结果显示,DEGs 在Cushing 综合征相关通路、cGMP-PKG 信号通路、Hepatitis C 信号通路、Apelin信号通路等通路中显著富集。
2.4 小鼠POCD 发生发展枢纽基因的筛选结果小鼠POCD 发生发展的10 个枢纽基因分别为Gsk3β、Igf1、Cd34、Ubxn7、Smad2、Smarca4、Stat1、Grb2、Sin3a、Ncam1,其相互作用关系见图1。

图1 小鼠POCD发生发展枢纽基因的相互作用关系图
2.5 POCD 小鼠海马组织中差异表达miRNA-mRNA 调控网络图的构建结果 10 个小鼠POCD 发生发展枢纽基因相应的DEMs 共有6 个,分别为mmu-miR-362-3p、mmu-miR-3065-5p、mmu-miR-592-3p、mmu-miR-28a-3p、mmu-miR-181c-5p 以及 mmumiR-351-5p。利用Cytoscape 构建二者间的调控网络图,得到 10 个 miRNA-mRNA 关系对,见表 1。由表1 可知,mmu-miR-362-3p 节点度最高,可以调控Gsk3β、Smad2、Grb2、Sin3a 四个 mRNA,mmu-miR-3065-5p 可以调控 Igf1、Ncam1 两个 mRNA。构建的POCD小鼠海马组织中差异表达miRNA-mRNA调控网络见图 2,其中 mmu-miR-362-3p 调控 Gsk3β 的关系对、mmu-miR-3065-5p 调控Igf1 的关系对在调控网络中节点度最高。
3 讨论
本研究运用生物信息学方法,鉴定出POCD 小鼠海马组织与正常小鼠海马组织中11个上调和8个下调的差异表达的miRNA,即DEMs。miRNA 与靶基因之间存在负相关关系,其可以通过抑制后者转录或翻译下调靶基因的表达。研究[10]表明,miRNA-mRNA 调控网络与中枢神经系统密切相关。大脑中miRNA-mRNA 调控网络失调可以导致多种人类疾病,如阿尔茨海默病(AD)[11]、帕金森病(PD)[12]、脑梗死[13]以及缺血性脑血管疾病[14]等。本研究发现,在所有的DEMs中,mmu-miR-362-3p节点度最高,可以调控Gsk3β、Smad2、Grb2、Sin3a四个mRNA,mmumiR-3065-5p 可以调控 Igf1、Ncam1 两个 mRNA,其中,mmu-miR-362-3p 调控 Gsk3β 的关系对、mmumiR-3065-5p 调控Igf1 的关系对在调控网络中节点度最高,推测Gsk3β和Igf1可能是影响POCD发展进程以及预后的关键基因。
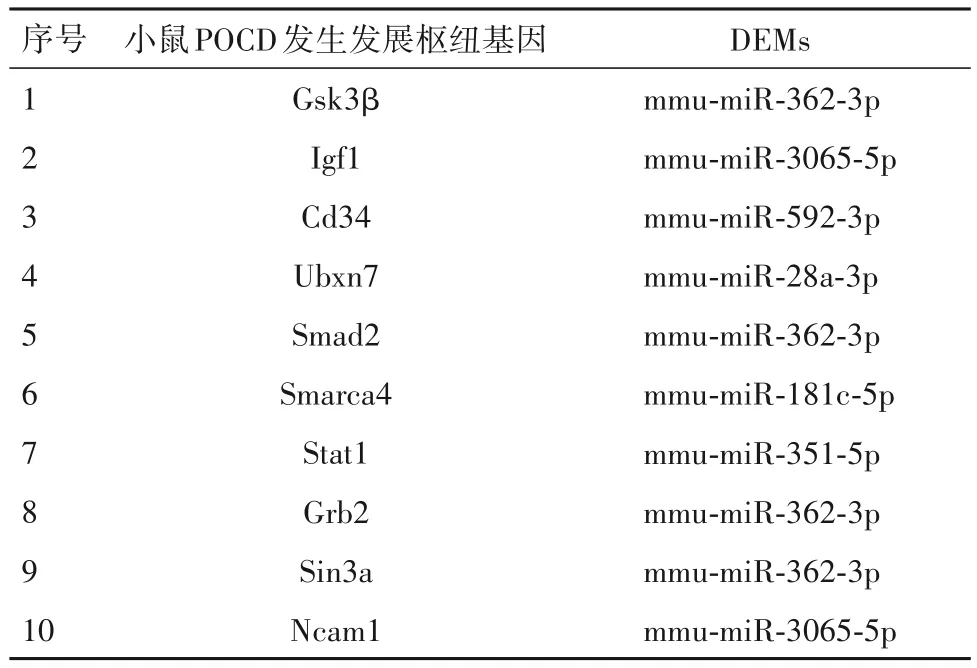
表1 小鼠POCD发生发展枢纽基因及其对应的DEMs

图2 POCD小鼠海马组织中差异表达miRNA-mRNA调控网络图
POCD 在分子机制上与老年痴呆、抑郁症、AD、PD 等神经精神疾病密切相关。研究[15]表明,患有AD 的老年人POCD 的风险增加,并且与AD 发病相关的神经信号通路参与了POCD 的病因[16],老年人术前抑郁可增加POCD 的风险[17]。在构建的miR⁃NA-mRNA 调控网络图中,Gsk3β 和 Igf1 是节点度最高的两个基因。Gsk3β 作为一种丝氨酸/苏氨酸蛋白激酶,参与细胞凋亡、细胞增殖、糖原代谢等生物学进程。研究[18]表明,Gsk3β 在小鼠海马和皮层神经元中的过度表达能导致相应区域神经元丢失和记忆缺陷。在转基因小鼠的AD模型中,Gsk3β抑制剂能够延缓皮质神经元Aβ 的聚集和斑块的沉积[19],激活Nrf2 通路,阻止认知功能障碍的产生[20],因此,Gsk3β 抑制剂被认为是治疗AD 可能的有效药物。Gsk3β 在 PD 小鼠中表达增加,通过间接调控 Nrf2 通路,抑制PD小鼠线粒体生物过程的激活,促进PD小鼠病程的进展[21]。Igf1 是机体中重要的稳态调节因子,参与机体的许多生理代谢过程,在生长发育、寿命长短控制和衰老进程中起到重要的作用。通过影响突触的形态和功能、神经元的兴奋性以及与NMDA 受体的相互作用,Igf1 的表达导致学习和记忆的显著改变。研究[22]发现,人类血清Igf1 水平随年龄增长而下降,Igf1的水平降低与认知缺陷以及中枢神经系统退行性疾病相关。Igf1 在正常脑发育中起着关键作用,Igf1 及其受体Igf1R 基因突变会导致小头畸形和智力障碍[23]。MARKOWSKA等[24]研究发现,在正常老年大鼠脑室内注射Igf1可以改善大鼠认知功能的下降,表现为记忆力和物体识别能力的提高。本研究结果与上述研究结果一致,尽管Gsk3β和Igf1在神经退行性疾病中的作用已经得到证实,但是其在POCD中的潜在作用尚未研究清楚,这对于探索和研究POCD的新机制和治疗靶点具有重要意义。
本研究发现,差异表达的mRNA 主要富集于与Cushing 综合征相关的通路以及cGMP-PKG 信号通路中。Cushing 综合征是一种以内源性皮质醇增多为特点的内分泌疾病,与长期认知功能障碍、抑郁、焦虑等症状相关,并且在疾病缓解后症状可以持续存在。研究[25]表明,糖皮质激素分布于整个大脑,其中海马体和前额叶皮质浓度最高,而前者正是大脑认知、学习和记忆的关键区域。海马对糖皮质激素的缺乏和升高都很敏感,给予外源性糖皮质激素或暴露于内源性高皮质醇会导致海马锥体细胞形态的改变和细胞丢失,损害动物的记忆能力。Cushing综合征患者海马体萎缩,纠正高皮质醇后海马体积减少可以部分逆转,仍可存在持续的认知功能异常,最常见的受影响的认知领域包括注意力、执行能力以及长短期记忆的下降,机制可能与葡萄糖利用率降低、神经元稳态失调以及神经递质信号传导异常相关。目前研究表明,海马体中cGMP 水平的增加可以改善学习和巩固记忆,尤其是在记忆形成的早期阶段。cGMP-PKG 信号通路与突触可塑性相关,其激活可以降低与年龄相关的记忆障碍。
综上所述,本研究通过运用一系列生物信息学方法筛选POCD 小鼠海马组织中异常表达的miR⁃NA,与正常小鼠海马组织相比,POCD小鼠海马组织中有 19 个差异表达的 DEMs 和 448 个 DEGs;DEGs与树突的形成以及调节等有关,参与介导Cushing综合征相关通路、cGMP-PKG 信号通路等。mmu-miR-362-3p、mmu-miR-3065-5p 等差异表达的 miRNA 可能是通过调节Gsk3β、Igf1 等靶基因的表达,影响POCD的发生发展。

