甲哌钅翁通过调节棉花叶片水分平衡和光合性能提高苗期耐旱性的生理机制
王玉贤,董莹莹,李芳军,杜明伟,田晓莉,李召虎
(中国农业大学农学院/ 作物化控研究中心/ 植物生长调节剂教育部工程研究中心,北京 100193)
我国是原棉生产大国,棉花种植区域主要分布在干旱和半干旱地区,常受到春旱、伏旱或秋旱的威胁, 其中春旱对出苗和苗期生长影响较大。 干旱胁迫下,植物会在组织和细胞水平发生多种生理生化反应启动胁迫应答,如积累脯氨酸等低分子量渗透调节物质防止细胞失水[1];积累超氧化物歧化酶、过氧化物酶和抗坏血酸等抗氧化物质消除过多的活性氧[2];形成水通道蛋白、晚期胚胎发生丰富蛋白(Late embryogenesis abundant,LEA)等具有保护和调节细胞功能的蛋白[3];以及加快根系生长增强吸水能力、减少蒸腾增加保水能力[4]。此外,耐旱性强的物种或品种能减轻干旱对叶绿素含量和净光合速率的负面影响,保护光合系统Ⅱ[5-6]。
植物生长调节剂不仅可以调控植物的生长发育, 也可以提高植物抵抗生物和非生物逆境的能力[7-9]。甲哌钅翁(Mepiquat chloride,DPC)是在棉花生产中广泛应用的植物生长调节剂[10],通过抑制赤霉素(Gibberellin,GA)关键合成酶柯巴基焦磷酸合酶 (Ent-copalyl diphosphate synthase,CPS)和内根-贝壳杉烯合酶(Ent-kaurene synthase,KS)编码基因的表达降低内源GA 含量,从而延缓茎枝的伸长生长[11]。 此外,有研究表明DPC 浸种可增强作物抵御苗期干旱胁迫的能力[12-16],但存在延迟出苗、降低出苗率的风险[17]。为明确棉花苗期叶面喷施DPC 是否也具有提高棉株抗旱能力的作用,本文从形态、光合特性、水分平衡及利用等方面进行了探索。研究结果不仅可挖掘DPC的调控潜力,而且有助于完善其作用机制。
1 材料与方法
1.1 试验设计
试验于2018―2019 年在中国农业大学植物培养室进行。 试验材料为陆地棉(Gossypium hirsutumL.)品种中棉所41,由中国农业科学院棉花研究所和河北省河间市国欣农村技术服务总会提供。DPC 为98%(质量分数,下同)可溶性粉剂,由河北国欣诺农生物技术有限公司提供。
挑选饱满一致的棉花种子, 在3%过氧化氢溶液中浸泡15 min,之后用清水冲洗3~5 次、用去离子水冲洗2 次,于28 ℃下避光浸种12 h。 挑选露白一致的种子播种于装有450 g 混土(营养土和蛭石体积比为10∶1)的花盆中(直径25 cm,高20 cm),每盆播6~8 粒种子,生长至2 叶期后保留3 株长势一致的幼苗。
培养室光照强度为(400±100)μmol·m-2·s-1,光照/黑暗时间为14h/10h,昼夜温度为(28±2)℃/(22±2)℃,相对湿度为65%。
试验设置4 个处理:CK-Ctrl (正常供水+喷施清水)、CK-DPC(正常供水+喷施DPC)、DSCtrl(干旱+喷施清水)、DS-DPC(干旱+喷施DPC)。于2 叶期,叶面喷施浓度为30 mg·L-1的DPC,以等量清水为对照,喷至叶片完全湿润。 鉴于喷施DPC 后4 d 可显著影响棉花的多项生理指标[18],因此本研究选择DPC 处理5 d 后进行控水干旱处理,对照组(CK-Ctrl,CK-DPC)正常供水。 正常供水处理为每2~3 d 浇1 次水,将托盘中加水直至花盆中表层土壤湿润后倒掉多余水分;干旱处理前浇1 次水,之后不再浇水进行干旱处理,直至棉花幼苗出现干旱表型,进行观察和拍照记录; 干旱处理7 d 后待棉花幼苗均呈现出明显的干旱表型,拍照记录表型,之后进行复水,观察植株的生长恢复表型,6 h 后拍照记录表型。各处理重复6 盆,4 个处理的植株置于同一托盘中培养。
1.2 测定指标和方法
1.2.1生物量。干旱处理7 d 后,取完整植株将根部冲洗干净,用吸水纸将多余水分吸干,分离地上部和地下部, 置于105 ℃烘箱中杀青0.5 h 后将温度调至85 ℃烘至恒重并称量干物质质量。各处理重复3 株。
1.2.2叶片相对含水量。 干旱处理5 d 后,取第2片叶称量鲜物质质量, 用去离子水浸泡至恒重,吸干表面水分后称量饱和鲜物质质量, 之后置于80 ℃烘箱中烘至恒重并称量干物质质量。 用以下公式计算叶片相对含水量(Relative water content RWC):
相对含水量(%)=(叶鲜物质质量-叶干物质质量)/(叶饱和鲜物质质量-叶干物质质量)×100%.
1.2.3叶片脯氨酸和可溶性蛋白含量。 分别于干旱处理后0、1、2、4、6 d 取幼苗第2 片真叶, 采用考马斯亮蓝G-250 法测定可溶性蛋白含量[19]。 参照孔祥生等[20]的方法测定游离脯氨酸含量。
1.2.4叶绿素含量。干旱处理5 d 后,使用直径为0.6 cm 的打孔器从各处理植株的第1、2 和3 片叶取样, 每株共取60 个叶圆片, 取样面积为0.28 cm2。将叶圆片置入96%乙醇溶液中,避光浸提24 h 至叶片完全脱色, 使用分光光度计测定665 nm 和649 nm 处的吸光值, 按照下列公式计算叶绿素含量:
叶绿素a 浓度 (mg·L-1)=13.95×OD665-6.88×OD649;
叶绿素b 浓度 (mg·L-1)=24.96×OD649-7.32×OD665;
叶绿素含量(mg·cm-2)=色素浓度×提取液体积×稀释倍数/样品面积;
总叶绿素含量(mg·cm-2)=叶绿素a 含量+叶绿素b 含量。
1.2.5叶片光合参数。 干旱处理5 d 后,用LI-6400 便携式光合系统(LI-COR,Lincoln,NE,USA)测定第2 片真叶的净光合速率(Net photosynthetic rate,Pn)、 气孔导度 (Stomatal conductance,Gs)、蒸腾速率(Transpiration rate,Tr)及胞间CO2浓度(Intercellular CO2concentration,Ci)。人工光源的光强为500 μmol·m-2·s-1。
1.2.6水分利用率(Water use efficiency,WUE)。WUE 按以下公式[21-22]计算:
水分利用率=净光合速率(Pn)/ 蒸腾速率(Tr)×1000。
1.3 数据统计与分析
采用Microsoft Excel 2010 对数据进行整理、计算和作图, 用SPSS Statistics 21 的一般线性模型(General linear model,GLM)进行方差分析,用邓肯多重范围检验(Duncan’s)法对各处理进行多重比较。
2 结果与分析
2.1 叶面喷施DPC 对棉花幼苗形态和干物质质量的影响
就各处理棉苗生长表型看(图1A),正常供水条件下,CK-DPC 处理的棉花植株与CK-Ctrl相比叶片较小, 植株较矮。 干旱胁迫7 d 后,DS-DPC 与DS-Ctrl 处理的幼苗叶片均出现萎蔫,但DS-DPC 处理降低了叶片萎蔫程度。 复水6 h 后,DS-DPC 的幼苗叶片较DS-Ctrl 更快恢复平展。 根据棉苗地上部和地下部干物质质量变化(图1B 和1C), 在正常供水条件下,CK-DPC 处理抑制了植株地上部的生长。 干旱胁迫7 d 后,DS-Ctrl 处理地上部干物质质量较CK-Ctrl 显著下降,降幅为71.0%;而DS-DPC 处理地上部干物质质量与CK-DPC 相比下降62%,DPC 处理与清水对照相比降幅减少了9.0 百分点(图1B)。
无论供水条件如何,与清水对照相比,喷施DPC 对地下部根系干物质质量无显著影响。干旱胁迫7 d 后,DS-Ctrl 处理的根系干物质质量较CK-Ctrl 降低14%;与CK-DPC 相比,DS-DPC 处理的根系干物质质量降低11%;DPC 处理与清水对照处理相比, 根系干物质质量降幅减少了3.0 百分点(图1C)。 说明DPC 处理能够缓解干旱对棉花幼苗的生长抑制,且对地上部的缓解作用更明显。
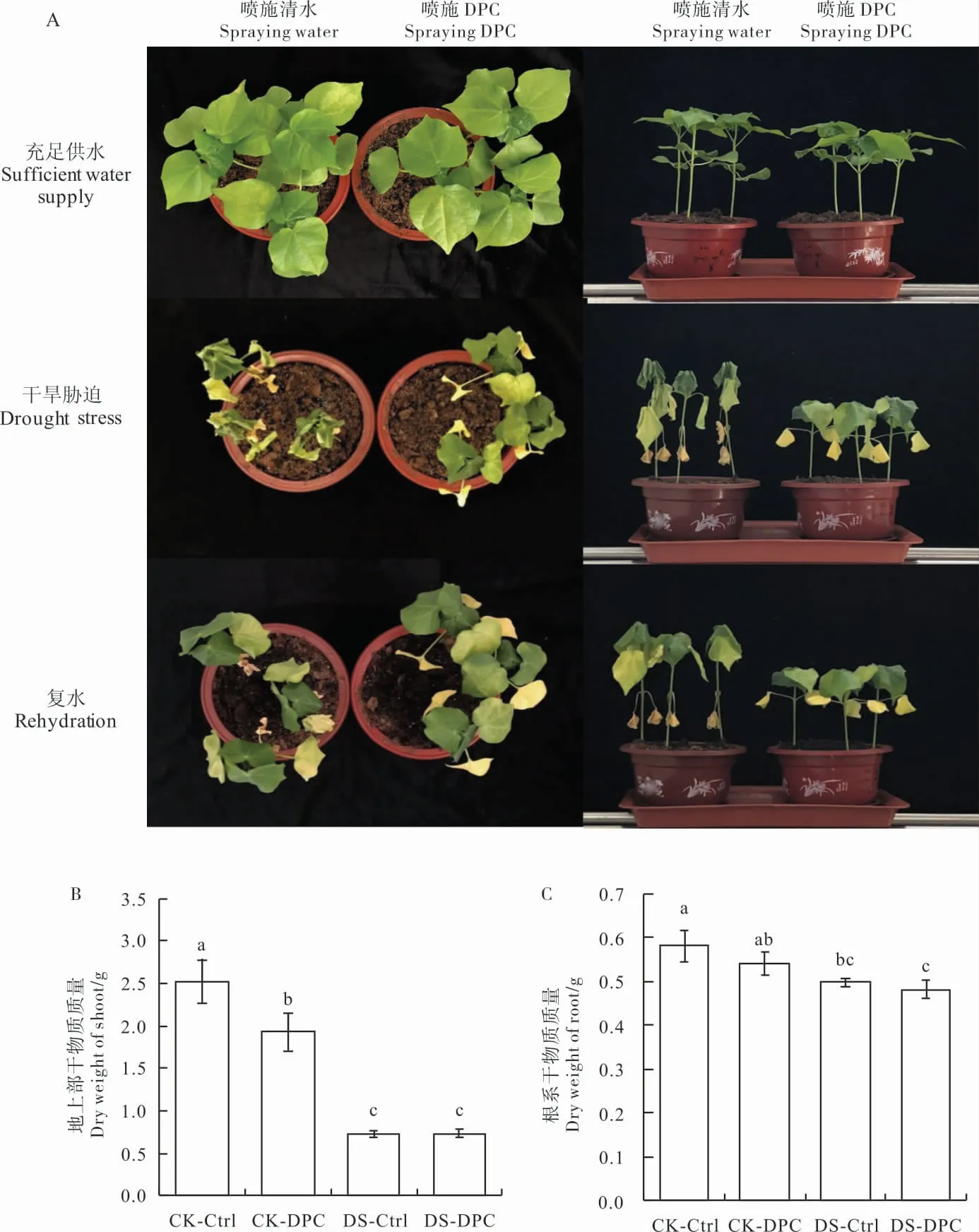
图1 喷施DPC 对干旱胁迫下棉苗生长的影响Fig. 1 Effects of spraying DPC on the development of cotton seedlings under drought stress
2.2 DPC 对棉苗叶片相对含水量的影响
正常供水条件下,CK-DPC 处理的棉花幼苗叶片相对含水量与CK-Ctrl 处理无显著差异。 胁迫条件下,DS-DPC 处理的叶片相对含水量较DS-Ctrl 显著增加12.06%(图2), 表现出较强的保水能力。
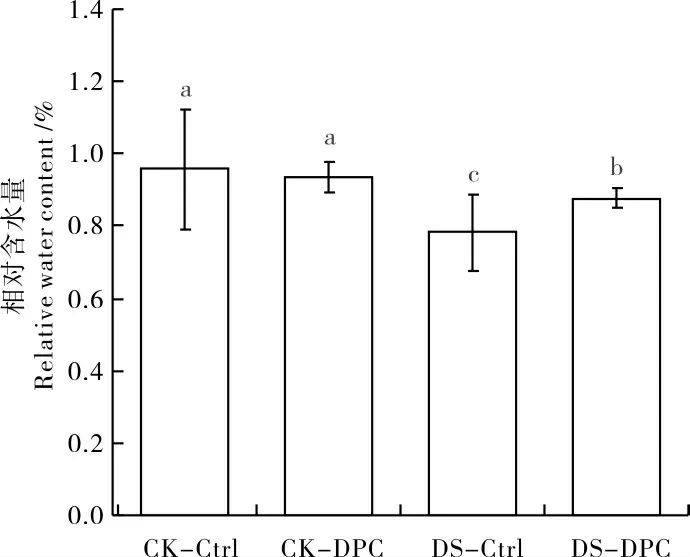
图2 喷施DPC 对棉苗叶片相对含水量的影响Fig. 2 Effects of spraying DPC on the relative water content of cotton leaves
2.3 喷施DPC 对干旱胁迫下叶片脯氨酸含量的影响
脯氨酸是重要的渗透调节物质[23],干旱胁迫下,DS-Ctrl 处理的脯氨酸含量较CK-Ctrl 处理有所增加;DS-DPC 处理的脯氨酸含量较CK-DPC有所增加。 除干旱处理6 d 后, 在不同供水条件下,DPC 处理组的脯氨酸含量较清水处理组均有所增加(图3)。 CK-DPC 处理的脯氨酸含量在第2 天和第4 天分别较CK-Ctrl 显著增加53.9%和79.0%。 胁迫条件下,DS-DPC 处理的脯氨酸含量在第1 天和第2 天分别较DS-Ctrl 显著增加84.3%和58.8%。 上述研究结果表明DPC 可以通过促进棉花幼苗中的渗透调节物质的积累来应答干旱胁迫。
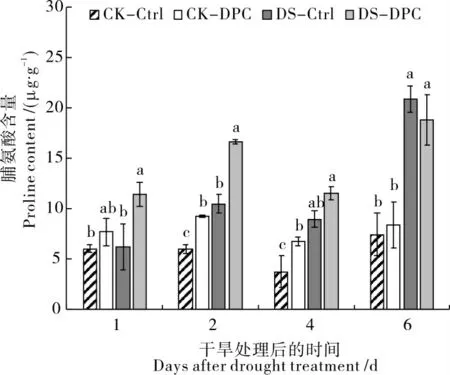
图3 喷施DPC 对干旱胁迫下叶片脯氨酸含量的影响Fig. 3 Effects of spraying DPC on proline content in leaf under drought stress
2.4 各处理下DPC 对棉花幼苗光合特性的影响
正常供水条件下,CK-DPC 处理增加了叶片的叶绿素含量,但与CK-Ctrl 相比差异不显著。干旱胁迫5 d 后,DS-Ctrl 处理的叶片叶绿素含量与CK-Ctrl 相比显著下降,降幅为30.7%;而DS-DPC处理缓解了干旱胁迫对叶绿素的破环, 与CK-DPC处理相比降幅为18.9%, 且与CK-Ctrl 相比无显
著性差异(图4A)。
正常供水条件下,CK-DPC 处理的幼苗叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)与CK-Ctrl 相比均无显著差异(图4B~E)。 干旱胁迫后,相较DS-Ctrl 处理,DS-DPC 处理的Pn和Tr分别显著增加149.1%和85.9%,Ci显著降低18.0%,Gs有所增加,但无显著性差异。
2.5 喷施DPC 提高干旱胁迫下棉花幼苗水分利用率
正常供水条件下,CK-DPC 处理的水分利用率较CK-Ctrl 处理无显著差异。 干旱胁迫5 d 后,DS-Ctrl 处理的水分利用率较CK-Ctrl 显著下降,DS-DPC 处理的水分利用率较DS-Ctrl 显著增加67%, 且与CK-DPC 处理组相比无显著差异(图4F)。
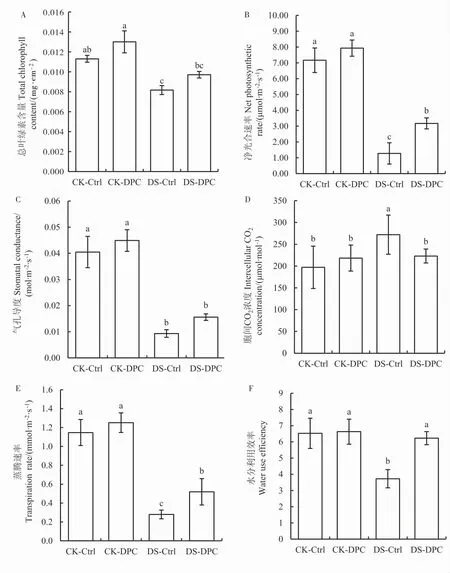
图4 喷施DPC 对棉花幼苗光合参数的影响Fig. 4 Effects of spraying DPC on photosynthetic parameters of cotton seedlings
2.6 各处理下DPC 对棉苗叶片可溶性蛋白含量的影响
由图5 可见, 无论供水条件如何,DPC 处理均可增加叶片中可溶性蛋白含量。 实施干旱胁迫的第2 天,CK-DPC 处理的可溶性蛋白含量较CK-Ctrl 显著增加62.6%。DS-DPC 处理的可溶性蛋白含量在第1 天和第2 天分别较DS-Ctrl 显著增加192.7%和28.2%。
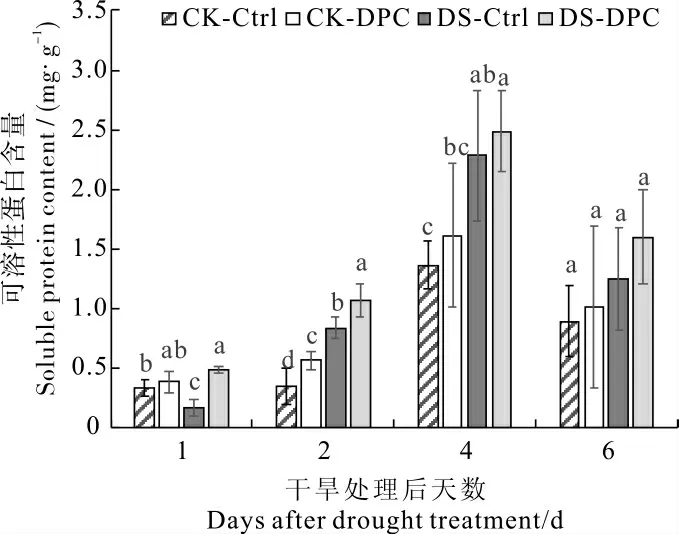
图5 喷施DPC 对干旱胁迫下棉花叶片可溶性蛋白含量的影响Fig. 5 Effects of spraying DPC on soluble protein content of cotton seedlings under drought stress
3 讨论
研究发现干旱胁迫条件下, 叶面喷施DPC可显著提高棉花幼苗的相对含水量、净光合速率和水分利用率,可通过调节水分平衡和光合性能增强棉花抵御干旱胁迫的能力。
3.1 DPC 处理降低干旱胁迫造成的地上部干物质损失
干旱胁迫可严重影响棉花的干物质积累[24]。本研究中DS-Ctrl 和DS-DPC 处理的地上部干物质质量较正常供水处理均显著减少, 但DS-DPC处理的地上部干物质质量下降程度小于DS-Ctrl(图1B)。 Niakan 等[25]的研究结果表明,不同浓度的DPC 对棉花各部位干物质质量影响不同;喷施DPC 0.5~2.0 L·hm-2可显著缩短植株的茎长,但对地上部的生物量没有显著影响。 本研究中, 正常供水条件下喷施DPC 会降低棉花的株高(图1A),这与DPC 处理植株中调节茎伸长的GA 合成基因CPS和KS的表达水平及蛋白活性的结果一致[26-27]。 而在干旱胁迫条件下,由于植株启动抗逆应答机制,生长发育受到抑制,如干旱胁迫下转录因子TINY 可平衡油菜素内酯信号介导的生长发育和逆境应答[28]。 本研究中干旱处理抑制棉花幼苗地上部的生长与前人研究结果一致, 而DPC 处理通过诱导渗透调节物质的积累、 增强植株叶片光合性能等缓解逆境胁迫,减轻胁迫对棉花地上部生长的抑制效应, 表现为DPC 处理后地上部的干物质损失较清水对照有所降低。
3.2 DPC 可缓解干旱对根系生物量的抑制作用
地下部根系是吸收水分和营养物质的主要场所,根系形态不同的棉花品种对干旱胁迫的反应不同[29]。Wu 等[30]研究发现,200 mg·L-1DPC 浸种能显著增加棉花萌发阶段的侧根数。 本研究发现叶面喷施30 mg·L-1DPC 后第12 天对棉花幼苗根系没有明显影响,但缓解了干旱对根系生物量的抑制作用(图1C)。 已有研究表明DPC 处理后10~15 d 为药效高峰期, 且不同浓度DPC 对棉花根部发育的影响不一[31]。Niakan 等[25]用DPC 0.5~2.0 L·hm-2剂量处理棉花3 周后,发现其地上部株高受到显著抑制,而根部的长度与对照相比无显著变化,这与本研究的结果相似。 推测本研究中DPC 对棉花根系形态无明显调控作用的原因可能是药剂处理后的时间较短且浓度较低。
3.3 干旱胁迫下DPC 处理调控棉花幼苗的水分保持与利用
水分胁迫条件下,植物地上部的高保水能力对维持胞内水势,保证各项生理机制的正常运行具有重要意义[32]。 失水率能直接反映植物地上部的持水能力,可作为衡量作物抗旱性的重要指标之一[33]。 渗透调节物质如脯氨酸等小分子化合物能够提高作物的渗透调节能力,维持胞内水势稳定以防止细胞过度失水[34]。干旱条件下,植物叶片中的脯氨酸含量可短时间增加200 倍[35],一方面增强了细胞的渗透调节作用,另一方面其偶极性对膜蛋白起到了一定的保护作用[36]。 田又升等[37]研究发现耐旱型棉苗的脯氨酸合成途径中的关键基因GhP5CS表达水平显著增加,促进脯氨酸的合成以应对干旱。 本研究发现,干旱胁迫条件下叶面喷施DPC 能有效降低植株地上部的失水速率,减少水分散失;促进植株体内脯氨酸的积累,维持渗透平衡;提高叶片的相对含水量,增强棉花的耐旱性,减轻水分亏缺带来的生理损伤。
水分利用率是评价作物耐旱性的一个重要指标,受渗透调节、气孔导度和光合作用等多种因素调控,可用来反映植物水分蒸散和光合作用之间的协调程度。 在玉米和小麦中的研究表明,耐旱性强的品种在干旱胁迫下具有较高的水分利用率[38-39]。本研究中,干旱胁迫7 d 后,棉花幼苗的Tr和Pn降低,但水分利用率较高。表明DPC 可优化干旱胁迫下棉花幼苗的水分利用,从而提高棉花的耐旱性。
3.4 干旱胁迫下DPC 处理提高棉花幼苗的光合效率
光合作用对干旱胁迫非常敏感,当叶片相对含水量低于80%时,净光合作用将降低50%[40-41]。原因是一方面,干旱使叶绿素减少,叶绿体结构功能退化,RUBP 羧化酶等光合作用酶的活性下降,抑制干物质的生产与积累[40];另一方面,干旱使气孔关闭,阻碍CO2的同化进程[41]。 干旱处理5 d 后棉花幼苗的叶绿素含量和净光合速率显著降低,叶片的光捕获能力和碳同化能力下降。 喷施DPC 可使棉花叶片的叶绿素含量和光合速率增加, 但DPC 不同用量对不同品种的影响程度不一[42-43]。本研究中,在正常供水条件下喷施DPC后,叶绿素含量、净光合速率均呈升高趋势,但与对照相比无显著性差异,分析原因可能与棉花品种、DPC 用量以及处理后的取样时间有关。 干旱胁迫下DS-Ctrl 处理的胞间CO2浓度较CK-Ctrl处理升高、气孔导度下降,推测净光合速率的下降是内部光合作用生理机能遭到破坏所致[43]。 与DS-Ctrl 处理相比,DS-DPC 处理叶片的总叶绿素含量提高,胞间CO2浓度降低、气孔导度升高,说明DPC 减轻了干旱胁迫下非气孔因素对光合速率的抑制效应, 从而提高了叶片的光合速率,这与DPC 可以缓解干旱对地上部干物质积累的影响一致。
3.5 干旱胁迫下DPC 处理提高棉花幼苗的可溶性蛋白含量
叶片中大部分可溶性蛋白是与光合作用相关的CO2固定酶[45]和逆境蛋白[46-47]。 因干旱胁迫下光合速率显著下降,推测本研究中可溶性蛋白含量随胁迫时间延长(胁迫后1~4 d)而增加的现象与逆境蛋白的积累有关。 逆境蛋白可调控细胞内的信号转导及基因表达,帮助植物适应不利的生长环境[48]。 本研究中,DPC 处理增加了叶片可溶性蛋白的积累, 说明DPC 可能通过促进逆境蛋白合成增强细胞在干旱胁迫下的保护能力。
4 结论
正常供水条件下, 叶面喷施DPC 对棉花幼苗的相对含水量、总叶绿素含量、净光合速率及水分利用率无显著影响。 干旱胁迫下,DPC 处理能缓解地上部的水分散失、 增加叶片脯氨酸积累、显著提高叶片相对含水量,增强叶片的保水能力;还可以提高叶片总叶绿素含量、蒸腾速率、气孔导度和净光合速率,增加叶片可溶性蛋白含量,提高水分利用率;综上,DPC 可通过调节水分平衡和光合性能增强棉花的抗旱性。

