陆地棉GhBZR1 基因的克隆及功能研究
贺浪,张华崇,司宁,简桂良*
(1.植物病虫害生物学国家重点实验室/ 中国农业科学院植物保护研究所,北京 100193;2.黄冈市农业科学院,湖北 黄冈 438000)
棉花黄萎病,被称为棉花的“癌症”,是一种土传维管束病害,由土传真菌大丽轮枝菌(Verticillium dahliae)引起。 该菌具有易变异、能产生微菌核和寄主范围广等特点[1]。 1935 年从美国引进斯字棉时,棉花黄萎病传入我国并逐年扩散。 在许多国家,棉花黄萎病使植株发育不良、叶片萎蔫、维管束黄褐化、甚至死亡,造成的平均产量损失达10%~35%[2-3]。 目前没有有效的杀菌剂防治棉花黄萎病,培育抗病品种是最可行的防治方法[4]。因此,筛选和鉴定抗棉花黄萎病相关基因是为棉花分子育种提供候选基因的有效途径。
油菜素甾醇类物质(Brassinosteroids,BR)是植物生长的正调节因子,在植物生长发育及逆境应答中发挥重要作用[5-7]。生理研究表明,BR 能促进细胞伸长,增强植物对环境胁迫的耐受性和对病原体侵染的抵抗力,从而提高作物产量[8]。 BR信号转导组分主要包括BZR1、BES1(也称BZR2)、BSK1、BRI1 和BAK1 等[9]。 在植物的免疫机制中,病原体侵入的信号能被BAK1 接收,经过信号传递,BR 信号激活磷酸酶PP2A,使BZR1 和BES1去磷酸化,与大量基因的启动子结合,从而调节这些基因的表达[10-11]。
在病原体侵染植物的过程中,BR 也起重要的作用。 Albrecht 等[12]研究发现,BR 信号可能通过调控富含亮氨酸重复序列(Leucine rich repeat,LRR)的受体激酶BAK1 下游的免疫信号,在植物生长过程中发挥重要的免疫调节作用。 在棉花基因组中鉴定出BAK1同源基因,通过病毒诱导的基因沉默(Virus-induced gene silencing, VIGS)技术发现沉默GhBAK1会引发棉花细胞死亡,并伴随着活性氧(Reactive oxygen species,ROS)的产生, 表明BAK1在棉花抗黄萎病中发挥一定的作用[13-15]。 有研究表明,BES1、BZR1 是BR 信号转导途径的关键转录因子[16]。 对拟南芥的研究发现,WRKY15、WRKY18、WRKY11的基因功能缺失突变能诱发植物体内积累的ROS,使植物产生抗病反应,这些转录因子对早期免疫反应具有负调控作用,BZR1 可诱导这些WRKY 转录因子的表达。 bHLH 转录因子HBI1 是BRZ1 的靶标位点,会抑制病原体相关分子模式(Pathogenassociated molecular pattern,PAMP) 诱导的生长阻滞、 防御基因表达、ROS 爆发以及对病原体的抗性。此外,BZR1 还可以与WRKY40 结合,介导BR 信号与免疫信号之间的拮抗作用,最终BZR1介导的转录改变抑制病原体相关分子模式触发的免疫反应 (PAMP-triggered immunity,PTI)信号[17-18]。 因此,BZR1 是BR 信号的重要调节因子,可诱导PTI 负调控因子的表达,抑制植物的免疫反应,从而利于病原体的入侵。
从育种层面分析,突变或者敲除负调控植物抗性的基因,可能在培育广谱、持久抗性品系中具有很好的应用前景。 目前,棉花中BZR1基因的研究主要集中在棉纤维发育、抗旱等生理功能方面[19-20],对棉花黄萎病抗性中的功能研究鲜有报道。 因此,本研究通过对GhBZR1进行全长克隆、生物信息学分析、黄萎病菌和激素胁迫后的表达模式分析及VIGS 等功能验证, 明确其在陆地棉抗黄萎病中的作用,为利用分子技术培育抗病品种提供候选基因。
1 材料与方法
1.1 植物材料及培养
所用材料为陆地棉抗黄萎病品系中植棉KV-3、KV-6 和KV-2;陆地棉感黄萎病品种(系)冀棉11 号、新陆早6 号、新陆早13 号和86-1。将上述种子分别脱绒、消毒处理后,点种于花盆中 (营养土与蛭石体积比为2∶1), 置于温度24 ℃、16 h 光照/8 h 黑暗、相对湿度为70%的温室生长。
1.2 GhBZR1 基因的克隆
比较接种和未接种黄萎病菌的中植棉KV-3的转录组测序结果,筛选得到GhBZR1基因。 采用RNA prepPure 植物多酚多糖总RNA 提取试剂盒(天根生化科技有限公司,北京)提取棉花品种86-1 真叶的RNA, 并用微量分光光度计进行浓度及质量检测,-80 ℃保存备用。 利用cDNA末端快速扩增(Rapid amplification of cDNA ends,RACE)技术克隆GhBZR1基因全长。 通过3′-Full RACE Core Set with Prime Script RTase 试剂盒(宝日医生物技术有限公司,北京)获得GhBZR1基因3′端非翻译区(Untranslated region, UTR),使用SMART RACE 5′/3′ Kit User Manual 试剂盒(宝日医生物技术有限公司, 北京) 获得Gh-BZR1基因5′端UTR。 RACE 所需的引物(表1)通过引物设计软件Primer 5 设计完成,由上海生工生物工程股份有限公司合成。
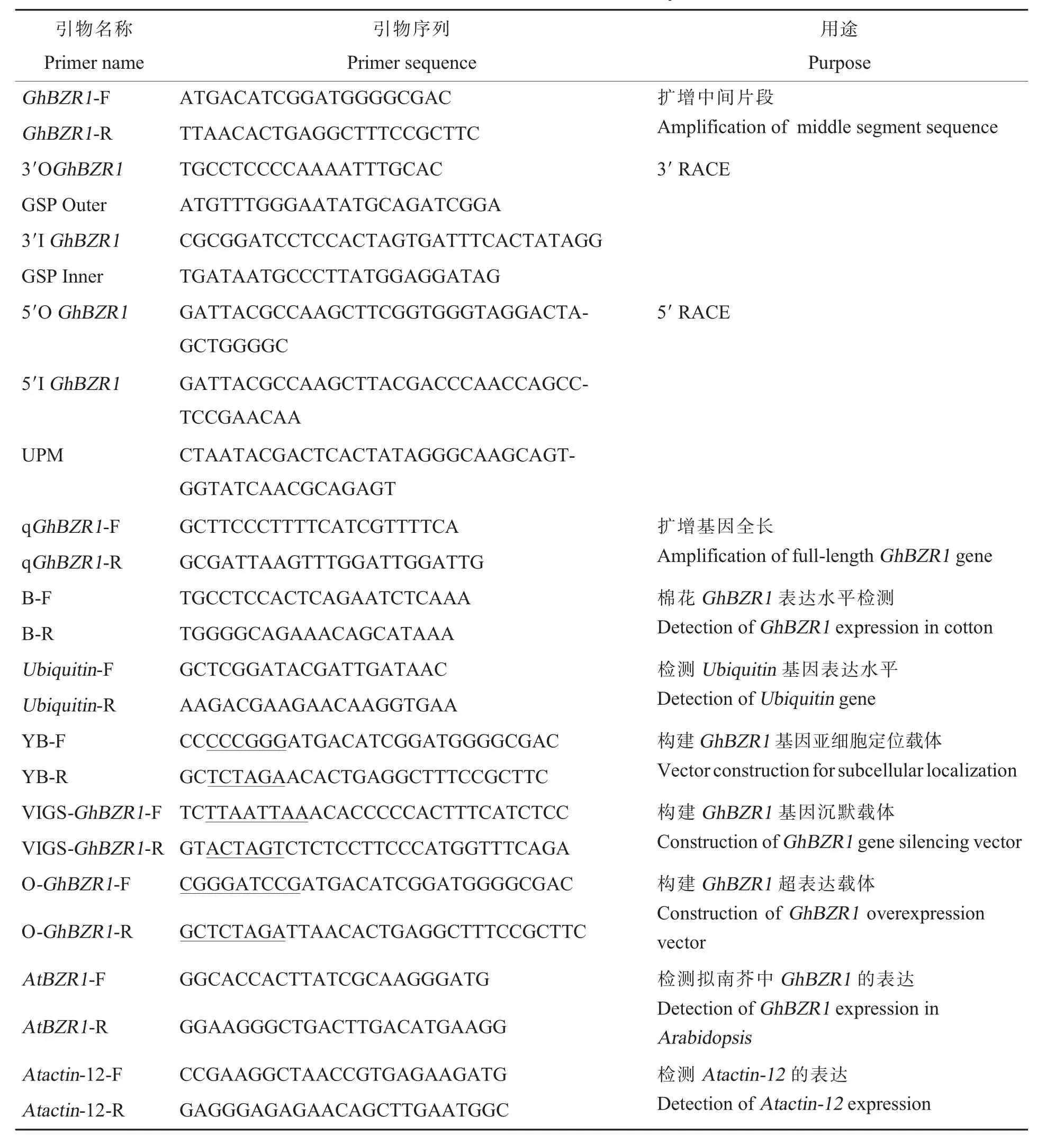
表1 本研究所用引物Table 1 Primers used in this study
1.3 生物信息学分析
利用Genbank 的Blast 找出同源蛋白序列,通过多序列比对及MEGA 5.2 软件(Booststrap值设为1 000),构建GhBZR1 及同源蛋白的系统发育树。利用NCBI 的ORF Finder 程序查找开放阅读框, 之后通过相关生物信息学方法分析Gh-BZR1 蛋白的生理生化特性, 具体操作参照任玉红[22]的方法。 为了预测GhBZR1基因可能具有的生物学功能,利用Blast 根据基因ID 从陆地棉基因组序列中调取该基因起始密码子上游1 000 bp的序列,随后将调取到的启动子序列提交到Plant CARE 网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对顺式作用元件进行预测分析。
1.4 GhBZR1 瞬时表达载体构建及亚细胞定位
利用引物扩增GhBZR1基因的编码序列(Coding sequence,CDS)(去除终止密码子),插入到亚细胞定位表达载体35S∷GFP 的多克隆位点XmaⅠ和XbaⅠ间, 与绿色荧光蛋白(Green fluorescent protein,GFP)基因融合表达,将重组质粒转化农杆菌菌株EHA105,-80 ℃保存。 亚细胞定位以本氏烟草为材料, 侵染缓冲液的制备、荧光观察等操作参照敬丹等[23]的方法。
1.5 GhBZR1 基因在不同棉花材料中的表达分析
将抗黄萎病的中植棉KV-3、KV-6 和KV-2,以及感黄萎病的冀棉11 号、新陆早6 号、新陆早13 号,培养至第2 片真叶完全展开时,接种大丽轮枝菌V991。 制备1.0×107mL-1的黄萎病菌V991 孢子悬浮液,采用蘸根法接菌,分别于处理后0 h、6 h、12 h、24 h、48 h、72 h、96 h 和144 h 取棉株叶片,以未按菌处理为对照(CK),保存于-80 ℃超低温冰箱[21]。 提取各材料的总RNA并稀释至1 000 mg·L-1,进行荧光定量检测。 按照FastQuant cDNA 第一链合成试剂盒 (天根生化科技有限公司,北京)说明书合成cDNA。 根据Super-Real PreMix Plus(SYBR Green)试剂盒(天根生化科技有限公司,北京)说明书在ABI7500 Real-time PCR system 荧光定量仪上进行实时荧光定量聚合酶链式反应 (Real-time quantitative Polymerase chain reaction,qRT-PCR)分析。 以陆地棉Ubiquitin基因为内参基因,每个处理设3 次生物学重复,采用2-ΔΔCt 法进行数据分析,检测黄萎病菌侵染后抗病和感病棉花品种(系)中GhBZR1基因的表达情况。
1.6 激素处理后GhBZR1 基因的表达分析
待棉花86-1 幼苗长至第2 片真叶展开时,分别配制含0.01 mmol·L-1茉莉酸(Jasmonic acid,JA)和0.1 mmol·L-1水杨酸(Salicylic acid,SA)的植物培养液浸泡棉花幼苗,以正常的植物培养液培养为对照,并在处理后0 h、0.5 h、1 h、3 h、6 h、12 h、24 h 和36 h 取棉花完整根部材料,-80 ℃保存。 然后提取RNA 进行qRT-PCR 试验,方法同1.5。
1.7 VIGS 技术研究GhBZR1 基因功能
设计引物(表1)克隆GhBZR1片段,插入到VIGS 载体pCLCrVA 多克隆位点SpeⅠ和PacⅠ间,将构建好的载体通过冻融法转化农杆菌菌株EHA105。 待感黄萎病棉花品种陆地棉86-1 的子叶完全展开时, 用乙酰丁香酮溶液重悬上述菌体, 将含阳性载体的菌液与含pCLCrVB 的菌液1∶1 等体积混合,室温静置3 h 后对棉花子叶进行接种[21]。 以接种pCLCrVA 和pCLCrVB 混合菌液的棉株作为空载体对照,以接种pCLCrVAGhCLAI 和pCLCrVB 混合菌液的棉株作为阳性对照,具体操作参照刘凯等[21]的方法。将沉默后的棉株置于培养箱中, 昼夜温度分别为25 ℃、20℃,光照16 h/黑暗8 h 条件下培养。 17 d 后采集叶片,提取总RNA 反转录后,利用qRT-PCR 检测基因表达量,每个材料设3 次生物学重复。
在VIGS 处理后18 d, 用注射器吸取大丽轮枝菌V991 孢子悬浮液(1.0×107mL-1)100 μL,从沉默植株子叶下方1 cm 茎部刺入,注射菌液。 接菌后6 d,调查植株真叶的发病情况,并计算病情指数(Disease index,DI),病情指数=∑(各级病株数×相应病级值)/(调查总株数×最高病级值)×100。 分级标准[24]如下:0 级为植株无症状表现;1级为1~2 片真叶发病;2 级为3~4 片真叶发病;3 级为4 片以上真叶发病或脱落;4 级为全株枯死。
1.8 GhBZR1 基因超表达载体构建及抗病性鉴定
1.8.1GhBZR1 基因超表达载体构建及遗传转化。 根据表1 中的超表达引物通过PCR 扩增GhBZR1的CDS 并插入pZP111-eGFP 多克隆位点BamHⅠ和XbaⅠ间, 利用冻融法将构建好的载体转化农杆菌菌株EHA105。然后转化拟南芥,遗传转化及筛选参照任玉红[22]的方法。
1.8.2转基因拟南芥的功能研究。 通过qRT-PCR技术检测T2代阳性转基因拟南芥中的目的基因表达量。 以Atactin-12为内参基因,每个处理设3 次生物学重复,采用2-ΔΔCt 法进行相对定量分析。
将生长4 周的野生型和转基因拟南芥从土壤中分离, 洗净根部后, 将根部在大丽轮枝菌V991 孢子悬浮液(1.0×107mL-1)中浸泡5 min,以在蒸馏水中浸泡的拟南芥作为空白对照,然后种植于花盆中。 接种大丽轮枝菌V991 后10 d,开始调查植株发病情况,病情指数计算参照1.7。
2 结果与分析
2.1 GhBZR1 基因全长的获得
提取陆地棉86-1 叶片总RNA 经1.2%(质量分数)琼脂糖凝胶电泳(图1A)和微量紫外分光光度计检测纯度和浓度均合格。通过RACE 技术获得350 bp 的3′端UTR 和223 bp 的5′端UTR;根据BZR1基因的同源序列设计中间引物GhBZR1-F、GhBZR1-R, 扩增出942 bp 的大片段;设计引物进行全长扩增得到完整的GhBZR1基因序列1 515 bp(图1B)。
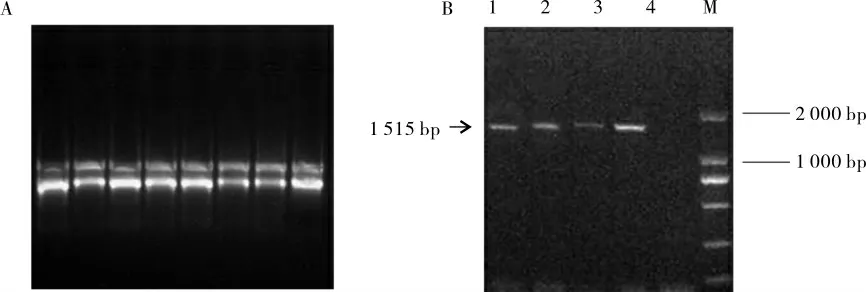
图1 总RNA 和GhBZR1 基因电泳结果Fig. 1 Electrophoresis of total RNA and GhBZR1 gene
2.2 GhBZR1 生物信息学分析
GhBZR1基因的开放阅读框长度为942 bp,编码313 个氨基酸。蛋白的相对分子质量为34.332×103,等电点为9.00,分子式为C1512H2346N434O465S9,包含30 个带负电荷的天冬氨酸和谷氨酸残基,36 个带正电荷的精氨酸和赖氨酸残基。该蛋白由20 种氨基酸组成,其中丝氨酸和脯氨酸所占比例较大,分别是13.1%和12.8%;该蛋白的不稳定系数为65.96,属于不稳定蛋白。预测显示,GhBZR1蛋白是亲水性蛋白,无信号肽结构、无跨膜结构,具有BES1_N 超家族结构域。
通过在线软件Netphos 3.0 Server 分析GhBZR1 蛋白氨基酸序列, 共发现35 个丝氨酸位点、15 个苏氨酸位点和1 个络氨酸位点可能被磷酸化,说明该蛋白可能被激酶磷酸化。
系统进化分析表明,GhBZR1 与海岛棉(G.barbadense)、雷蒙德氏棉(G. raimondii)中BZR1蛋白相似度最高、亲缘关系最近;与可可(Theobroma cacao)、哥伦比亚锦葵(Herrania umbratica)、木槿(Hibiscus syriacus)中BZR1 蛋白亲缘关系较近(图2)。
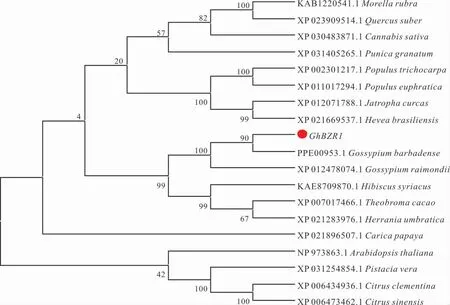
图2 GhBZR1 的系统发育树分析Fig. 2 Phylogenetic tree analysis of GhBZR1
GhBZR1 基因启动子区域顺式作用元件预测结果筛选,共发现3 类相关作用元件(表2),分别是1 个与防御和应激反应相关的作用元件TC-rich repeats,2 个响应脱落酸的ABRE 顺式作用元件,1 个MBSI 作用元件(MYB 结合位点),可能参与调控类黄酮生物合成基因表达。
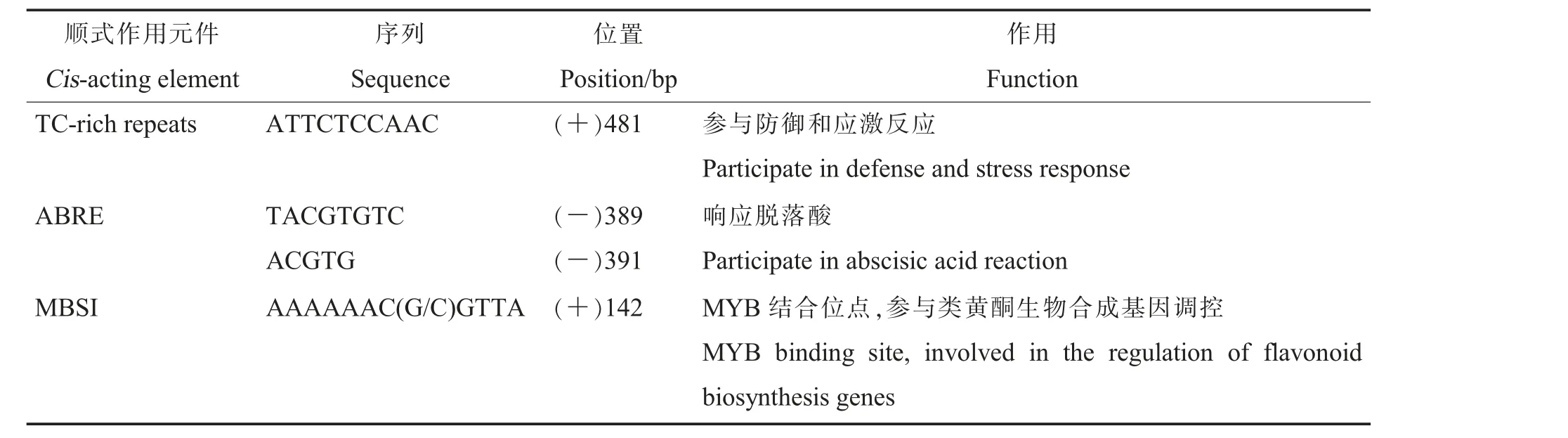
表2 GhBZR1 启动子中与抗病性相关的顺式作用元件Table 2 Pathogenesis-related cis-acting elements in the promoter of GhBZR1
2.3 GhBZR1 蛋白的亚细胞定位分析
激光共聚焦显微镜观察烟草叶片荧光的分布, 空载体GFP 信号分布在细胞核和细胞质;而GhBZR1与GFP 共表达时,荧光仅分布在细胞核(图3),说明GhBZR1 蛋白定位于细胞核,符合转录因子的基本特征。
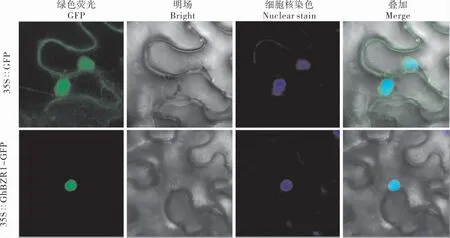
图3 GhBZR1 蛋白的亚细胞定位Fig. 3 Subcellular localization of the GhBZR1 protein
2.4 黄萎病病菌胁迫后不同棉花品种(系)中GhBZR1 基因的表达分析
接种大丽轮枝菌后,GhBZR1基因在感病和抗病棉花叶片中的表达情况见图4。 感病品种冀棉11、新陆早6 号和新陆早13 号的GhBZR1基因均在接种后12 h 左右受到大丽轮枝菌诱导上调表达。 在抗病棉花材料中植棉KV-3、KV-6 和KV-2 中,GhBZR1基因表达变化规律不一致。 与CK 相比,KV-3 接菌后24 hGhBZR1基因显著下调表达,KV-6 接菌后6 hGhBZR1基因显著下调表达,KV-2 接菌后48 h、72 hGhBZR1基因显著下调表达。 这表明,不同抗病棉花材料接种大丽轮枝菌后,GhBZR1基因的响应和表达模式不同,总体呈现下调表达趋势。
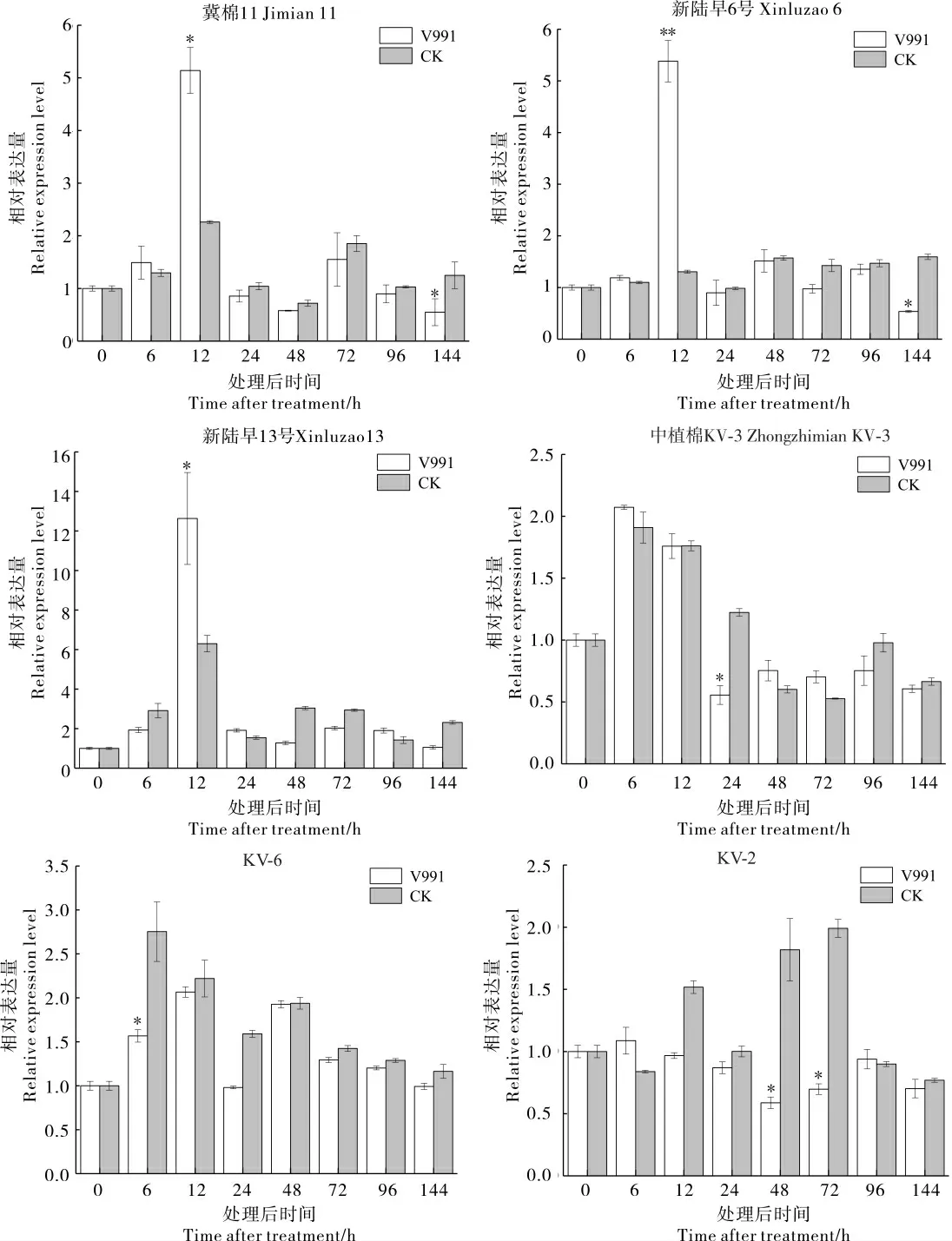
图4 黄萎病菌胁迫后GhBZR1 基因在不同抗病性品种(系)中的表达分析Fig. 4 Expression analysis of GhBZR1 gene in different cotton varieties (lines) with infection of V. dahliae
2.5 SA 和JA 处理后GhBZR1 基因的表达模式
GhBZR1基因在陆地棉86-1 苗期的根、 茎、叶中均有表达, 在茎中的相对表达量是叶中的1.87 倍,是根中的44.67 倍(图5A)。 JA 处理后0.5 h,GhBZR1表达量显著上调,之后缓慢下调,处理后12 h 表达量又上升,随后又下降,呈现“升-降-升-降”的表达趋势(图5B)。SA 处理后3 h,GhBZR1转录水平达到峰值,然后下降至原表达水平(图5C)。 这些结果表明,植物激素JA 和SA都能诱导GhBZR1的表达。
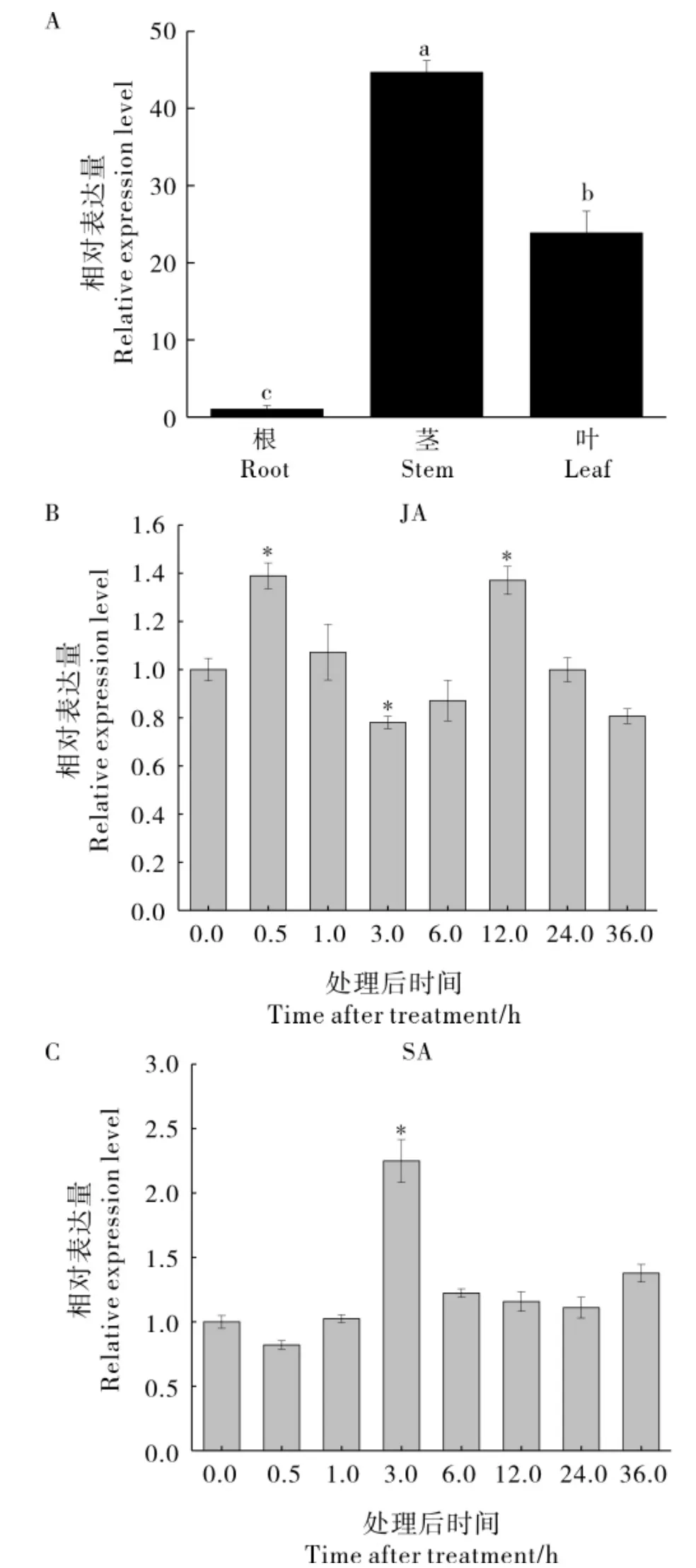
图5 激素处理下GhBZR1 的表达模式Fig. 5 The expression patterns of GhBZR1 with hormone treatments
2.6 GhBZR1 基因功能分析
在VIGS 处理后18 d,pCLCrVA-GhCLA1-pCLCrVB 阳性对照棉花叶片出现白化症状(图6A),GhBZR1沉默棉株中GhBZR1表达量较空载体对照下降39%(图6B)。
接种棉花黄萎病菌悬浮液9 d 后, 野生型和转化空载体的棉株出现叶片边缘部位变软、失水等明显的黄萎病症状,而GhBZR1沉默棉株症状较轻(图6C)。 18 d 后,GhBZR1沉默植株的病情指数为64.8±1.3,比转化空载体pCLCrV(A+B)的植株(94.1±2.1)和野生型86-1 植株(92.3±3.2)的病情指数低(图6D)。 综上,沉默GhBZR1基因可增强感病品种86-1 对黄萎病的抗性。
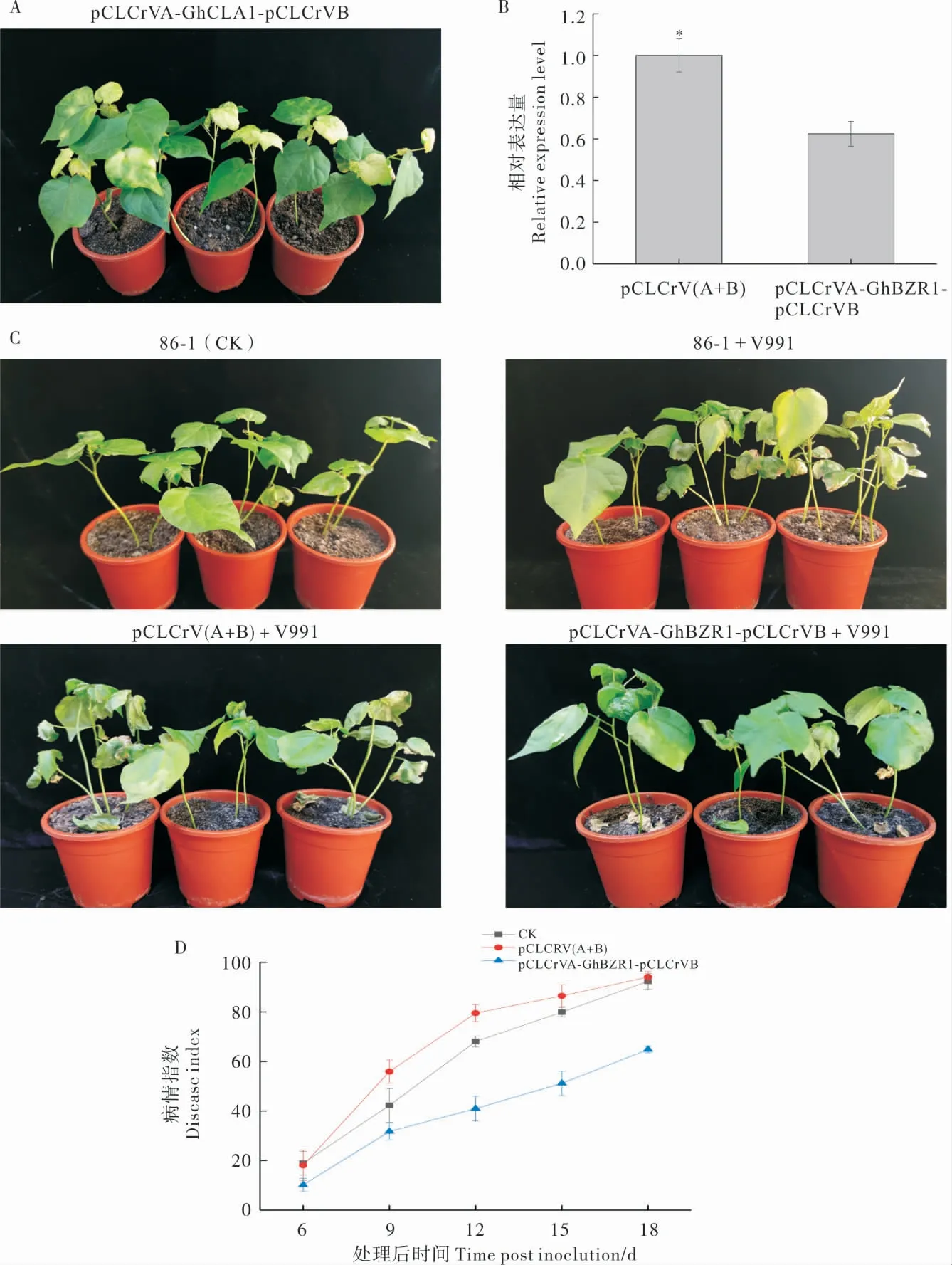
图6 GhBZR1 基因的功能分析Fig. 6 Function analysis of the GhBZR1 gene by VIGS
2.7 转GhBZR1 拟南芥的筛选及抗病性鉴定
利用载体携带的卡那霉素抗性基因筛选转基因拟南芥, 结合GhBZR1表达量的分析结果,获得14 株T2代转GhBZR1拟南芥,其中9 号株系GhBZR1基因的表达量最高,选择9 号进行后续试验研究(图7A)。
通过蘸根法对野生型拟南芥、转GhBZR1基因拟南芥、转空载体拟南芥接种黄萎病菌V991,20 d 后可观察到明显的症状,转基因拟南芥叶片出现萎蔫、黄化及局部坏死;转空载体拟南芥叶片症状较轻,野生型拟南芥仅有部分叶片出现黄化(图7B)。 接种后35 d 转基因株系的病情指数为82.8±3.8,比野生型拟南芥(56.1±2.0)和转化空载株系(53.3±0.1)的病情指数高(图7C)。 结果表明,超表达GhBZR1基因会使拟南芥对黄萎病的抗性减弱。

图7 GhBZR1 转基因拟南芥植物的筛选和黄萎病抗性检测Fig. 7 Screening and V. dahliae resistance of GhBZR1 transgenic Arabidopsis plants
3 讨论
BZR1 是BR 信号通路中的重要转录因子之一,是植物防御系统的1 种信号分子,可以诱导防御基因的表达抵御外界胁迫[25]。 启动子对基因的调控起重要作用,顺式元件的数量和种类都能影响基因的表达模式[26]。 生物信息学预测显示,GhBZR1基因的启动子有3 种与抗病原菌相关的顺式作用元件TC-rich repeats、ABRE 和MBSI,分别参与植物的防御和应激反应、响应脱落酸以及类黄酮生物合成基因的调控。 植物激素对植物自身的生长发育以及对外界坏境胁迫的响应至关重要[27]。 关于植保素的研究主要集中在类黄酮和萜类植保素,一般认为天然类黄酮化合物中的一些酚类物质具有抗细菌、抗真菌、抗病毒活性,用SA 处理接种链格孢菌(Alternaria alternate)的杏果, 能促进类黄酮和木质素等抗性物质的积累,从而提高杏果对黑斑病的抗性[28-29]。脱落酸介导的植物抗逆信号转导与许多基因的诱导表达有关,许多响应脱落酸的基因启动子区域都有1 个保守的ACGT 核心(G 盒)[30]。GhBZR1基因的启动子区域存在与抗病相关的顺式作用元件,表明该基因可能在激素信号转导及植物抗性中发挥重要作用。 系统发育树分析显示,GhBZR1 蛋白与海岛棉、雷蒙德氏棉中的同源蛋白相似度很高,推测该蛋白序列保守且广泛存在于各棉花品种中。
在抗黄萎病过程中,SA、JA 和乙烯是抗病性信号转导途径中的重要调节因子[31]。 SA 是1 种广泛存在于植物和细菌中的小分子酚类物质,参与植物生长发育的多个过程[32]。 目前的研究主要集中在SA 在植物免疫中的作用,SA 能够介导PTI 和效应子触发的免疫(Effector-triggered immunity,ETI)2 种植物免疫反应[33-34]。 JA 是一类脂肪酸的衍生物,在植物抗病中可作为信号分子,激活植物的防御系统,从而提高植物对病原体的抵抗力。JA 还可以通过与乙烯的协同作用增强植物的抗性。 有研究证实,在棉花中JA 信号通路参与对黄萎病菌的早期防御反应[35]。GhBZR1的表达能被外源SA、JA 诱导, 推测GhBZR1可能参与植物激素信号调控通路。 接种黄萎病菌之后,GhBZR1在感病品种中呈现上调表达趋势, 在抗病品种中则呈现下调表达的趋势,表明GhBZR1基因在抗病性不同的品种中的表达有差异,推测该基因的表达有利于黄萎病菌的侵入。
沉默感黄萎病陆地棉86-1 的GhBZR1基因,能增强其对黄萎病的抗性;超表达GhBZR1基因导致拟南芥对黄萎病的抗性减弱,加重叶片枯萎和死亡。亚细胞定位分析显示,GhBZR1 蛋白定位在细胞核,符合转录因子的特点[36]。 推测黄萎病菌侵染棉花时,GhBZR1 可能通过调控下游基因转录来实现抗病反应。
4 结论
本研究通过RACE 技术克隆得到GhBZR1基因,基因全长1 515 bp,编码313 个氨基酸。GhBZR1 蛋白由20 种氨基酸组成,无信号肽结构和跨膜结构,属于亲水性蛋白,具有BES1_N 超家族结构域,为转录因子,定位于细胞核。GhBZR1能被黄萎病菌、JA 和SA 诱导表达。 通过VIGS技术沉默GhBZR1能增强感病陆地棉86-1 对黄萎病的抗性;超表达GhBZR1基因使拟南芥对黄萎病抗性减弱。 综上,GhBZR1基因编码1 个负调控黄萎病抗性的转录因子。

